蝎素组分Ⅲ对THP1细胞HMGB1表达的影响①
2012-07-30朱琳琳牛志国宋向凤陈丽媛张晨光新乡医学院医学检验系新乡453003
朱琳琳 牛志国 宋向凤 陈丽媛 张晨光 王 辉 (新乡医学院医学检验系,新乡453003)
从传统动植物中药资源中开发抗肿瘤和抗炎症药物已成为当今研究的一个热点,生物毒素如蝎素等对肿瘤细胞的抑制作用日益受到研究者的关注。多项研究资料表明,蝎素可促进T淋巴细胞的转化和肿瘤坏死因子(TNF-α)的分泌,使用药量显著减少并可增强其它抗肿瘤药物的效应,蝎素组分Ⅲ(Scorpion venom crudeⅢ,SVC-Ⅲ)就是从河南马氏钳蝎素中分离纯化出来的一种活性成分[1]。高迁移率族蛋白B1(High mobility group box-1,HMGB1)是一种存在于真核生物细胞内的非组蛋白染色体结合蛋白,由单核巨噬细胞分泌或坏死组织释放,具有多种功能,参与基因转录、DNA修复、细胞外信号转导等多种重要生命过程,作为良性因子,可以促使骨髓细胞迁移至皮肤,促进表皮细胞的再生,作为不良因子,在肿瘤血管形成、抑制细胞凋亡、参与肿瘤侵袭中扮演重要角色[2,3]。截至目前,蝎素与 HMGB1对免疫细胞的作用机制尚未明确。本研究检测蝎素对人单核细胞系THP1细胞HMGB1的表达的影响,试图探讨蝎素对单核细胞免疫调节的机制、HMGB1参与细胞炎症反应的机制以及蝎素与HMGB1相互作用的关系,从而为蝎素在临床上的应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞系与质粒 人单核细胞系THP1细胞购自ATCC,pEGFP-N1荧光质粒由本实验中心保存。
1.1.2 主要试剂 RPMI1640培养液购自Gibco公司;胎牛血清购自杭州四季青公司;SVC-Ⅲ由新乡医学院分析测试研究室提供;转染试剂TfxTM-50 Reagent购自 Promega公司;Trizol试剂、Taq酶、DNA MarkerⅢ、质粒提取试剂盒均购自北京天根公司;反转录酶(M-MLV)购自TaKaRa公司;所用引物均为上海英骏生物公司合成;兔抗人HMGB1抗体、HRP标记羊抗兔IgG、内参β-actin抗体、化学发光试剂盒、BCA蛋白浓度检测试剂盒均购自江苏碧云天生物技术公司。
1.2 实验方法
1.2.1 RT-PCR检测HMGB1的表达 将处于对数生长期的THP1细胞离心收集,调细胞浓度为1×105ml-1,分装于24孔板。实验设空白对照组、0.1、1.0、10、100 ng/ml的 SVC-Ⅲ组,37℃ 5%CO2培养箱中培养48小时后收集细胞,提取细胞的总RNA,RT-PCR检测 HMGB1、GAPDH的 mRNA的表达,HMGB1引物序列为F:5'-GGCAAGCTTATGGGCAAAGGAGATCCTAA-3',R:5'-GGCGAATTCTTAATCATCATCATCACTT-3',产物长度 648 bp,退火 58℃;GAPDH引物序列为F:5'-GCGAGAGGAGCACAGATACC-3',R:5'-CTGATAGCCTGCTCCAGGTC-3',产物长度568 bp,退火58℃。电泳图片用 Band leader 3.0进行灰度分析,以目的片段条带灰度值与GAPDH灰度值的比值反映目的基因的表达量。
1.2.2 Western blot检测 HMGB1蛋白表达 设空白对照组、0.1、1.0、10、100 ng/ml的 SVC-Ⅲ组,37℃ 5%CO2培养箱中培养48小时后收集细胞,提取细胞的总蛋白,Western blot检测HMGB1、β-actin的蛋白表达情况,采用Quantity-one分析软件检测蛋白条带相对灰度值,分析目的蛋白相对表达量。
1.2.3 HMGB1-EGFP荧光融合蛋白表达质粒构建
以THP1的cDNA为模板,扩增HMGB1全长,Trizol试剂提取 THP1细胞总 RNA,RT-PCR扩增HMGB1,所用引物序列为F:5'-GGCAAGCTTTTCATCATCATCATCTTC-3',R:5'-GAAGATCTATGGGCAAAGGAGATCCTAA-3',HindⅢ和 EcoRⅠ双酶切后纯化的HMGB1片段与pFLAG-cmv2双酶切产物连接,转化后挑取阳性菌落增菌提取质粒双酶切鉴定,送上海英骏生物公司测序。
1.2.4 激光共聚焦检测HMGB1在细胞内的分布
实验设空白对照组、1.0 ng/ml的SVC-Ⅲ组,采用爬片的方法在24孔板中培养THP1细胞,细胞贴壁后,将0.5μg pEGFP-HMGB1转染入两组 THP1细胞,转染4小时后,实验组加入终浓度为1.0 ng/ml的SVC-Ⅲ,两组细胞培养48小时后DAPI染色,应用激光共聚焦显微镜(Laser scanning confocal microscope,LSCM)检测HMGB1在细胞中的分布情况。
2 结果
2.1 SVC-Ⅲ对 THP1细胞HMGB1 RNA水平表达的影响 0.1、1.0 ng/ml的 SVC-Ⅲ对 HMGB1 表达有促进作用(P <0.05),其中 1.0 ng/ml SVC-Ⅲ的促进作用最强,100 ng/ml SVC-Ⅲ则有明显抑制作用(P <0.05)。见图1。
2.2 SVC-Ⅲ对THP1细胞HMGB1蛋白水平表达的影响 与RNA结果一致,0.1、1 ng/ml的 SVC-Ⅲ对HMGB1蛋白表达有促进作用(P<0.05),其中1.0 ng/ml SVC-Ⅲ的促进作用最强,100 ng/ml SVC-Ⅲ则有明显抑制作用(P<0.05)。见图2。
2.3 HMGB1-EGFP荧光融合蛋白表达质粒构建将质粒转染入SGC7901细胞,激光共聚焦检测表达效果,绿色荧光非常明显。见图3。

图1 SVC-Ⅲ对HMGB1基因表达的影响Fig.1 Effect of SVC-Ⅲ on RNA expression of HMGB1
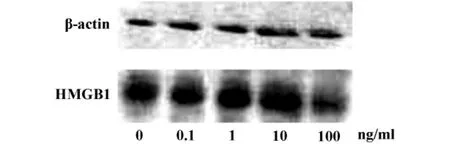
图2 SVC-Ⅲ对HMGB1蛋白表达的影响Fig.2 Effect of SVC-Ⅲ on protein expression of HMGB1

图3 激光共聚焦检测p EGFP-HMGB1的SGC7901细胞中的表达(×400)Fig.3 The expression of p EGFP-HMGB1 in SGC7901 detected by LSCM(×400)

图4 SVC-Ⅲ对THP1细胞HMGB1分布情况的影响(×400)Fig.4 Effect of SVC-Ⅲ on distribution of HMGB1(×400)
2.4 SVC-Ⅲ对THP1细胞HMGB1分布情况的影响HMGB1-EGFP荧光融合蛋白表达质粒转染后,激光共聚焦检测HMGB1表达分布情况:空白对照组,HMGB1存在于胞核中;1.0 ng/ml的 SVC-Ⅲ组,由于SVC-Ⅲ的刺激作用,HMGB1从胞核中转移入胞浆。见图4。
3 讨论
近年来,蝎素作为生物应答调节剂调节免疫系统功能的研究日益增多,它可以改善荷瘤机体细胞免疫功能的抑制状态,发挥抗肿瘤作用[1]。SVC-Ⅲ能够促进淋巴细胞的转化和肿瘤坏死因子的分泌,能以剂量依赖的方式调节Jurkat细胞中信号分子ZAP-70和LAT的表达[4]。HMGB1作为单核巨噬细胞分泌的细胞因子,其功能具有两面性。一方面可以引起骨髓细胞转移,促进表皮细胞再生,发挥其良性作用,另一方面还可以促进血管生成因子的分泌,参与肿瘤的转移和侵袭[5]。已有报道,HMGB1参与了肿瘤、自身免疫病、败血症等多种疾病的病理生理过程[6]。HMGB1是否可以成为抗炎抗肿瘤治疗的新的切入点,已成为目前的研究热点。
截至目前,蝎素与HMGB1对免疫细胞的作用机制尚未明确。本研究就以人单核细胞系THP1细胞为研究对象,应用不同浓度SVC-Ⅲ对其进行刺激,48小时后检测细胞HMGB1的表达。结果显示,0.1 ng/ml和1.0 ng/ml SVC-Ⅲ对 HMGB1 转录以及蛋白表达水平有明显的促进作用,其中1.0 ng/ml SVC-Ⅲ的促进作用最强,但随着浓度的增高,100 ng/ml SVC-Ⅲ则显示出抑制作用。除HMGB1之外,我们之前研究结果还表明0.1 ng/ml和1.0 ng/ml SVC-Ⅲ对THP1细胞p65、IKK1的表达也有促进作用,而100 ng/ml时则表现出明显的抑制作用[7]。
不同浓度SVC-Ⅲ对THP1细胞HMGB1 RNA与蛋白表达会产生不同的影响,本研究结果也已显示1 ng/ml SVC-Ⅲ可以刺激细胞产生大量的HMGB1,那么产生的HMGB1又是通过什么途径来对细胞产生功能影响呢?针对此,我们应用激光共聚焦技术,发现HMGB1作为核蛋白,在不受任何刺激的情况下,主要是存在于胞核内的,但接受SVC-Ⅲ刺激以后,HMGB1则从胞核转移入胞浆。这也印证了以往一些研究结果:HMGB1可由单核、巨噬细胞主动地分泌出细胞,当HMGB1位于细胞外时,可与晚期糖基化终产物受体、Toll样受体2和Toll样受体4等多种受体结合,从而诱导多种炎性因子的表达,发挥其生物学功能[8,9]。
总之,本研究表明SVC-Ⅲ能影响HMGB1的表达及在细胞内的转移,而且功能的发挥与其剂量关系密切。在临床应用中,如创伤修复的病人可以选择低浓度SVC-Ⅲ,从而升高其HMGB1水平,促进表皮细胞再生;而肿瘤等病人则可选择较高浓度SVC-Ⅲ,从而抑制其HMGB1表达,起到抗炎抗肿瘤的效果。本研究为蝎素在疾病治疗中的应用,提供了一定的理论依据,临床应用应根据具体病情以及治疗目的,选择适合的浓度,以期达到预期效果。
1 王 辉,董 珂,孙书明 et al.蝎素SVC-Ⅲ对荷瘤小鼠淋巴细胞转化及TNF-α水平的影响[J].细胞与分子免疫学杂志,2002;18(5):505-506.
2 Katsuto Tamai,Takehiko Yamazaki,Takenao Chino et al.PDGFRαpositive cells in bone marrow are mobilized by high mobility group box 1(HMGB1)to regenerate injured epithelia[J].Proc Natl Acad Sci USA,2011;108(16):6609-6614.
3 Ulloa L,Messmer D.High-mobility group box 1(HMGB1)protein:Friend and foe[J].Cytokine Growth Factor Rev,2006;17(3):189-201.
4 宋向凤,郭继强,白国强 et al.蝎素组分 对 Jurkat细胞 CCR5表达的影响[J].中国免疫学杂志,2009;25(3):221-222.
5 Tang D,Kang R,Zeh H J et al.High mobility group box 1 and cancer[J].Biochim Biophys Acta,2010;1799(12):131-140.
6 Sims G P,Rowe D C,Rietdijk S T et al.HMGB1 and RAGE in inflammation and cancer[J].Annu Rev Immunol,2010;28:367-388.
7 宋向凤,孙爱平,牛志国 et al.蝎素组分Ⅲ对THP1细胞NF-κB转录因子的影响[J].中国免疫学杂志,2011;27(1):34-36.
8 Park JS,Robertson F,He Q et al.High mobility group box 1 protein interacts with multiple Toll-like receptors[J].Am J Physiol Cell Physiol,2006;290(3):917-924.
9 Yan S F,Ramasamy R,Schmidt A M.Receptor for AGE(RAGE)and its ligands-cast into leading roles in diabetes and the inflammatory response[J].J Mol Med,2009;87(3):235-247.
