结核性脑膜炎和缺血性卒中脑梗死的MRI特点
2012-07-28李海斌敖国昆
董 莘 李海斌 敖国昆 秦 崇
结核性脑膜炎是最常见的亚急性和慢性脑膜炎[1]。其病理改变包括基底池的渗出、脑积水、肉芽肿和梗死。结核性脑膜炎的脑梗死可以发生在任何动脉供血区,但典型的累及穿支血管供应的基底节[2]。这是由于血管炎,血栓形成,机化渗出液导致的血管闭塞,缺血腔隙性脑梗死与结核性脑膜炎脑梗死的病理机制完全不同,通常位于豆状核,内囊后肢,外侧丘脑,主要归因于Willis环的横向穿支血管受累。据报道,结核性脑膜炎的腔隙性脑梗死更常向前累及尾状核外侧丘脑前方内囊膝部和内囊前肢[3]。许多结核性脑膜炎的患者可能同时并有缺血性中风和梗死的危险因素,这些患者可能不遵循这一规则。本文回顾性分析结核性脑膜炎和缺血性卒中基底节区脑梗死的分布特点。
1 资料和方法
1.1 一般资料
(1)2006年5月至2012年1月被诊断为结核性脑膜炎住院治疗的患者208例。结核性脑膜炎的诊断是根据临床,放射学和脑脊液的标准。临床标准包括感染证据以及脑膜刺激症状如发烧、头痛、喷射性呕吐、颈项强直等。排除病毒性、化脓性以及真菌性脑膜炎,其诊断高度怀疑为结核性脑膜炎。确诊标准包括脑脊液涂片或培养、聚合酶链式反应结核分枝杆菌阳性、Ig M酶联免疫吸附试验阳性,或符合以下3条标准者予以采用:①脑脊液细胞0.2×109/L,以淋巴细胞为主,细菌和真菌涂片或培养阴性,蛋白超过1 g/L;②MRI扫描显示有渗出、脑积水、脑梗塞、结核瘤的证据;③中枢神经系统以外的结核证据;④对抗结核治疗良好的反应。对于既往患脑血管病变者亦排除在本研究之外。78例患者有基底节区脑梗死纳入本研究,其中男性43例,女性35例;年龄8~69岁,平均年龄为29.6岁。
(2)同期有253例被诊断为基底节区缺血性脑梗死的患者在我院神经内科住院治疗。基底节区缺血性脑梗死的诊断标准为MRI显示基底节T2加权高信号,T1加权低信号,弥散加权成像高信号,病灶<1.5 cm,并有相应的临床症状。同时记录患者中风的危险因素,包括年龄、性别、吸烟史、高血压(血压≥140/90 mm Hg,或高血压病史、或药物治疗),糖尿病(空腹血糖>126 mg/dl,餐后2 h血糖≥200 mg/dl,或口服降糖药,或使用胰岛素),高脂血症(需要药物或饮食控制的血脂异常史)。其中47例患者因房颤、风湿性心脏瓣膜病等被排除在本研究之外。共206例纳入本研究,其中男性131例,女性75例,年龄46~79岁,平均年龄为59.6岁。
1.2 MR扫描方法
MR扫描采用Philips Intera 1.5T超导型磁共振仪,标准头部正交SENSE线圈。扫描方向为横断面、矢状面和冠状面。扫描参数为视野(FOV)230 mm,层厚5 mm,层距1 mm,矩阵256×256。常规扫描T1WI、T2 WI、FIAIR、DWI序列。T1WI采用自旋回波(SE)序列,TR=400~600 ms,TE=15~25 ms;T2 WI采用快速自旋回波(TSE)序列,TR=2000~4000 ms,TE=90~150 ms;FIAIR TR=6000 ms,TE=120 ms,TI2000 ms,DWITR=3071 ms,TEd=95 ms。横断面扫描范围自额窦上缘至颅底水平。增强扫描对比剂使用钆替酸葡甲胺(Gd-DTPA),静脉团注剂量0.1 mmol/kg,重复平扫层面行T1WI(参数同T1WI)横断面、矢状面、冠状面扫描。
1.3 统计学方法
所有数据采用SPSS 12.0统计软件进行统计学分析。计数资料比较使用x2检验。设定以P<0.05为差异有统计学意义。
2 结果
本组研究包括78例累及基底节区的结核性脑膜炎和206例缺血性卒中病例。缺血性卒中患者的年龄明显大于结核性脑膜炎(59.6岁和29.6岁,P<0.01),更频繁的合并高血压和高脂血症(x2=27.01,33.90;P<0.05)。人口统计学和临床参数见表1。

表1 结核性脑膜炎和缺血性卒中患者的人口统计学和危险因素
结核性脑膜炎腔隙性脑梗死累及尾状核29例(如图1所示);豆状核50例(如图2所示);内囊前、后肢和膝部分别是16例、16例和28例;丘脑前部和后部分别是24例和24例。缺血性卒中腔隙性脑梗死累及尾状核17例;豆状核138例;内囊前、后肢(如图3所示)和膝部分别是17例、61例和8例;丘脑前部和后部分别是25例和78例。

图1 结核性脑膜炎基底池、右侧外侧裂池结核性肉芽肿,右侧尾状核脑梗死
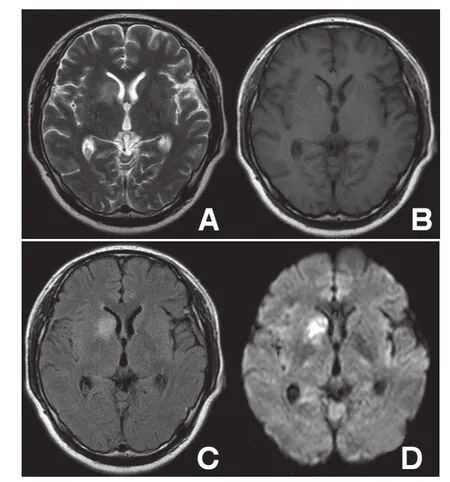
图2 结核性脑膜炎 右侧尾状核头部、豆状核及内囊前肢脑梗死
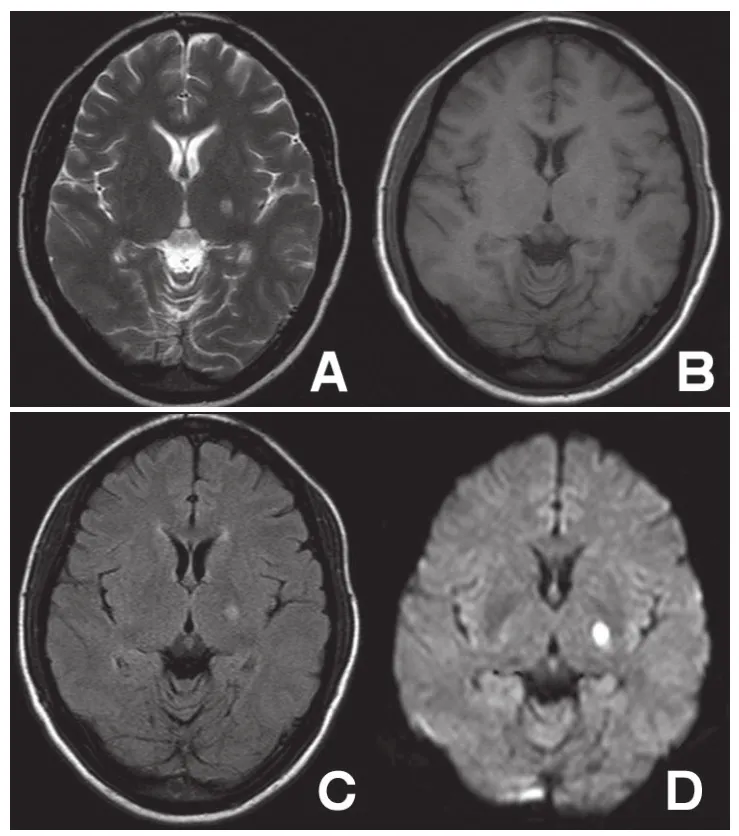
图3 缺血性卒中,左侧内囊后肢腔隙性脑梗死
结核性脑膜炎腔隙性脑梗死累及豆状核和内囊膝部明显高于缺血性卒中(x2=34.88,20.22;P<0.05)。详细分布见表2。
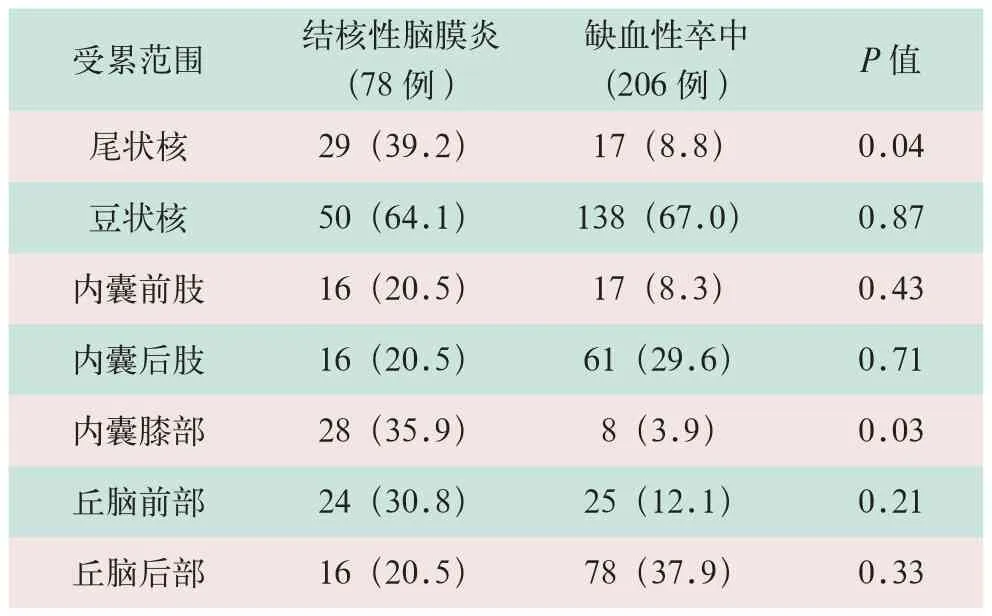
表2 结核性脑膜炎和缺血性卒中的腔隙性脑梗死的解剖位置分布
基底节区被分为前部和后部。前部包括尾状核、内囊前肢和膝部以及前内侧丘脑,相应的供血动脉为纹状体内侧动脉、丘脑结节动脉和丘脑穿动脉;后部包括豆状核、内囊后肢和后外侧丘脑,相应的供血动脉为纹状体外侧动脉、脉络膜前动脉和丘脑膝状体动脉[3-4]。
在结核性脑膜炎的腔隙性脑梗死患者中,有44例仅累及基底节区的前部,8例仅累及后部,26例为前、后部混合受累。在缺血性卒中的腔隙性脑梗死患者中,有25例仅累及基底节区的前部,148例仅累及后部,33例为前、后部混合受累, 详细分布见表3。
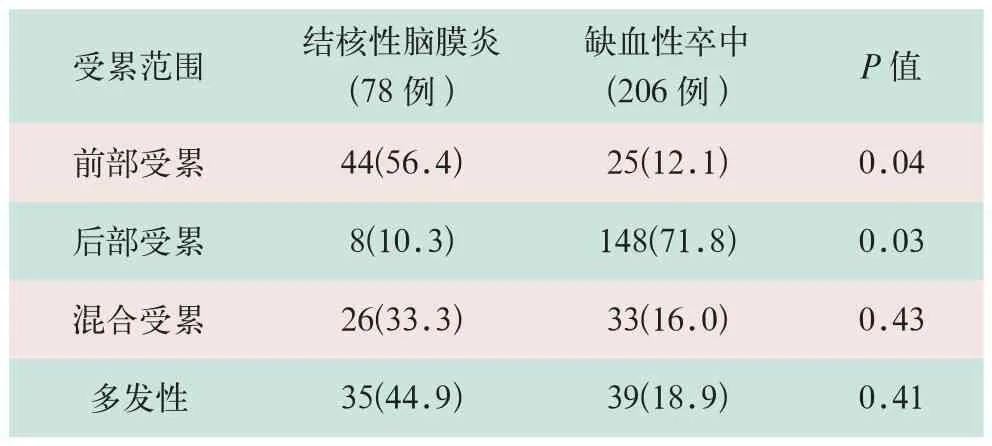
表3 结核性脑膜炎和缺血性卒中的腔隙性脑梗死的循环分布
结核性脑膜炎腔隙性脑梗死累及基底节区后部的34例中,26例有卒中危险因素,5例患有高血压,13例患有糖尿病,7例患有高脂血症,13例有吸烟史,12例年龄>45岁。提示在这些卒中还可能与同时存在的动脉硬化有关。尾状核和内囊膝部的腔隙性脑梗死似乎是结核性脑膜炎腔隙性脑梗死的特异表现。结核性脑膜炎腔隙性脑梗死中35例为多发性占44.9%(如图2、图4所示);而缺血性卒中腔隙性脑梗死患者中,39例为多发性占18.9%。
3 讨论
结核性脑膜炎的病理改变包括基底池的渗出、脑积水、肉芽肿和梗死。结核性脑膜炎的脑梗死可以发生在任何动脉供血区,但典型的是累及穿支血管供应基底节区[2]。缺血性卒中亦经常累及上述血管,二者均导致腔隙性脑梗死。在人口统计学和发病危险因素中,二者在性别、糖尿病史以及吸烟史方面无显著差别。结核性脑膜炎腔隙性脑梗死的发病年龄明显小于缺血性卒中(P<0.01),而缺血性卒中腔隙性脑梗死并有高血压和高脂血症基础者明显高于结核性脑膜炎(P<0.05)。

图4 结核性脑膜炎,左侧豆状核、内囊膝部以及右侧内囊后肢多发性脑梗死
研究显示,腔隙性脑梗死的分布特点相当典型。结核性脑膜炎主要表现为基底节区前部的腔隙性脑梗死(占89.7%),而缺血性卒中主要表现为后部的腔隙性脑梗死(占87.9%)。然而,许多患者表现为混合模式。结核性脑膜炎脑梗死的绝大多数位于尾状核、内囊前肢和丘脑,而罕见于较大的血管分布区和脑干[4]。一项针对40例成人结核性脑膜炎的研究显示,12例脑梗死患者,其中9例有症状,3例无症状;5例仅有腔隙性脑梗死,7例合并或不合并腔隙性脑梗死的较大血管分布区梗死。前循环梗死患者8例,后循环梗死患者1例,前、后循环梗死混合存在的患者3例[5]。另一项130例儿童结核性脑膜炎的研究显示,67例有脑梗死。梗死的位置分别为基底节55例,内囊41例,豆状核39例,尾状核35例,双侧基底节20例,丘脑21例,半球32例。多发性梗死45例[6-8]。
结核性脑膜炎发生脑梗死可能与以下机制有关:①穿行于脑底渗出物的血管被压迫、绞窄,发生血管炎,最终血栓形成导致了脑梗死[9-10];②脑膜炎性分泌物累及血管外膜,随后逐步侵犯整个血管壁,导致坏死性全动脉炎,继发血栓形成致血管闭塞[11];③已经受损的血管被扩大的侧脑室拉展,导致梗死[12]。
研究显示,结核性脑膜炎腔隙性脑梗死仅累及基底节区前部的为56.4%,仅累及后部的为10.3%;缺血性卒中腔隙性脑梗死仅累及基底节区前部的为12.1%,仅累及后部的为71.8%。二者的分布显著不同。Nair等[4]的研究结果显示,结核性脑膜炎腔隙性脑梗死仅累及基底节区前部的为33%;缺血性卒中脑腔隙性梗死仅累及基底节区和后部的为75%。本研究尽管与Nair等研究的患者年龄有差异,研究样本更大,但结果却惊人的相似。
本研究中的结核性脑膜炎腔隙性脑梗死患者,尾状核受累占39.2%,内囊膝部受累占35.9%,而缺血性卒中的尾状核和内囊膝部受累分别占8.8%和3.9%。提示尾状核和内囊膝部是结核性脑膜炎腔隙性脑梗死的易受累部位。另一个显著特点是腔隙性脑梗死的多发性,在结核性脑膜炎腔隙性脑梗死患者中,44.9%为多发性,而缺血性卒中则为18.9%。这些差异可以归因于疾病的病理、生理机制。结核性脑膜炎腔隙性脑梗死基底池的渗出、血管炎和血栓形成可能导致了Willis环的纹状体内侧动脉、丘脑结节动脉和丘脑穿动脉的闭塞。缺血性卒中是动脉粥样硬化的结果,是全身性的血管病变,但似乎更偏爱累及纹状体外侧动脉。Fisher[13]的报告显示,缺血性卒中的纹状体外侧动脉受累更常见。本研究中,在结核性脑膜炎腔隙性脑梗死累及基底节区后部的34例患者中,26例有卒中危险因素,提示这些卒中还可能与同时存在的动脉硬化相关。
4 结语
腔隙性脑梗死的分布取决于疾病的病理、生理机制。基底节区前部的受累,尤其是尾状核和内囊膝部,以及病变的多发性常提示结核性脑膜炎的可能性;而后部受累,多提示缺血性卒中的可能性。
[1]Dye C,Scheele S,Dolin P,et al.Consensus statement.Global burden of tuberculosis: estimated incidence,prevalence and mortality by country.WHO surveillance and monitoring project[J].JAMA,1999,282(7):677-686.
[2]Dastur DK,Dave UP.Further observations on the fine structure of blood vessels in neurotuberculosis:possible significance of vasculitis with proliferated basement membrane[J].Adv Neurol,1978,20:577-589.
[3]Hsieh FY,Chia LG,Shen WC.Locations of cerebral infarctions in tuberculous meningitis[J].Neuroradiology,1992,34(3):197-199.
[4]Nair PP,Kalita J,Kumar S,et al.MRI pattern of infarcts in basal ganglia region in patients with tuberculous meningitis[J].Neuroradiolo gy,2009,51(4):221-225.
[5]Chan KH,Cheung RT,Lee R,et al.Cerebral infarcts complicating tuberculous meningitis[J].Cerebrovasc Dis,2005,19(6):319-325.
[6]Andronikou S,Wilmshurst J,Hatherill M,et al.Distribution of brain infarction in children with tuberculous meningitis and correlation with outcome score at 6 months[J].Pediatr Radiol,2006,36(12):1289-1294.
[7]Kalita J,Misra UK,Ranjan P.Predictors of long-term neurological sequelae of tuberculous meningitis: a multivariate analysis[J].Eur J Neurol,2007,14(1):33-37.
[8]许国宇,李红,敖国昆,等.磁共振成像对结核性脑膜炎伴发脑梗死的诊断价值[J].中华临床医师杂志(电子版),2011(20):5939-5944.
[9]Hosoglu S,Ayaz C,Geyik MF,et al.Tuberculous meningitis in adults: an eleven-year review[J].Int J Tuberc Lung Dis,1998,2(7):553-557.
[10]Dastur DK,Lalitha VS,Udani PM,et al.The brain and meninges in tuberculous meningitis-Gross pathology in 100 cases and pathogenesis[J].Neurol Bombay,1970,18(2):86-100.
[11]Garg RK,Sharma R,Kar AM,et al.Neurological complications of miliary tuberculosis[J].Clin Neurol Neurosurg,2010,112(3):188-192.
[12]Bhagwati SN.Ventriculolateral shunt in tuberculous meningitis with hydrocephalus[J].J Neurosurg,1971,35(3):309-313.
[13]Fisher CM.Lacunes:Small,deep cerebral infarcts[J].Neurology,2011,77(24):2104.
