三七茎叶皂苷对大鼠离体心脏缺血/再灌注损伤的保护作用
2012-07-28任小宇孙桂波徐惠波孙晓波
任小宇,孙桂波,张 强,徐惠波,孙晓波
(1.黑龙江中医药大学药学院,黑龙江哈尔滨 150040;2.辽东学院医学院基础医学教学部,辽宁丹东 118003;3.中国医学科学院药用植物研究所,北京 100193;4.温州医学院,浙江温州 325035;5.吉林省中医药科学院,吉林长春 130011)
三七是五加科多年生人参属植物,具有止血祛淤、消肿止痛的功效。传统中医多以根入药。其主要活性成分为皂苷类成分。近年来因三七的价格增长过快,使以三七根茎为原料的制剂均出现成本难以控制、企业难以承受的局面。但市场对三七入药的产品需求却不断增加,因此,综合利用和开发三七各活性部位对充分研发和利用三七具有重要意义。三七茎叶是三七的活性部位。其主要活性成分三七茎叶皂苷(panex notoginsegnoside of the leaves,PnGL)属于达玛烷型三萜皂苷。与传统入药部位三七根皂苷相比,药理活性、作用相似[1],但所含化学成分却差别迥异。对三七茎叶的化学研究表明,其主要含有原人参二醇型皂苷,几乎不含原人参三醇型皂苷,这是与三七主根皂苷的最大不同点。另外,三七茎叶具有资源丰富、来源广泛、价格低廉的特点。利用三七茎叶皂苷,现在我们已开发了一种对脑血管疾病有治疗作用的五类新药,正在开展三期临床实验。进一步深入研究PnGL在心血管方面的药理作用对三七的综合利用开发具有重要意义。目前,文献报道表明,PnGL在镇静、抗炎等方面具有明显的药理活性[2-3],但其在心血管药理方面报道鲜见。本实验选用 Langendorff离体灌流技术,观察PnGL对离体大鼠心肌缺血/再灌注损伤模型的影响,旨在为PnGL的研究和开发及抗心肌缺血药物的探索提供实验依据。
1 材料与方法
1.1 动物 选用SPF级SD大鼠,♂,体质量330~380 g,由北京维通利华实验动物技术有限公司提供。合格证号:SCXK(京)2006-2009。
1.2 药品和试剂 PnGL:棕黄色粉末,由吉林省中医药科学院提供。临用前溶于K-H液中配成所需浓度。K-H液成分如下(g·L-1):NaCl 6.8912、NaHCO32.09、KCl 0.35015、KH2PO40.1606、GLU l.998、MgSO4·7H2O 0.2908、CaCl20.283,pH 7.4。地奥心血康,成都地奥制药集团有限公司生产,批号Z10910051。乳酸脱氢酶、肌酸激酶、SOD、MDA、GSH-Px试剂盒购自南京建成生物医学工程研究所。
1.3 仪器 美国Radnoti离体灌流系统;成都泰盟BL-420/820四道生理记录仪;天津奥特赛恩斯AP-01P型真空泵;梅特勒pH计。DY89-Π型电动玻璃匀浆机;MQX200型酶标仪;TGL-16高速台式冷冻离心机。
1.4 方法
1.4.1 离体心脏Langendorff灌流模型制备 SD大鼠经20%乌拉坦(腹腔注射)麻醉后,舌下静脉注射肝素钠(25 mg·kg-1)行肝素化。迅速开胸,取心脏,悬挂于Langendorff灌流装置上,以恒温(37℃),充二元氧(95%O2,5%CO2),K-H液持续逆流灌流,流速为10 ~15 ml·min-1。采用左心室内水囊传递压力测定心室内压,通过BL-420生物信号采集系统记录左室收缩曲线,计算左心室各项心功能指标,包括左室收缩压(LVSP)、左室发展压(LVDP)、左室内压最大上升速率(+dp/dtmax)、左室内压最大下降速率(-dp/dtmax)。
1.4.2 PnGL对缺血/再灌注损伤模型的影响 SD大鼠36只,随机分为6组(n=6),分别是空白对照组、模型组、阳性给药组(地奥心血康 70 mg·kg-1)、PnGL 低、中、高剂量组(20、40、80 mg·kg-1)。阳性给药组和PnGL给药组大鼠每日灌胃给药1次,连续给药7 d,空白对照组和模型组同时给予同体积生理盐水。末次给药60 min后,分离心脏置于Langendorff离体灌流装置上,各组心脏平衡15 min后,缺血/再灌注(I/R)组;阳性给药组(地奥心血康);PnGL低、中、高剂量组(20、40、80 mg·L-1),全心停灌25 min,再灌注 60 min,造成心肌缺血/再灌注损伤模型。正常对照组心脏平衡后持续灌流85 min。
1.5 检测指标
1.5.1 血流动力学指标的测定 在左心耳根部剪一小口,从此处插入球囊(接BL/420信号采集系统)至左心室记录血流动力学指标,实时记录血流动力学指标:LVSP、LVDP、±dp/dtmax、HR。
1.5.2 冠脉流出液中LDH、CK的测定 再灌注60 min时取灌流液于-80℃冻存待测。标本收集后用生化试剂盒测定其活性。
1.5.3 心肌组织中 SOD、GSH-Px活性、MDA 含量及LDH,CK活性检测 灌流完毕后取下心脏,于-80℃冻存,标本收集后用相应生化试剂盒测定其活力和含量。
1.6 病理组织学观察心肌损伤程度 取出心脏,用4%多聚甲醛液固定,制成石蜡切片,从心尖至心底连续切片,HE染色,光学显微镜下观察。
Tab 1 Effects of PnGL on isolated cardiac function recovery rate(reperfusion for 60min)in rats(±s,n=6)
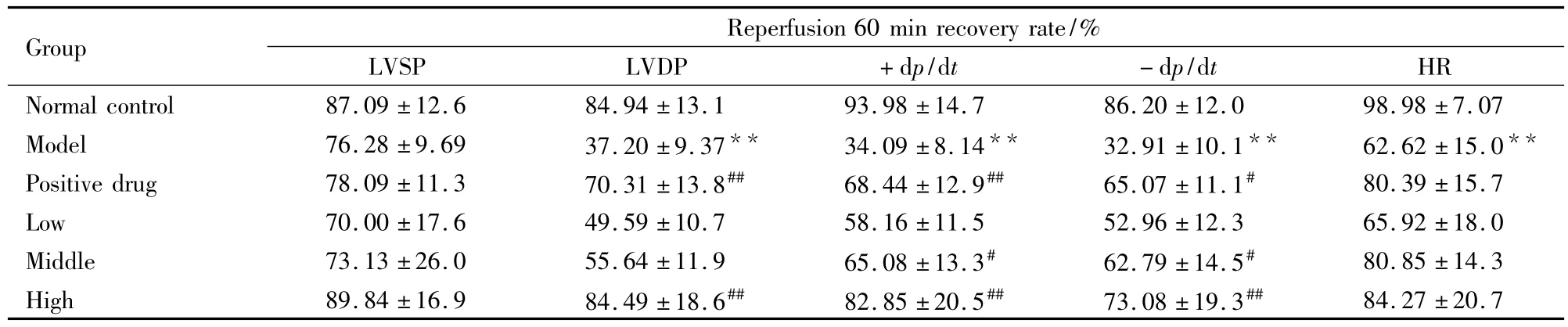
Tab 1 Effects of PnGL on isolated cardiac function recovery rate(reperfusion for 60min)in rats(±s,n=6)
**P<0.01 vs normal;#P<0.05 vs model
Group Reperfusion 60 min recovery rate/%LVSP LVDP +dp/dt -dp/dt HR Normal control 87.09 ±12.6 84.94 ±13.1 93.98 ±14.7 86.20 ±12.0 98.98 ±7.07 Model 76.28 ±9.69 37.20 ±9.37** 34.09 ±8.14** 32.91 ±10.1** 62.62 ±15.0**Positive drug 78.09 ±11.3 70.31 ±13.8## 68.44 ±12.9## 65.07 ±11.1# 80.39 ±15.7 Low 70.00 ±17.6 49.59 ±10.7 58.16 ±11.5 52.96 ±12.3 65.92 ±18.0 Middle 73.13 ±26.0 55.64 ±11.9 65.08 ±13.3# 62.79 ±14.5# 80.85 ±14.3 High 89.84 ±16.9 84.49 ±18.6## 82.85 ±20.5## 73.08 ±19.3##84.27 ±20.7
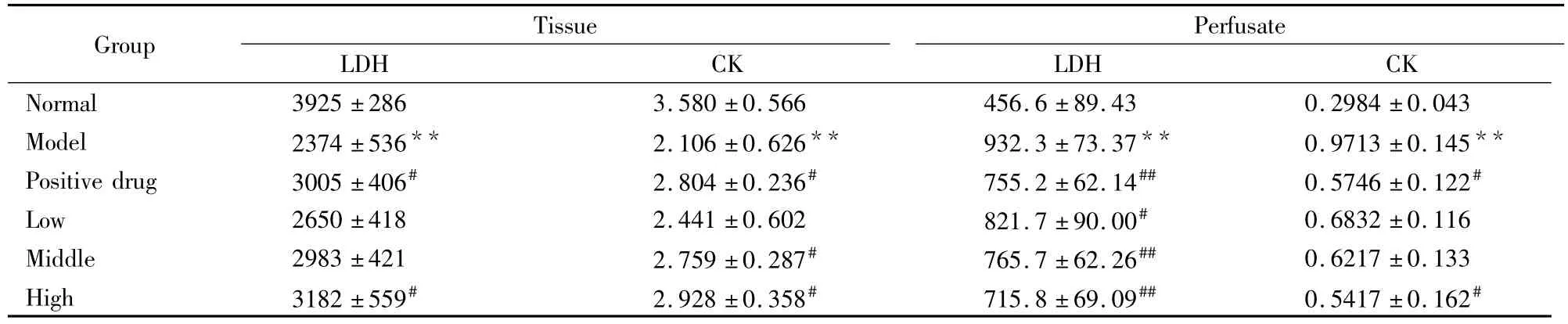
Tab 2 Effect of PnGL on LDH and CK release in perfusate and myocardial tissue after I/R injury
2 结果
2.1 PnGL对大鼠离体缺血/再灌注心肌血流动力学的影响 各组大鼠离体心脏在I/R前平衡时血流动力学指标差异无统计学意义。再灌注60 min时,与空白组比较,模型组LVDP、±dp/dtmax明显下降(P<0.05)。与模型组比较,阳性给药组、PnGL高、中剂量组上述指标均有明显改善。提示:PnGL可明显改善受损心肌的舒缩功能,降低I/R损伤对心肌舒缩功能的抑制作用。见Tab 1。
2.2 PnGL对大鼠离体缺血/再灌注心脏组织和冠脉流出液中LDH、CK活性的影响 与空白组比较,模型组心肌组织中LDH、CK的活性明显降低,差异具有显著性(P<0.05);而灌流液中LDH、CK的活性明显增高,差异具有显著性(P<0.05)。与模型组比较,阳性药组再灌注后60 min组织中LDH、CK活性增高(P<0.05);灌流液中LDH、CK活性降低(P<0.05)。PnGL高、中、低3个剂量组再灌注后60 min组织中LDH、CK活性增高(P<0.05);灌流液中LDH、CK活性降低(P<0.05)。提示PnGL通过增强心肌细胞膜稳定性而降低缺血/再灌注心肌的损伤,发挥保护心肌的作用。结果见Tab 2。
2.3 PnGL对离体大鼠缺血/再灌注心肌组织SOD、GSH-Px活性和MDA含量的影响 与空白组比较,缺血/再灌注模型组心肌组织中SOD、GSHPx活性下降(P<0.01),MDA含量增加(P<0.01)。与模型组比较,阳性给药组和PnGL中、高两个剂量组 SOD、GSH-Px活性增加,MDA含量降低,并呈一定量效关系,差异具有统计学意义(P<0.05)。提示PnGL可提高缺血/再灌注心肌组织中SOD、GSH-Px活性、降低MDA含量,增强心肌的抗氧化能力。见Tab 3。
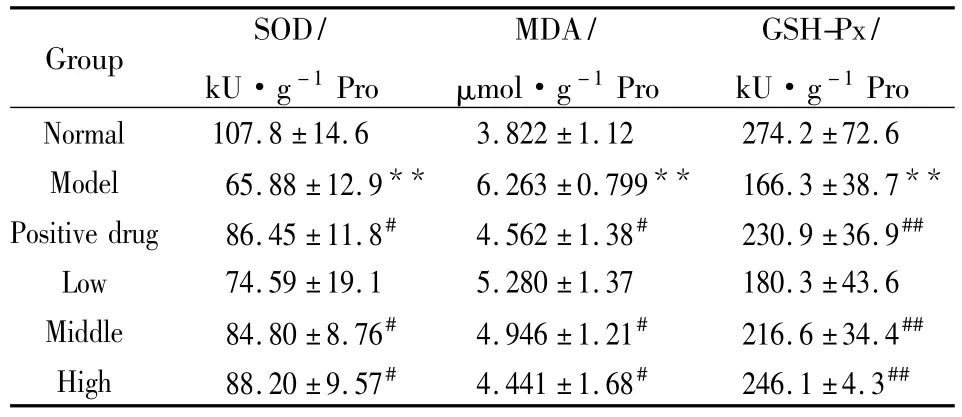
Tab 3 Effects of PnGL on the content of MDA,SOD and GSH-Px activities in myocardial tissue after I/R
2.4 HE染色光学显微镜观察心肌结构 显微镜下观察:正常对照组:心肌组织结构基本无异常,心肌细胞排列比较整齐,横纹比较清楚(Fig 1A)。I/R组:心肌纤维排列紊乱,出现多处断裂,间质增宽、水肿,局部呈现波浪形,可见多处变性坏死灶,程度较重,胞质有溶解现象,坏死心肌肌浆呈嗜伊红染的条带或斑块,心肌纤维间可见大量炎细胞浸润(Fig 1B)。阳性给药组:心肌纤维排列紊乱,可见变性坏死灶,但程度较轻,心肌纤维间可见少量炎细胞浸润(Fig 1C)。PnGL高剂量组:可见轻度心肌纤维变性坏死灶,心肌纤维间可见少量炎性细胞浸润(Fig 1D)。
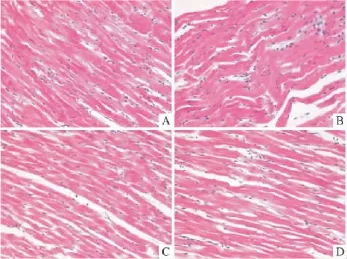
Fig 1 Effect of PnGL on isolated myocardial ischemia-reperfusion injury of rats (HE×400)
3 讨论
心肌缺血/再灌注可造成多种损伤后果,包括心脏舒缩功能抑制、细胞膜受损、心肌组织坏死等,其机制涉及自由基损伤及炎症反应等[4]。
本实验结果显示,心肌缺血/再灌注60min后,模型组心肌舒缩功能严重受限,LVSP、LVDP、±dp/dt均明显下降。PnGL预防性给药后,高剂量组心功能上述指标恢复明显、效果显著。心肌缺血/再灌注损伤可通过多种因素造成心肌细胞破损,细胞膜通透性增加,继而使细胞内的标志性心肌酶LDH、CK外漏致血清或灌流液中,同时造成心肌组织内酶活性降低[5]。本实验酶学指标显示,PnGL高剂量组酶学改变明显减轻(LDH、CK,P<0.05),提示预先给药PnGL可提高心肌细胞膜的稳定性,减少酶的外漏,继而有效的保护心肌细胞。
心肌缺血/再灌注过程中大量氧自由基的生成是引起心肌缺血/再灌注损伤的主要机制之一[6]。大量的氧自由基生成可引起多种生物靶点的损伤,如蛋白质、DNA、脂质等,并可通过过氧化反应造成严重的生物膜损害,以及后续的细胞损伤或者死亡[7-9]。机体存在 SOD、谷胱甘肽过氧化物酶(GSH-Px)等内源性抗氧化防御系统。SOD能催化超氧自由基歧化为过氧化氢,继而在GSH-PX作用下使过氧化氢降解为水和氧气[10]。MDA的含量常常可反映机体内的脂质过氧化的程度,间接反映心肌细胞受自由基攻击的严重程度和细胞损伤的程度[11]。抗氧化系统防御能力的增强有利于减轻组织氧化损伤,能有效保护组织细胞。PnGL可提高心肌组织中SOD、GSH-Px活性,降低MDA含量。表明PnGL可能通过清除氧自由基起到保护心肌的作用。
研究发现,早期炎症反应是加重心肌损伤的重要因素之一[12]。另外,能否缩小心肌坏死面积或减轻心肌坏死程度是评价药物对缺血性心肌病疗效的重要指标。本实验HE染色结果显示,模型组心肌组织结构紊乱,可见多处变性坏死灶,胞质出现溶解,程度较重,心肌纤维间可见大量炎细胞浸润。预防性给予PnGL后,与模型组比较,PnGL高剂量组心肌组织结构紊乱现象明显减轻,断裂、弯曲现象减少。坏死灶明显缩小,坏死程度明显减轻。间质中炎细胞浸润明显减少,炎症反应明显减弱。染色结果表明,预防性给予PnGL对缺血/再灌注心肌组织具有明显的保护作用。
综上所述,预防性给予PnGL能减轻心肌再灌注所造成的多种损伤,其对心肌组织的保护作用可能是多方面的。既可减轻由缺血/再灌注导致的心功能抑制,减少标志性心肌酶的释放,又可降低心肌组织变性坏死程度,减少炎细胞的浸润。其保护机制部分可能与抗自由基损伤有关,但其确切的作用机制有待于多方面、多层次的深入研究,尤其是研究其对抗心肌缺血/再灌注损伤的作用靶点及相关的信号通路,将对进一步揭开PnGL心肌保护的作用机制具有重要意义。
[1] 周家明,崔秀明,曾鸿超,等.三七茎叶的综合开发利用[J].现代中药研究与实践,2009,23(3):32.
[1] Zhou J M,Chui X M,Zeng H C,et al.Comprehensive development and utilization of Panax notoginsegnoside of leaves[J].Res Pract Chin Med,2009,23(3):32.
[2] 叶豆丹.三七叶的临床应用[J].长春中医药大学学报,2007,23(4):104.
[2] Ye D D.Clinical application of Panax notoginsegnoside of leaves[J].J Changchun Univ Tradit Chin Med,2007,23(4):104.
[3] 李淑惠,李晓辉,张海港,等.三七叶皂苷抗炎作用机理的实验研究[J].哈尔滨商业大学学报,2002,18(1):30-2.
[3] Li S H,Li X H,Zhang H G,et al.Experimental study of anti-inflammatory mechanism of Panax notoginsegnoside of leaves[J].J Harbin Univ Commer,2002,18(1):30 -2.
[4] 栾荣华,马梃光,区晋禧,等.降钙素基因相关肽对阿霉素心肌细胞毒性的保护作用[J].中国药理学通报,1998,14(3):29-31.
[4] Luan R H,Ma T G,Ou J X,et al.The protective role of calciton in gene related peptide against adriamycin-induced acute cadiotoxicity in cultured myocardial cells[J].Chin Pharmacol Bull,1998,14(3):29-31.
[5] Kaur H,Parikh V,Sharma A,Singh M.Effect of amiloride A Na+/H+exchange inhibitor on cardioprotective effect of ischaemic preconditioning:possible involvement of resident cardiac mast cells[J].Pharmacol Res,1997,36(2):95 -102.
[6] Rajadurai M,Stanely Mainzen Prince P.Preventive effect of naringin on lipid peroxides and antioxidants in isoproterenol-induced cardiotoxicity in Wistar rats:biochemical and histopathological evidences[J].Toxicology,2006,228(2-3):259 - 68.
[7] Duranteau J,Chandel N S,Kulisz A,et al.Intracellular signaling by reactive oxygen species during hypoxia in cardiomyocytes[J].Biol Chem,1998,273(19):11619-24.
[8] Hensley K,Robinson K A,Gabbita S P,et al.Reactive oxygen species,cell signaling,and cell injury[J].Free Radical Biol Med,2000,28(10):1456-62.
[9] Basaga H S.Biochemical aspects of free radicals[J].Biochem Cell Biol,1990,68(7-8):989 -98.
[10]张荣沭,沈雅香,苗 术,等.槲寄生黄酮苷对大鼠心肌缺血/再灌注损伤保护作用[J].中国医院药学杂志,2010,30(12):1001.
[10] Zhang R S,Shen Y X,Miao S,et al.The protective role of Mistletoe flavonoid glycosides on myocardial ischemia-reperfusion injury in rat[J].Chin J Hosp Pharm,2010,30(12):1001.
[11]呼敏凤,尚立芝,韦大文.川芎嗪预处理对心肌缺血/再灌注损伤大鼠保护作用的实验研究[J].上海中医药杂志,2008,42(4):66.
[11] Hu M F,Shang L Z,Wei D W.The protective role of ligustrazine pretreatment on on myocardial ischemia-reperfusion injury in rat[J].Shanghai J Trad Chin Med,2008,42(4):66.
[12] Entman M L,Youker K A,Frangogiannis N,et al.Is inflammartion good for the ischemic heart-perspectives beyond the ordinary[J].Z Kardiol,2000,89(Suppl 9):I X/82 -7.
