左旋多巴甲酯对剥夺性弱视猫视皮层17区神经细胞的影响
2012-07-28张士军蒋伟哲黄仁彬
黎 荣,梁 韬,林 兴,张士军,蒋伟哲,黄仁彬
(广西医科大学药学院,广西南宁 530021)
弱视对儿童视力影响很大,若不采取及时的治疗将会导致终身视力缺陷。国外研究表明神经生长因子在具有调节视觉发育可塑性的作用[2-3]。即刻早期基因c-fos的表达产物FOS蛋白同样参与了视皮层相关区域神经元功能活动的调控,从而与视觉发育的可塑性密切相关[4-5]。目前国外临床上多采用左旋多巴治疗弱视,文献报道其已取得了一定效果[6-7]。而新合成的化学物质左旋多巴甲酯(LDME)将应用于弱视治疗研究。
本研究采用TUNEL检测法和免疫组织化学法检测观察左旋多巴甲酯(LDME)对剥夺性弱视猫视皮层17区中细胞凋亡情况以及NGF、FOS阳性神经元的形态变化和数量分布的影响,探讨左旋多巴甲酯对弱视神经细胞的影响及治疗效果,从而为弱视的预防和治疗奠定基础。
1 材料与方法
1.1 主要仪器 包埋机:Japan Sakura finetechnical Co.Ltd,4590 Model;低温高速离心机:德国西门子公司Gel doc 2000;病理组织切片机:Germany Leitz,2235 Model;病理图像分析仪:Germany Leica Co.Ltd,DMR+550 Model。
1.2 主要试剂 NGF-β蛋白抗体:武汉博士德公司,批号:3574102;FOS蛋白抗体:北京中杉金桥生物技术有限公司,批号:27261;DAB显色试剂盒:北京中杉金桥生物技术有限公司,批号:673767A;TUNEL检测试剂盒:德国 Roche公司,批号:110684817910;二抗:上海长岛生物技术有限公司,中国;麻醉剂:体积分数为0.25乌拉坦;灌注液:NS;4℃体积分数为0.04多聚甲醛;缓冲液:30 g·L-1,柠檬酸,2 × SSC,0.5 mol·L-1PBS;5 g·L-1多聚赖氨酸。
1.3 实验动物模型建立 初生家养幼龄猫(2周龄)30只,体质量约300~320 g,♀♂不分,常规检查双眼无异常。随机分为6组(每组5只):左旋多巴甲酯高剂量组(LDMEH)、中剂量组(LDMEM)、低剂量组(LDMEL)、阳性对照组(PC)正常组(NC)、模型组(MC)。除正常组之外,于 4周龄时参照Hubel[1]经典实验方法对各组幼猫进行的左眼上下睑缝合建立剥夺性弱视模型,在12周后打开缝合眼并开始结药。每天灌胃左旋多巴甲酯20,40,80 mg·kg-1,阳性组为左旋多巴 40 mg·kg-1,正常组与模型组为等剂量生理盐水,每天1次,持续30 d。动物饲养在符合医学实验动物环境设施要求的条件中。
1.4 实验动物的取材 在给药后d 31时,腹腔注射适量的体积分数为0.25乌拉坦进行深度麻醉,将插管插入左心室后切开右心房形成出路,与此同时用动脉夹夹住下腔静脉血管,此做法有利于增加清洗脑的灌注流量,接着先快速灌注4℃生理盐水250 ml,再灌注体积分数为0.04多聚甲醛500 ml。打开头颅取脑,根据Snider猫立体定向图谱,分离出对应的视皮层17区,浸入体积分数为0.04的多聚甲醛液中后固定6 h,经常规逐级脱水,二甲苯透明后,浸蜡包埋,切片厚度为6 μm,以上标本全部置于适当的保存,然后进行Nissl染色、TUNEL检测以及NGF、FOS免疫组织化学实验。所有染色过程均按照厂家试剂盒使用说明进行。
1.5 统计学处理 细胞胞质呈棕黄色或棕褐色为免疫阳性细胞。每张切片在视皮质Ⅱ/Ⅲ、Ⅳ、Ⅴ、Ⅵ层分别随机选取不重叠的5个等长度的视野进行计算机显微图像分析,计算每个视野中的凋亡细胞表达计数和阳性细胞数,取其平均值后换算成阳性细胞的密度。采用SPSS13.0软件,对各组凋亡细胞计数比较采用单因素方差分析,组间均数差异的两两比较采用LSD-t检验以及各组间免疫阳性细胞数比较进行两样本t检验。
2 结果
2.1 Nissl染色光镜观察结果 经Nissl染色后的视皮层神经元的Nissl小体呈深蓝色,细胞核淡蓝色。低倍镜下,正常幼猫视皮层的Nissl染色标本上可以区分为4层:分子层(Ⅰ)、外层(Ⅱ/Ⅲ)、颗粒层(Ⅳ)及内层(Ⅴ/Ⅵ ),相应层细胞排列规则,神经细胞形态和染色正常。Nissl染色在于显示视皮层的基本神经细胞结构,并可作为免疫组织化学分层计数的基础。见Fig 1。
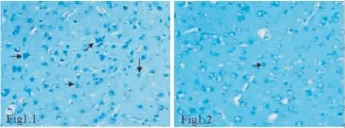
Fig 1 Structural feature in the visual cortex area 17 in the cats of normal and model control groups(Nissl staining,×400)
2.2 左旋多巴甲酯对剥夺性弱视猫左侧视皮层17区中细胞凋亡的影响 在光镜下观察到TUNEL阳性细胞呈棕褐色,给药组视皮层在相同时期内表现出不同剂量下的治疗效价。与模型对照组比较,给药各组的视皮层17区凋亡细胞数量均有不同程度的减少。其中LDMEH表现出明显的抗凋亡的效果,差异有统计学意义(P<0.01)。给药各组都对左侧视皮质17区神经细胞有着一定程度的抑制凋亡作用,差异均有统计学意义(P<0.01或P<0.05)。见 Tab 1、Fig 2。
Tab 1 Density of TUNEL positive cells in layers and divisions of the left 17 area of visual cortex in normal and monocular deprivation cats(±s,n=5,cell·mm-2)

Tab 1 Density of TUNEL positive cells in layers and divisions of the left 17 area of visual cortex in normal and monocular deprivation cats(±s,n=5,cell·mm-2)
*P<0.05,**P<0.01 vs NC;#P<0.05,##P<0.01 vs MC.(One-Way ANOVA,LSD-t test)
Group Ⅱ/Ⅲ Ⅳ Ⅴ Ⅵ0.000 0.000 0.001 0.001 NC 22±5 18±4 25±7 12±2 MC 236±42** 190±28** 278±34* 163±26*PC 64±19# 58±16# 55±11# 46±17#LDMEL 104±30# 91±22 124±33 78±19#LDMEM 59±23# 45±14## 41±16## 39±15#LDMEH 31±8## 23±11## 28±13## 20±6##F 35.673 38.405 39.795 34.763 P
2.3 左旋多巴甲酯对剥夺性弱视猫左侧视皮层17区NGF的影响 光镜下观察到胞质呈棕褐色为阳性细胞,各组剥夺侧视皮层17区中NGF阳性细胞的分布基本相同,表现为计数细胞密度(ND)的不同。与模型对照组比较,LDME给药组NGF免疫阳性细胞数量在各层有所增加,层间的差异有统计学意义(P<0.01或P<0.05)。与阳性对照组比较,同剂量给药的LDMEM阳性细胞数多于左旋多巴阳性组,提示LDMEM发挥了较好治疗作用,但LDMEM低于LDMEH或正常对照组,差异均未见统计学意义。见 Tab 2、Fig 3。
2.4 左旋多巴甲酯对剥夺性弱视左侧猫视皮层17区FOS蛋白的影响 光镜下观察到正常幼猫视皮层17区中的FOS阳性细胞为淡棕黄色。模型对照组视皮层17区中FOS阳性细胞表达较少,较正常组其数量明显降低,差别有统计学意义(P<0.01或P<0.05)。其中LDMEH阳性细胞数量高于模型对照组,差异有统计学意义(P<0.01)。但与正常对照组比较,LDMEH的FOS免疫阳性细胞数量在各层均少于正常组对照组,两者间差异无统计学意义。提示它们之间有一定的量效关系。见Tab 3、Fig 4。
3 讨论
近年来研究发现,视觉发育敏感期内的可塑性与多种细胞功能调节因子间有密切联系,其中的神经生长因子(NGF)可促进神经细胞的修复,在视觉发育的可塑性方面有着重要作用[8-9]。
Tab 2Density of expression of NGF positive cells in layers of the left 17 area of visual cortex(±s,n=5,cell·mm-2)

Tab 2Density of expression of NGF positive cells in layers of the left 17 area of visual cortex(±s,n=5,cell·mm-2)
*P<0.05,**P<0.01 vs NC;#P<0.05,##P<0.01 vs MC
Group Ⅱ/Ⅲ Ⅳ Ⅴ ⅥNC 418.45±62.38 532.56±48.22 335.87±41.68 423.57±35.61 MC 147.57±45.13** 185.47±28.63** 105.78±26.75* 153.24±47.65*PC 246.89±46.74# 348.19±35.28# 181.56±42.53# 232.89±43.76#LDMEL 218.16±42.29# 305.37±34.48# 143.24±51.87 220.28±41.52 LDMEM 252.24±47.35# 350.21±39.86## 208.57±32.45## 245.57±43.37##LDMEH 389.46±45.68## 512.43±36.55## 331.41±28.65## 398.42±35.41#
Tab 3 Density of expression of FOS positive cells in layers of the left 17 area of visual cortex(±s,n=5,cell·mm-2)

Tab 3 Density of expression of FOS positive cells in layers of the left 17 area of visual cortex(±s,n=5,cell·mm-2)
*P <0.05,**P <0.01 vs NC;#P <0.05,##P <0.01 vs MC
Group Ⅱ/Ⅲ Ⅳ Ⅴ ⅥNC 381.44±41.47 369.44±43.36 285.66±39.58 317.67±36.52 MC 138.78±38.99** 119.67±25.03** 84.78±12.76* 98.11±17.46*PC 215.87±36.32# 208.89±36.74# 112.65±41.52# 159.89±23.87#LDMEL 207.31±24.37 198.02±30.26# 98.25±20.87 135.26±21.32 LDMEM 226.89±38.97## 214.26±48.35# 121.46±24.57## 167.68±24.25##LDMEH 357.58±35.46## 325.43±46.65## 268.43±26.65## 296.32±35.34##

Fig 2 Apoptosis index in the visual cortex area 17 (TUNEL staining,×100)
在细胞水平上,经左旋多巴和左旋多巴甲酯治疗后,弱视视皮层17区神经细胞愈合恢复正常,表现为Nissl小体数量增加,说明了左旋多巴甲酯能促进神经细胞的修复。在基因水平上,TUNEL法检测准确反映了弱视发生后视皮层17区神经细胞凋亡时断裂DNA的形态和生化特征,而在药物治疗后能够有效减少细胞凋亡的发生,表现为抗细胞凋亡作用。实验表明在相等或较大的剂量下,左旋多巴甲酯的治疗效果高于左旋多巴,其原因为左旋多巴甲酯脂溶性优于左旋多巴,在相同条件下能更多通过血脑屏障,提高脑内dopamine浓度。在视皮层17区中存在着多巴胺通路,它可直接参与关键期视皮层的发育,也可介导调节某些关键因子的活性,使发生早期类凋亡的视皮层神经元得到恢复或重塑[10-11]。所以推测:给予左旋多巴甲酯治疗后,弱视眼视皮层l7区中神经细胞由于dopamine浓度的补足解除了在“废用”状态中NGF的活性,促使其自身合成和释放,进而参与相关的蛋白酶及基因表达调控,恢复神经细胞的可塑性。

Fig 3 NGF expression in visual cortex area 17(immunohistochemical staining,×400)

Fig 4 FOS expression in visual cortex area 17(immunohistochemical staining,×400)
同样,有研究认为c-fos基因的表达与神经细胞的可塑性相关,而不仅仅将其表达情况视为神经兴奋性活动水平[12-13]。c-fos基因产物FOS蛋白进入细胞核,和Jun家族的产物结合形成AP-1转录因子,该活性因子与相关DNA序列结合作为大多数基因的启动子,实行对其它基因的调控后进行神经细胞的重塑[14]。故推测:给予左旋多巴甲酯后弱视眼视皮层l7区相应区域的dopamine含量增多,dopamine直接介导调节N-甲基-天冬氨酸(NMDA)受体的活性,诱导c-fos基因表达,FOS蛋白合成增加后参与该区的生化调控,从而提高神经细胞兴奋性和降低其功能阈,恢复视觉功能。
综上所述,在一定范围内剥夺性弱视猫接受左旋多巴甲酯治疗后,发挥着抗细胞凋亡作用以及重塑了弱视发生后的神经细胞,故左旋多巴甲酯可作为潜在的治疗弱视药物,本研究为其今后临床应用提供重要的基础理论。
[1] Hubel D H,Wiesel Y N.The period of susceptibility to the physiological effects of unilateral eye closure in kittens[J].Physiol,1970,206(2):419-36
[2] Tanaka S,Tani T,Ribot J,et al.A postnatal critical period for orientation plasticity in the cat visual cortex[J].PLoS ONE,2009,4(4):1-10.
[3] Domnenici L,Fontanesi G,Cattanco A,et al.Nerve growth factor(NGF)up take and transport following injection in the developing rat visual cortex[J].Vision Neurosci,1994,11(6):1093-102.
[4] Leszek K.Sensory regulation of immediate-early gene expression in mammalian visual cortex:implications for functional mapping and neural plasticity[J].BrainRes Brain Res Rev,1997,23(3):237-56.
[5] 李勇文,林 兴,张士军,等.左旋多巴甲酯对斜视性弱视猫模型的作用[J].中国药理学通报,2010,26(1):70-3.
[5] Li Y W,Lin X,Zhang S J,et al.Effects of L-dopa methyl ester on the strabismic amblyopia cats[J].Chin Pharmacol Bull,2010,26(1):70-3.
[6] Leguire L E,Walson P D,Roger G L,et al.Levodopa/carbidopa treatment for amblyopia in older children[J].Pediatr Ophthalmol Strabismus,1995,32(3):143-51.
[7] Razeghinejad M R,Rahat F,Bagheri M.Levodopa-carbidopa may improve vision loss in indirect traumatic optic neuropathy[J].Neurotrauma,2010,27(10):1905-9.
[8] Madduri S,Papaloïzos M,Gander B.Synergistic effect of GDNF and NGF on axonal branching and elongation in vitro[J].Neurosci Res,2009,65(1):88-97.
[9] Hannila S S,Kawaja M D.Nerve growth factor mediated collateral sp routing of central sensory axons into deafferentated of the dorsal hom is enhanced in the absence of the p75 neurotrophin in receptor.[J].Comp Neurol,2005,486(4):331-43.
[10]Reis R A M,Ventura A M,Kubrusly R C,et al.Dopaminergic signaling in the developing retina[J].Brain Res Reviews,2007,54(1):181-8.
[11] Kuleshova E P,Zaleshin A V,Sidorina V V,Merzhanova G Kh.Effects of blokade of the dopaminergic D1/D2 receptors on the single and network neuronal activity in the frontal and visual cortices and behavior of cats[J].Zh Vyssh Nerv Deiat Im I P Pavlova,2010,60(3):309-20.
[12]刘 珏,陈 剑,周 清,等.c-fos蛋白在单眼斜视性弱视成年大鼠视皮质神经元的表达[J].暨南大学学报 (医学版),2010,31(2):163-7.
[12] Liu Y,Chen J,Zhou Q,et al.Study on the expression of c-fos protein in the visual cortex of adult rats with monocular strabismus amblyopia[J].J Jinan Univ(Med Ed),2010,31(2):163-7.
[13] Vanessa B,Francisco S G.c-Fos expression increase in NADPH-diaphorase positive neurons after exposure to a live cat[J].Behavioural Brain Res,2006,170(1):52-61.
[14] Hughes P.Induction of immediate-early genes and the control of neurotransmitter-regulated gene expression within the nervous system[J].Pharmacol Rev,1995,47(1):133-78.
