高效液相色谱法测定格列齐特缓释片的含量
2012-07-28蒋海峰
蒋海峰
(黑龙江大学化学化工与材料学院有机化学实验室,黑龙江 哈尔滨 150080)
格列齐特为磺酰脲类第2代口服降糖药物[1-2],格列齐特缓释片是其缓释剂型之一,也是目前患者常用药物。2005年版《中国药典(二部)》和文献[3],其中格列齐特片的含量测定方法为电位滴定法、紫外分光光度法和高效液相色谱法,但未详细设有该物质的相关检测项;同时,由于格列齐特缓释片辅料的原因,在228 nm波长下紫外测定有干扰,而高效液相色谱法在测定药物有效含量时具有精密度高、重现性好等优点[3-5]。因此,笔者采用高效液相色谱法测定了格列齐特缓释片的含量,现报道如下。
1 仪器与试药
日本岛津LC-10ATVP液相色谱仪(日本岛津公司);SPD-10AVP紫外检测器(日本岛津公司);JA1003型电子天平(沈阳龙腾电子有限公司)。色谱乙腈(山东禹王实业有限公司化工分公司);磷酸(天津科密欧化学试剂有限公司),格列齐特原料药(天津中新药业集团股份有限公司,批号为Y05050035,纯度99%);无水乙醇(分析纯,天津市北方天医化学试剂厂);色谱甲醇(天津科密欧化学试剂有限公司);格列齐特缓释片(施维雅<天津>制药有限公司,批号分别为 9G0502,2002258,2001948)。
2 方法与结果
2.1 色谱条件
色谱柱:Diamonsil C18柱(250 mm ×4.6 mm,5 μL);流动相:乙腈 - 水 - 磷酸(70 ∶30 ∶0.1);流速:0.8 mL/min;检测波长:228 nm;柱温:室温。
2.2 溶液制备
精密称取干燥至恒重的格列齐特原料药0.0032 g,置100 mL容量瓶中,加95%乙醇适量,超声使其完全溶解,再加95%乙醇定容至100 mL,作为贮备液。根据2010年版《中国药典(二部)》,取10片格列齐特缓释片(批号为9G0502),捣碎,研细,取细粉适量置于50 mL容量瓶中,加95%乙醇适量,超声使其完全溶解,室温下加95%乙醇稀释至刻度,摇匀,用一次性滤膜过滤,取滤液适量,再用95%乙醇定量稀释制成20 μg/mL的滤液,作为供试品溶液。
2.3 方法学考察
检测限试验:将配置好的供试品溶液不断稀释,摇匀,进样,以信噪比 S/N=3作为检测限。结果检测限为0.5 μg/mL。
专属性试验:分别取格列齐特原料药的贮备液和供试品溶液各20 μL进样,按色谱条件进样,色谱图见图1。可见,格列齐特原料药保留时间是7.0 min,格列齐特缓释片的辅料出峰在6 min以内,格列齐特主药峰与辅料峰达到有效分离,分离度大于2,辅料对格列齐特测定无干扰,理论板数按格列齐特峰计算不低于2000,表明方法专属性良好。

图1 高效液相色谱图
线性关系考察:精密称取105℃干燥至恒重的格列齐特原料药0.0032 g,置100 mL的容量瓶中,按贮备液方法制备溶液,用移液管从贮备液中精密量取 0.2,1,2,4,6,8,10 mL,分别置于10 mL容量瓶中,用95%乙醇定容,每次用液相针取20 μL注入液相色谱仪中,峰面积分别为 24107.9,80170.5,159033.8,315542.7,473342.8,638712.3,792820.0,得到标准曲线 A=24675 C+2886.3,r=0.9999(n=7)。结果表明,格列齐特的95%乙醇液在0.64~32 μg/mL质量浓度范围内与峰面积呈良好线性关系。
稳定性试验:取同一供试品溶液,分别在 0,2,4,8,12 h时依法进样。结果峰面积分别为 496501,496383,496156,496373,496079,平均 496298,RSD 为 0.035%(n=5),表明供试品溶液在12 h内稳定性良好。
加样回收试验:按处方比例精密称取格列齐特和辅料混合,分别为标示量的90%,100%,120%,置100 mL容量瓶中,用95%乙醇溶解并稀释定容至刻度,经0.8 μm微孔滤膜过滤,精密量取滤液并稀释。结果见表1。
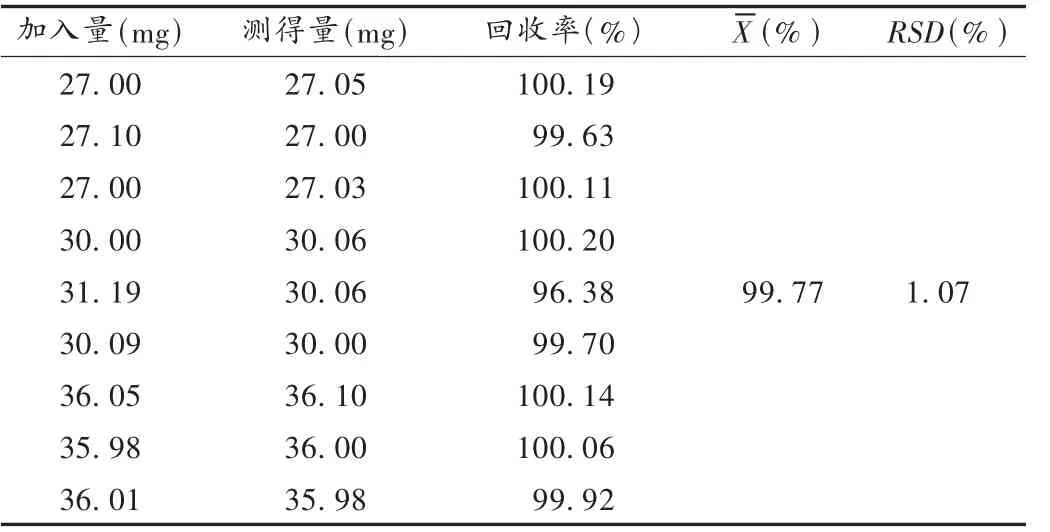
表1 格列齐特加样回收试验结果(n=9)
精密度试验:取标示量为90%的加样回收试验项下溶液,连续进样6次。结果的 RSD为0.22%(n=6),表明仪器精密度良好。
重现性试验:取同一批次(批号为9G0502)的样品10片,按供试品溶液制备方法操作,重复试验6次。结果的 RSD为0.57%(n=6),表明方法重现性良好。
2.4 样品含量测定
取3种同一厂家不同批次(9G0502,2002258,2001948)的格列齐特缓释片各10片,依法测定,结果含量分别为标示量的99%,101%,98%,均符合要求。
3 讨论
由2010年版《中国药典(二部)》[6]可知,格列齐特溶于三氯甲烷,在甲醇中略溶,在乙醇中微溶。本试验中,为了避免三氯甲烷和甲醇的毒性,将格列齐特溶于95%乙醇中,但一定要长时间超声处理,确保格列齐特全部溶于乙醇中,才能使数据准确。
称取格列齐特原料药2 mg于50 mL烧杯中,用少量95%乙醇溶解,转移至50 mL容量瓶中,用95%乙醇稀释至刻度线,以95%乙醇为空白对照,在采用紫外分光光度法,200~400 nm波长处进行波长扫描,格列齐特在228 nm波长处有最大吸收。笔者查阅相关文献资料[8],通过紫外分光光度法试验确定了格列齐特的波长为228 nm,辅料的杂质峰的干扰可以忽略,用外标法以色谱峰的面积计算药品含量。经过方法学验证,本方法操作简便,回收率、精密度、重现性等结果均符合分析方法规范要求,可用作格列齐特缓释片的含量测定方法。
[2]Krentz A J,Bailey CJ.Oral antidiabetic agents:Current role in type 2 di-abetes mellitus[J].Drugs,2005,65:385-411.
[3]Rambiritch V,Naidoo P.Gliclazide modified release[J].Drugs,2005,65:1449-1450.
[4]董翠萍.反相高效液相色谱法测定治伤胶囊中欧前胡素含量[J].中国药业,2012,24(1):30 -31.
[5]刘 杨,赖庆宽.高效液相色谱法测定复方茶新那敏片中马来酸氯苯那敏含量[J].中国药业,2012,21(1):26-27.
[6]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:809-810.
[7]陈勇川,董 慧,代 青,等.反相高效液相色谱法测定生物样品中左氧氟沙星的含量[J].中国抗生素杂志,1998,23(5):342-343.
