乙酰肝素酶、MMP-9在膀胱移行细胞癌侵袭转移中的表达相关性及临床意义
2012-07-27陈芳,李丽
陈 芳,李 丽
1.河南大学淮河医院肾内科,河南 开封 475001;2.河南大学护理学院,河南 开封 475001
膀胱移行细胞癌 (bladder transitional cell carcinoma,BTCC)是泌尿系常见的恶性肿瘤,其特点是易复发和易侵袭转移。因此积极寻求膀胱肿瘤的特殊标志物成为膀胱癌无创检查和治疗的极有价值的方法。新近研究发现乙酰肝素酶(heparanase,HPA)也称作乙酰肝素酶或类肝素酶,其能够酶解基底膜(basement membrane,BM)和细胞外基质(extracellular matrix,ECM)中的硫酸乙酰肝素蛋白聚糖成分,从而参与肿瘤侵袭转移过程。因此,HPA成为近几年肿瘤研究新热点[1]。肿瘤细胞的浸润转移是一个复杂过程,其中最重要的一步是降解细胞外基质及基底膜,这一步骤主要依赖于蛋白水解酶。MMPs(matrix metalloproteniase)就是这种锌离子依赖性内肽酶,它能降解细胞外基质所有成分,MMP-9是MMPs中降解基底膜最重要的蛋白酶之一。MMP-9主要降解以Ⅳ型胶原为主的基底膜屏障,对于肿瘤形成是非常重要的[2]。本研究采用免疫组化法检测膀胱移行细胞癌和正常膀胱组织中的HPA和MMP-9的表达情况,以探讨二者在膀胱移行细胞癌中的表达和相关性。
1 资料与方法
1.1 一般资料
病例取自2005~2010年我院膀胱移行细胞癌手术(经开放性膀胱肿瘤全切或部分切除及经尿道膀胱肿瘤电切患者)病例共92例,其中,男58例,女34例;年龄38~89岁,平均61.8岁。全部病例均经组织病理学诊断为膀胱移行细胞癌。组织学分级:高分化腺癌45例,中分化腺癌36例,低分化腺癌11例;另外同期选取34例正常膀胱组织作为对照(因输尿管癌或肾盂癌而行膀胱部分切除的正常膀胱组织,经病理证实膀胱无肿瘤细胞)。组织均经福尔马林固定,常规石蜡包埋。
1.2 方法
采用免疫组化链酶抗生物素蛋白-过氧化物酶(SP)法。兔抗人HPA单克隆抗体、兔抗人MMP-9单克隆抗体、均购自武汉博士德生物工程有限公司;兔抗SP试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。用已知的膀胱移行细胞癌阳性片作为阳性对照,以0.05 mol/L PBS液代替一抗作为阴性对照。HPA和MMP-9均以细胞胞浆中有清晰棕黄色或棕褐色颗粒为阳性。阳性结果判定标准:染色切片中计数每10个高倍视野阳性细胞百分率,阳性细胞率≥70%为强阳性(+++)病例,50%~69%为阳性(++)病例,30%~49%为弱阳性(+)病例,<30%为阴性病例[3]。
1.3 统计学处理
所有数据均采用SPSS 11.0统计软件包处理,统计方法采用χ2检验、Pearson相关分析等处理。P<0.05为差异有统计学意义。
2 结果
2.1 HPA在正常膀胱和膀胱移行细胞癌中的表达
HPA蛋白呈棕黄色或棕褐色颗粒,团块状分布,主要位于肿瘤细胞胞浆内。HPA在膀胱移行细胞癌组织阳性率为77.2%(71/92),多数为“+~++”表达(61/92);10 例正常膀胱组织中均呈“-”表达(0/10)。HPA在膀胱移行细胞癌组织中表达阳性率明显高于正常膀胱组织(P<0.05)。
2.2 HPA蛋白表达与BTCC临床病理学因素的相关性
HPA蛋白在BTCC中的表达与性别、年龄、组织学分级及1年存活率无关,而与患者周围脏器浸润、淋巴结转移有关(P<0.05)。 见表 1。
2.3 MMP-9蛋白在正常膀胱和BTCC中的表达
MMP-9蛋白呈棕黄色或棕褐色颗粒,阳性细胞主要位于肿瘤细胞胞浆内。MMP-9在BTCC中表达阳性率为70.7%(65/92),多数为“+~++”表达(46/92);10 例正常膀胱组织中有2例呈“+”表达(2/10)。HPA在BTCC中表达阳性率明显高于正常膀胱组织(P<0.05)。
2.4 BTCC组织中MMP-9的表达和临床病理指标的关系
MMP-9在BTCC中的表达与性别、年龄、组织学分级及1年存活率无关,而与患者周围脏器浸润、淋巴结转移有关(P<0.05)。 见表 2。
2.5 HPA和MMP-9的相关性
HPA表达阳性率高的患者其MMP-9的表达也显著升高,经Spearman等级相关性检验分析,在BTCC中HPA和MMP-9 常常联合表达,两者具有相关性(r=0.729,P<0.05)。
3 讨论
膀胱移行细胞癌90%具有浸润性生长、容易复发、易侵袭转移等生物学特性[4]。膀胱癌治疗关键仍然是早期诊断。总之临床需要有良好的判断指标和合理的治疗靶点。肿瘤侵袭转移是一个多步骤的、序贯的复杂过程。MMP-9和HPA均参与恶性肿瘤的侵袭转移,是其恶性生物学潜能的主要调节蛋白[5]。HPA能特异性破坏细胞外基质和基底屏障,从而促进恶性肿瘤浸润转移。目前国内外有关研究报道显示,乙酰肝素酶可能成为肿瘤治疗的一个新靶点[6]。且其可通过降解硫酸乙酰肝素糖蛋白,改变细胞外基质和基底膜结构,促进肿瘤细胞侵袭转移。本研究结果发现HPA在有周围脏器浸润及有淋巴结转移的BTCC患者中明显高于无浸润无转移者。MMPs目前已发现了至少26个成员,其中MMP-9主要降解明胶从而导致肿瘤细胞向周围组织浸润转移。有资料显示MMP-9不仅参与ECM的降解,而且还对肿瘤细胞的黏附能力有影响[7]。通常MMP-9以酶原形式在细胞内合成并最终被分泌到细胞外,改变分子构型后被激活,能降解多种细胞外基质成分,其中对ECM的降解和破坏是其中最关键的一步。大量研究表明,MMP-9在多种恶性肿瘤中呈现过度表达,在恶性肿瘤浸润转移过程中扮演着重要角色。本文显示MMP-9在BTCC中的表达与肿瘤侵犯周围脏器、淋巴结转移有密切关系[8-9]。本文说明MMP-9在BTCC的发生发展过程中起重要作用,且MMP-9阳性表达可作为BTCC浸润转移的重要分子标志之一[10]。目前关于HPA与MMP-9关系的研究尚不统一[11]。本研究同时证实HPA与MMP-9在BTCC浸润转移过程中有明显协同作用。因此,联合检测二者表达不仅可以作为早期发现和判断膀胱移行细胞癌的有效方法,同时还可作为评价膀胱移行细胞癌预后的重要指标。总之,HPA和MMP-9在膀胱移行细胞癌组织中共同表达增高,并均与肿瘤浸润转移过程相关,表明其可作为预测膀胱移行细胞癌的临床联合检测指标。

表1 BTCC中HPA的表达与临床病理学因素的相关性
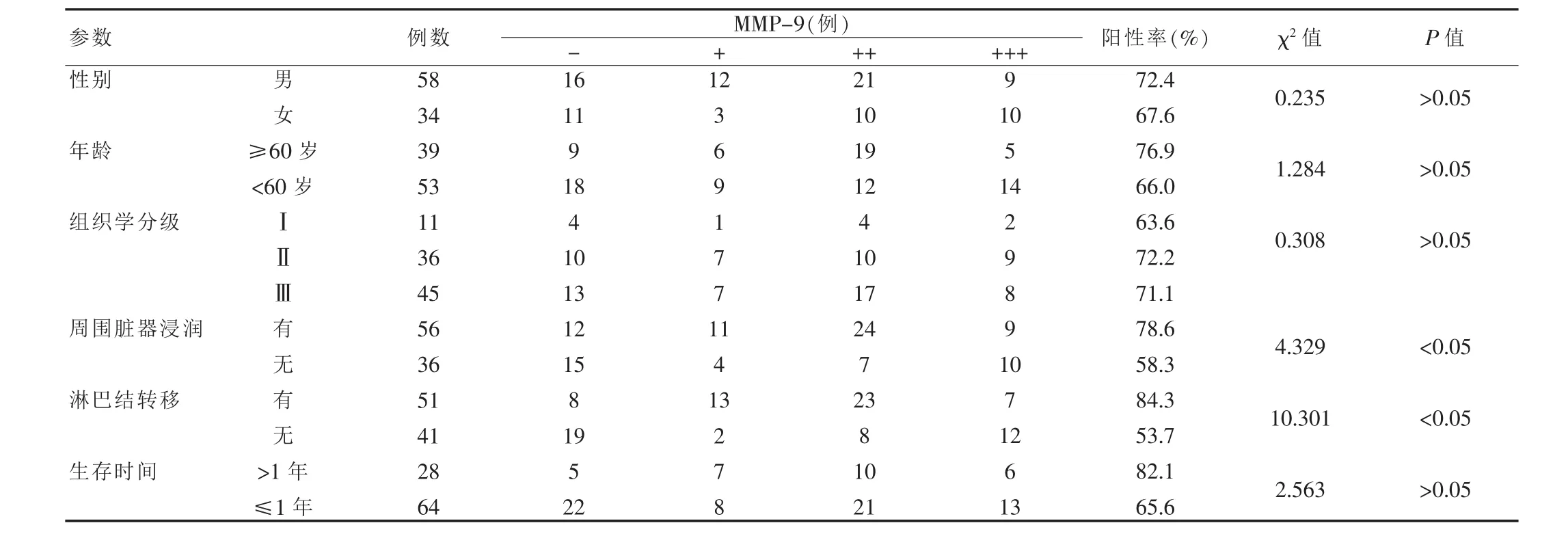
表2 膀胱移行细胞癌组织中MMP-9的表达与临床病理特征的关系
[1]李珺,李明昌,陆永建.乙酰肝素酶基因在U251胶质瘤细胞株中的表达[J].实用医学杂志,2007,23(13):1959-1961.
[2]Somiari S B,Somiari R I,Heckman C M,et al.Circulating MMP-2 and MMP-9 in breast cancer-potential role in classification of patients into low risk,high risk,benign disease and breast cancer categories[J].Int J Cancer,2006,119(6):1403-1411.
[3]Mendes O,Kim H T,Stoica G.Expression of MMP-2,MMP-9 and MMP3 in breast cancer brain metastasis in a rat model[J].Clin Exp Metastasis,2005,22(3):237-246.
[4]曾轶晖.基因治疗胰腺癌的研究[J].中国医药导报杂志,2009,6(7):156-159.
[5]Gorogh T,Beier UH,Baumken J,et al.Metalloproteinases and their inhibitors:influence on tumor invasiveness and metastasis formation in head and neck squamous cell carcinomas [J].Head Neck,2006,28(1):31-39.
[6]Baraz L,Haupt Y,Elkin M,et al.Tumor suppressor p53 regulates heparanase gene expression[J].Oncogene,2006,25(28):3939-3947.
[7]Zhang S,Li L,Lin JY,et al.Imbalance between expression of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in invasiveness and metastasis of human gastric carcinoma [J].World J Gastroenterol,2003,9(5):899-904.
[8]胡忠良,文继舫,沈明,等.TGIF,MMP9和蛋VEGF白在胃癌中的表达及临床病理联系[J].中南大学学报,2006,31(1):76-80.
[9]Matsumura S,One N,Nakayama H,et al.A single nucleotide polymorphism in the MMP-9 promoter affects tumor progression and invasive phenotype of gastric cancer[J].J Cancer Res Clin Oncol,2005,131(1):19-25.
[10]O'Grady A,Dunne C,O'Kelly P,et al.Differential expression of matrix metalloproteinase(MMP)-2,MMP-9 and tissue inhibitor of metalloproteinase(TIMP)-1 and TIMP-2 in non-melanoma skin cancer:implications for tumour progression[J].Histopathology,2007,51(6):793-804.
[11]范钰,王崇强,张振水,等.基质金属蛋白酶7mRNA在胰腺癌组织中表达的临床意义[J].齐齐哈尔医学院学报,2008,29(1):4-6.
