脑微出血:使用定量磁敏感成像进行负担评估
2012-07-24康奈尔大学生物医学工程系美国纽约威尔康奈尔医学院放射学系美国纽约哥伦比亚大学放射学系美国纽约浙江大学医学院第二附属医院神经科中国浙江中国人民解放军总医院放射科中国北京庆熙大学生物工程学系韩国首尔华东师范大学上海市磁共振重点实验室中国上海
1. 康奈尔大学 生物医学工程系,美国 纽约;2. 威尔康奈尔医学院 放射学系,美国纽约;3. 哥伦比亚大学 放射学系,美国 纽约;4. 浙江大学医学院第二附属医院 神经科,中国 浙江;5. 中国人民解放军总医院放射科,中国 北京;6. 庆熙大学 生物工程学系,韩国 首尔;7. 华东师范大学 上海市磁共振重点实验室,中国 上海
脑微出血:使用定量磁敏感成像进行负担评估
Tian Liu, PhD1,2Krishna Surapaneni , MD , MPH3Min Lou, MD4Liuquan Cheng, MD5Pascal Spincemaille, PhD2Yi Wang, PhD1,2,6,7
1. 康奈尔大学 生物医学工程系,美国 纽约;2. 威尔康奈尔医学院 放射学系,美国纽约;3. 哥伦比亚大学 放射学系,美国 纽约;4. 浙江大学医学院第二附属医院 神经科,中国 浙江;5. 中国人民解放军总医院放射科,中国 北京;6. 庆熙大学 生物工程学系,韩国 首尔;7. 华东师范大学 上海市磁共振重点实验室,中国 上海
Radiology杂志特别供稿专栏
编者按:本刊与世界顶级专业杂志合作,推出Radiology杂志特别供稿专栏。从2011年第8期起每期由北美放射学会Radiology(《放射学》)杂志向《中国医疗设备》杂志特别提供1~2篇当期的最新专业论文,本刊的读者将与Radiology杂志的读者分享到这些文章,了解该领域的最新动态。
Radiology刊载临床放射学和相关科学的研究论文,包括诊断放射学、神经放射学、核医学、儿科放射学、超声、治疗放射学、辐射物理学,以及放射生物学等。该杂志每月出版约300 页的同行评审的原创性研究、权威的评论及新技术的专家评论,其影响因子在诊断放射领域杂志中排名第一,系全球医学专业杂志中拥有权威地位的顶尖杂志(独家发布,禁止转载)。
目的 评估定量磁敏感成像(QSM)在减少标准磁共振成像序列测量脑微出血负担不一致性的作用。材料与方法 本研究遵守《健康保险可携带性及责任法案》(HIPAA)并获得公共审查委员会批准。从178例连续的患者中选出10例(5.6%),这178例患者均在3.0T多重回波梯度回波成像检查中诊断为疑似中风且在T2*加权成像下显示有脑微出血现象。通过形态学偶极子反演方法(MEDI)中的幅度和相位绘制出各个回波时间下的QSM图像。脑微出血的大小由两名神经放射学专家通过不同回波时间下的QSM图像、T2*加权图像、磁敏感加权(SW)图像以及R2*图像测得。脑微出血区域的总磁敏感度也通过QSM图像评估出来。用t检验和F检验对测量误差进行了评估,P<0.05为差异有统计学意义。结果当回波时间从约20ms增加至约40ms时,QSM图像、T2*加权图像以及SW图像下可测量的脑微出血量平均因子()分别为1.49±0.86、1.64±0.84、2.30±1.20,P<0.01。然而,QSM方法的总磁敏感度并没有随着回波时间的变化发生明显改变(P=0.31),且变化程度明显小于任意脑微出血量的增加程度(P<0.01)。结论 使用QSM方法测量脑微出血总磁敏感度是独立于回波时间的物理属性。
脑微出血和/或铁沉积的潜在原因是广泛的,包括常见的全身性高血压和脑淀粉样血管病。其他原因还有外伤继发弥漫性轴索损伤[1-2]、海绵状血管瘤、脱髓鞘疾病、脉管炎、神经退行性疾病、出血性微转移病灶等。脑微出血表示脑部有因长期高血压或老龄化引起的玻璃样变和微血管形成,且有脑部小动脉破裂,有潜在微出血的情况[3-6]。
有大量关于以原发脑出血的发病率或复发率来评价脑微出血严重程度的研究[7-10]。此外,近期的一项研究结果[11-12]显示:对于接受抗凝治疗的患者,脑微出血负担与脑出血的发病率高独立性相关。因此,迫切需要进一步评估脑微出血负担及其对治疗决策的影响。
T2*加权梯度回波磁共振成像是检测脑出血的一种方法,因为它对由含铁血黄素沉积[5]引起的磁场不均匀有一定敏感性。周围薄壁组织信号空白区的存在状态、数值、分布,尤其是大小往往用来表征脑微出血的负担[5,13]。然而,脑微出血的大小可能因磁场强度、倾倒角、截面间隙与厚度的不同而差异很大。此外,以往的研究在确定微出血大小时结果不一致[5],测得的大小与回波时间的选择有关,这主要是由于长时间累积的体素移相效应,导致随着回波时间的增加[14]信号空白区扩大。由于这些可变因素,微出血和临床检测措施之间尚未明确建立良好的关系。根据Greenberg和Vernooij的报告[5],有必要建立一套共同的标准,用以检测微出血,从而实现信息的交叉研究比较与数据的纵向收集。因此,在本研究中,我们评估了QSM在减少标准磁共振成像序列测量脑微出血负担不一致性的作用。
1 材料与方法
1.1 数据采集
回顾性分析获得了机构审查委员会批准并遵守HIPAA法案。本研究回顾了178例连续的疑似脑率中患者的检查数据,这些患者均在1周内(2010年9月20日~27日)于我们的单位(威尔康奈尔医学院、哥伦比亚大学、浙江大学医学院第二附属医院、中国人民解放军总医院)进行过MR检查。入选标准为年龄在40岁以上,在T2*加权MRI下检出脑软组织有2~10mm微出血的患者。56例患者(31.5%)达到以上标准。行1.5T MRI检查的患者被排除在外(n=43,24.2%)。
其他排除标准还包括在T2*加权成像下由神经放射学专家(K.S.,7年经验)判断有过量运动伪影,因为这限制了测量脑微出血大小的准确性(n=3,1.7%)。10例患者(5.6%)完全达到入选标准。平均年龄(72±18)岁,其中,5例男性患者平均年龄(76±9)岁,5例女性患者平均年龄(68±24)岁。用3.0TMRI装置和八通道相控阵头线圈进行成像。
脑率中治疗流程包括能够提供三维多回波扰相梯度回波样本的T2*加权血管造影。T2*加权血管造影序列的成像参数如下:轴面覆盖大脑,回波时间个数7~10,首次回波时间4.9~13ms,均匀回波时间间隔3.8~5.2ms,重复时间39.8~67.6ms,倾倒角15°~25°,每像素带宽244Hz,视野范围(24×19.2~24.0×7.2~18)cm,采集矩阵(240~448×180~384×36~60)。使用了换算系数为2的平行成像(阵列空间敏感编码技术)方法。
1.2 数据重建
从测得的复杂相位数据中进行QSM图像重建是一个不适定问题(或称反问题),在这个意义上许多方案能够生成一个实际上等同于从相位数据[16]衍生出来的域。在此,我们将这个反问题当做加权L1最小化问题[17-18]。在所有备选的解决方案中,敏感性分布估计量χ*是边缘分布和解剖(幅度)图像之间差异较小的方案之一。
这一空间优势有助于消除QSM中常出现的条纹伪影[22],并制定一个有物理意义的方案。MEDI方法的示意图,见图1。梯度加权代表了边缘信息(图1B),通过阈值的梯度幅度图像(图1A和1B)计算出。相位图像(图1C)用于获得场分布图(图1E),并估算其噪音(图1D)。通过投影对偶极场方法将场分布图(图1E)进一步处理,从而去除背景磁场。随后梯度加权,数据加权和本地磁场图像被输入到MEDI运算法则中来计算定量磁敏感性分布(图1F)。

图1 QSM重建方法示意图
1.3 数据分析
1.3.1 QSM 数据图评估
分析一定回波时间范围内QSM图像图对比度和噪声的变化,按回波时间绘制重建的QSM数据以评估回波时间的依赖性。对每例患者来说,在回波时间约为40ms时,QSM数据图上手动划分出苍白球的一个节段,这一节段也被应用在其他回波时间中。QSM图像对比率被定义为苍白球平均磁化率值,在回波时间为te时QSM的噪声被定义为回波时间为te-Δte与回波时间为te时的标准偏差差异。对每例患者来说,将回波时间约为40ms时测得的对比度除以回波时间约为20ms时的对比度来获得对比度与回波时间的关系,用类似的方法也获得了噪声比与回波时间的关系。
由两位放射学专家(K.S.与另一位有6年经验的放射学家)通过回波时间约为40ms时的幅度图像来判定是否有脑微出血。直径为2~10mm明显不是血管的圆形或卵圆形低信号病灶被判定为微出血。两位放射学专家分别独立在QSM图像上读取微出血的量。6周后第二位放射学专家重复做QSM分析,以评估观察者自身偏差(intraobserver variability)。对每一处脑微出血来说,将微出血处的中心设置一个(1×1×1)cm3的感兴趣区,进而计算其总磁敏感度。磁敏感度本身是一个无量纲的参数,组织磁敏感度通常为10-6级,因此常用百万分率作为单位。先前在健康志愿者脑软组织测得的磁敏感度低于0.05ppm[17]。因此,磁敏感度大于0.05ppm的立方体体素被认为是微出血的一部分,且所有选中的体素磁敏感度之和用如下公式计算总磁敏感度:
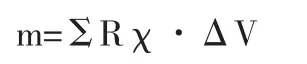
其中m代表脑微出血总磁敏感度,R代表选择的体素区域,ΔV代表体素大小。总磁敏感度进一步被用作脑微出血负担的指标,且与下文描述的尺寸测量相比较。
通过QSM图像上苍白球、内囊以及丘脑的线段来确定回波时间对磁敏感度差异的影响。总磁敏感度与回波时间之间进行线性回归。QSM噪声作为幂函数。
1.3.2 R2*图像、磁敏感加权图像以及T2*加权图像间的比较
与QSM图像相似,获得每一回波时间te下的单指数拟合R2*图像。对每一回波时间来说,通过将幅度图像与校正的相位图像多次相乘至四次方得到磁敏感加权图像[24],且保留了T2*加权图。每一回波时间下的QSM图像、R2*图像、SW图像以及T2*加权图上每一处微出血的直径dM由两位放射学专家读出(第一次由K.S.读取,第二次由另一放射学家读取)。为了比较一定体积下的总磁敏感度,微出血直径进一步转化为微出血体积(假设为球形):V=1/6πdM3。为了确定每一回波时间下微出血的体积,计算出了回波时间为te和20ms时的微出血体积比,20ms被认为是脑微出血检测的最小回波时间[5]。同样,计算出回波时间为te和20ms时的总磁敏感度。总磁敏感度与回波时间为40ms时T2*加权图像上每一脑微出血体积进行线性回归。绘制出所有患者每一脑微出血总磁敏感度的直方图来分析其分布。
R2*被证实与含铁量有高度相关性[25]。因此,我们将总磁敏感度与R2*相比较,这也能表征出脑微出血的总含铁量。通过(1×1×1)cm3感兴趣区R2*值之和计算出总R2*,(1×1×1)cm3感兴趣区用作计算总磁敏感度值。当回波时间约为40ms时,在每一微出血的总R2*及总磁敏感度间进行线性回归。
1.4 统计学分析
算出所有测量结果的标准偏差。总磁化率和尺寸测量的观察者间和观察者内变量(Inter-and Intraobserver Variabilities)通过组内相关系数进行了评估[26]。下列标准临床相关协议被用来评估计算组内相关系数:一致性(Agreement)<0.4被认为差;0.40~0.59为中等;0.60~0.74为良好;>0.74为优[27]。单向方差分析被用来测定QSM在不同回波时间里的差异。应用单尾学生t检验来评估总磁敏感度是否小于每一体积比。另用学生t检验评估这些比值和1之间的差异显着性水平。进行回顾性功效分析以评估当回波时间约增加一倍时总磁敏感度增加20%的几率。用F检验评估线性回归效果的显著性。所有的评估使用了统计软件(SPSS, release 16;SPSS,美国芝加哥),α=0.05,表示差异有统计学意义。
2 结果
脑微出血的结果,见表1。QSM数据图的对比度独立于回波时间的数值(平均对比度1.04±0.12,P=0.31),但在QSM重建中当回波时间数值增大时噪声降低(平均噪声比0.29±0.08,P<0.01),见图2。QSM图像线段在不同回波时间中没有明显改变(P=0.997)(图2D)。微出血的总磁敏感度与回波时间没有呈现明显线性关系(斜率-0.032,P=0.50,见图2E。QSM噪声随着回波时间的增加单调递减(指数-1.169),见图2F。

表1 脑微出血发现总结
另一实例进一步说明了在大回波时间范围内脑微出血总磁敏感度变化是减小的(图3),也包括了体积测量与QSM、T2*加权、SW以及R2*图像间的比较。磁敏感度比没有发生重大变化,而体积比随着回波时间增加(图3A)。所有在T2*加权图像中查出的微出血同样在SW、R2*图像以及QSM数据中查得(回波时间均约为40ms)。在T2*加权图像(图3B)与SW图像(图3C)上,微出血的直径显著随着回波时间的增加而增大,在R2*图像(图3D)上直径的增大并不明显,而在QSM图像上则显著减小(图3E)。
观察者间与观察者内的结果,见表2。组内相关系数介于好(0.60-0.74)和优秀(0.74)之间。三位读数者(K.S.与另两名放射学专家)在回波时间约40ms时读出的QSM、R2*、T2*加权与SW图像的平均容积比分别为1.49±0.86,1.64±0.84,2.30±1.20,和2.30±1.19,均显著大于1(P<0.01)。当回波时间约为40ms时总磁敏感度为1.03±0.30,显著小于任一平均容积比(P<0.01)且接近1(P=0.31)。3位读数者一致确认了这一发现。单样本t检验α值为0.05,回顾性功效分析证实样本大小足以实现94%的功效来检测当回波时间加倍时总磁敏感度的增加。脑微出血总磁敏感度与其体积之间没有相关性(回波时间约为40ms时测量)(P=0.47),见图4B。40处微出血中的37处的总磁敏感度小于25ppm·μmL(图4C)。
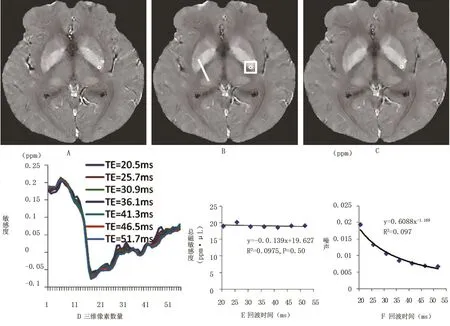
图2 QSM轮廓定性及定量分析
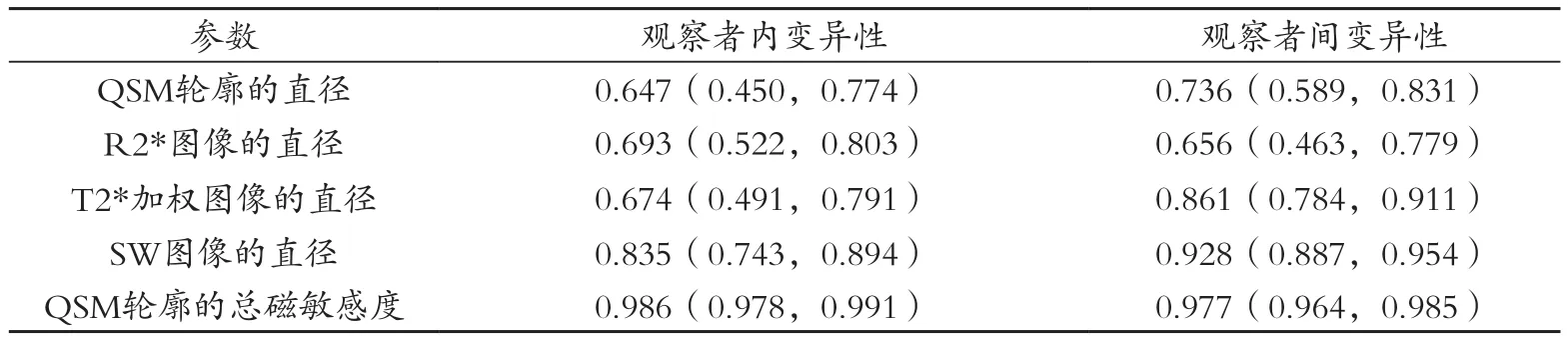
表2 观察者内和观察者间变异性
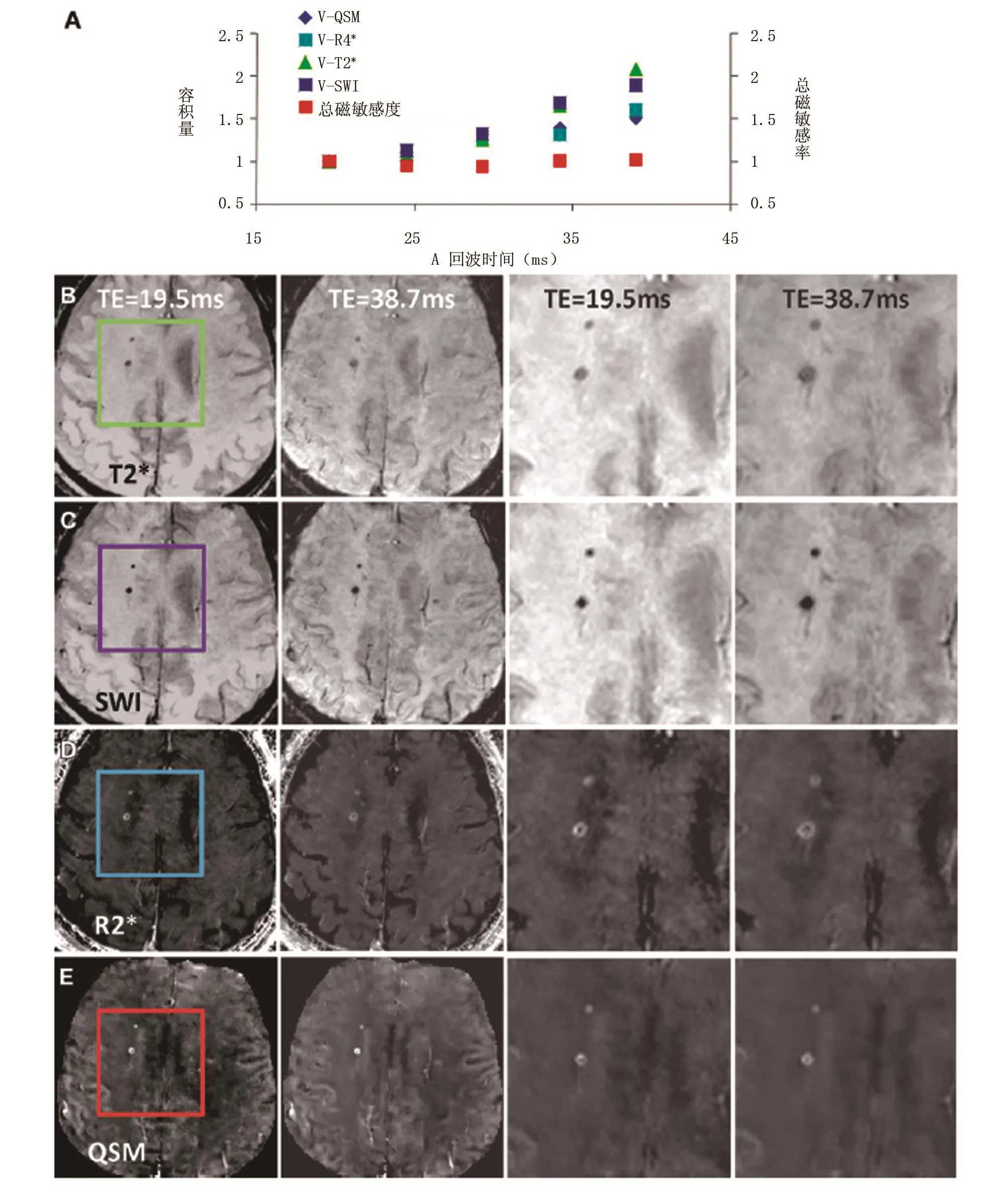
图3 R2*分布图、T2*加权图像的QSM轮廓比较
总R2*和总此敏感度之间的线性回归有着一个219.4的斜率(P<0.01),同时决定系数R2=0.75(图5)。
3 讨论
本研究数据表明,QSM能够通过磁敏感度确定脑微出血的量。与梯度回波MR图像在较大回波时间范围内的尺寸测量相比,脑微出血总磁敏感度测量的一致性更好。梯度回波MR成像及其衍生成像方法(包括T2*加权、SW及R2*成像)会受晕状伪影影响[28],体素低信号表明只有局域场变化是造成局域场干扰的原因,而与顺磁源的确切方位无关。当使用合适的信息时,如没有或很少晕状伪影的图像,QSM偶极单元磁场反卷积理论上能够消除晕状伪影。我们当前的QSM方法采用了复合T2*加权,当仅有极少量出血时仍然会轻微的晕状伪影。因此,计算出的QSM数据中回波时间略有增加,脑微出血预估体积磁敏感度回波时间有所降低。即使在目前的MEDI中,确定微出血的磁矩进行体积磁敏感度整合与尺寸测量相比随着回波时间变化而改变更小,这些发现与先前体模及体外验证的结果一致[29],在这项结果中QSM被证实能够准确量化铁元素。假设含铁血黄素中的铁磁化是不饱和的(非铁磁性的),那么总磁敏感度测量应该独立于磁场强度[30]。
脑微出血敏感度变化主要是由于含铁血黄素沉积,能够反映出铁元素含量,这被认为是脑出血损伤的重要因素[31-32]。相应地,关于出血的磁性问题的研究有所增加[33-34]。由于总敏感度在较大范围的回波时间里一致性更好,在T2*加权图像中,对于微出血负担的测量这可能是较出血量更有用的测量方法。我们缺乏量与总敏感度之间相关度的数据,反映出体积磁敏感度有明显变化。总磁敏感度、体积磁敏感度、神经损伤与疾病和药物治疗的风险间的关系有待进一步研究。如QSM脑微出血负担可能是儿童急性非偶然头部外伤[2]预后以及评估接受抗凝治疗的慢性乙型肝炎患者出血风险的重要指标[11-12]。

图4 脑微出血磁敏感度与其体积之间的关系
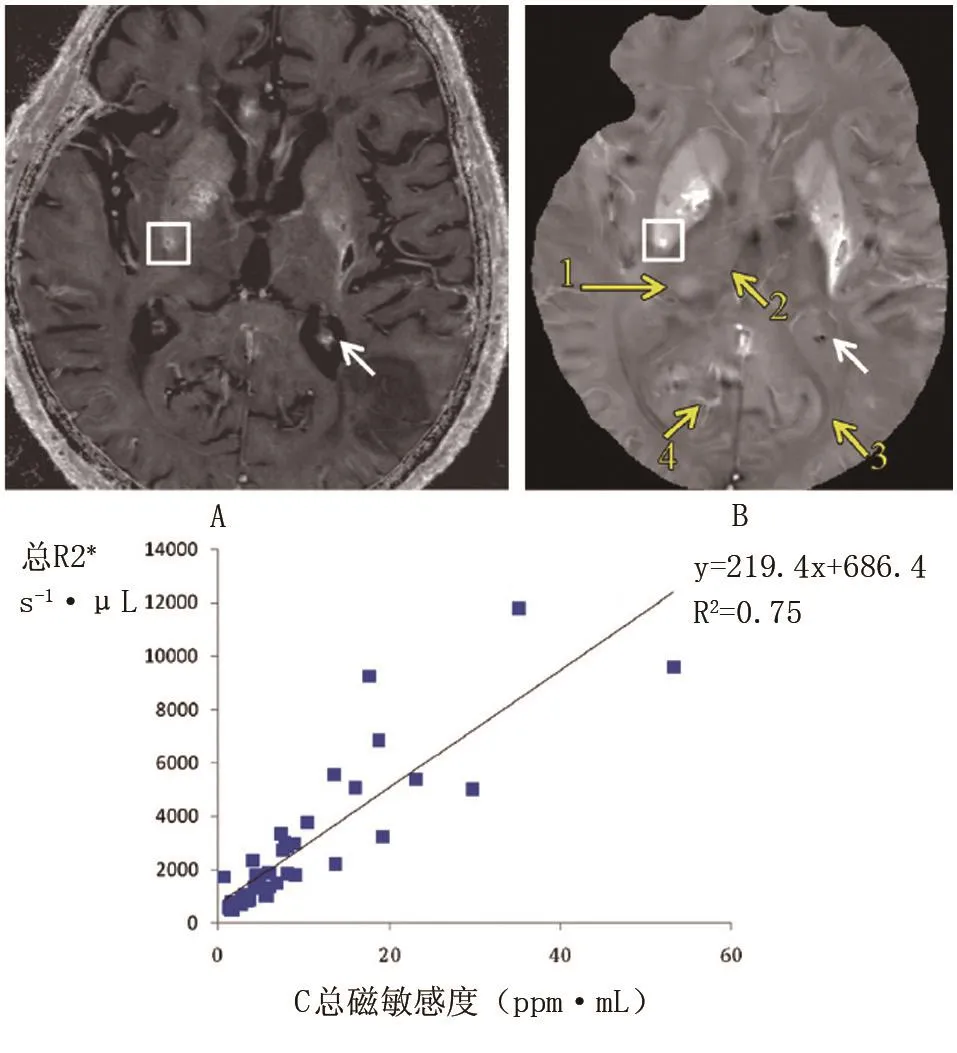
图5 总R2和总磁敏感度之间的线性回归斜率
QSM的噪音随着回波时间的增加而降低,因为更长的回波时间能够允许更多的移相且场分布估算更准确,只要幅面图像的信号强度没有衰减至噪音水平之下[35]。QSM的对比度由组织敏感度决定,与回波时间无关。这一物理原理为用QSM衡量脑微出血负担提供了支持。固定重复时间内回波时间个数随着接收器带宽而线性增加。低接收机带宽可用于获得单回波高信号噪声比。然而,预期回波时间的单回波可能无法在重复时间内使用,导致信号噪声比低于多回波方法下所有回波时间总和的信号噪声比。此外,多回波方法下的时间演变信息能够增强预估场分布图去包裹运算(Unwrapping Algorithm)的稳定性。大多数现代临床影像设备都装配了多梯度回波序列。
在本研究中,我们没有测量T2*加权和SW图像的总低信号强度。这些低信号区域多数包含噪声。因此,总低信号强度仅为体积乘以噪音水平,而并不能提供除了脑微出血量之外的有用信息(R2=0.75),应当指出的是这仅适用于脑微出血,它们都是顺磁性的。与铁元素相比,钙沉积在QSM上有着相反的信号,因为它们是逆磁性的[29,34,36]。然而,在R2*图像上,它们却有着相似的表现。此外,测得的R2*受T2淬火效应(Quench Effect)的影响[37]。因此,脑微出血总R2*测量并非检测脑微出血或衡量其负担的最佳方法。
这项研究的限制包括分析的回顾性。另一限制是数据采集参数并非对所有物体都是同质的。据早期的初步调查结果(本文未列出)显示,高空间分辨率对QSM重建有利,因为它能够减少在确定相位时的数字化错误。此外,更大的回波时间范围将会提高预估场分布图的准确性。这些发现有助于在未来设计出更加正确和前瞻的研究。改进的数据采集将会降低QSM中的噪音,增加标准效应量的大小,从而当应用相同的样本大小时使得统计能力更强。
总之,脑微出血的总磁敏感度是独立于回波时间的物理量。使用总敏感度测量脑微出血大大减少了与梯度回波MR图像回波时间相关的变化性,提供了一种表征脑微出血负担的一致性更强的方法。
出版前该文公布情况:
10.1148/radiol.11110251 Content code:NR
Radiology 2012; 262:269-278
缩略语注释:
MEDI=Morphology-Enabled Dipole Inversion(形态学偶极子反演)
QSM=Quantitative Susceptibility Mapping(定量磁敏感成像)
ROI=Region Of Interest(感兴趣区域)
SW=Susceptibility Weighted(磁敏感加权)
作者贡献:
全部研究担保人:Y.W.;
研究理念/研究设计、数据获得、数据分析/说明:所有作者;
重要知识内容的手稿起草及修订:所有作者;
文章定稿:所有作者;
文献查找:T.L., K.S., Y.W.;
临床研究:T.L., Y.W.;
实验研究:M.L., P.S., Y.W.;
统计分析:T.L., Y.W.;
手稿编辑:T.L., K.S., M.L., P.S., Y.W.
[1] Akiyama Y, Miyata K, Harada K, et al. Susceptibility-weighted magnetic resonance imaging for the detection of cerebral microhemorrhage in patients with traumatic brain injury[J].Neurol Med Chir (Tokyo),2009,49(3):97-99.
[2] Colbert CA, Holshouser BA, Aaen GS, et al.Value of cerebral microhemorrhages detected with susceptibility-weighted MR Imaging for prediction of long-term outcome in children with nonaccidental trauma[J]. Radiology,2010,256(3):898-905.
[3] Jeerakathil T, Wolf PA, Beiser A,et al.Stroke risk profi le predicts white matter hyperintensity volume:the Framingham Study [J].Stroke,2004,35 (8):1857-1861.
[4] Fazekas F, Kleinert R, Roob G, et al. Histopathologic analysis of foci of signal loss on gradient-echo T2*-weighted MR images in patients with spontaneous intracerebral hemorrhage: evidence of microangiopathyrelated microbleeds[J].AJNR Am J Neuroradiol,1999,20 (4):637-642 .
[5] Greenberg SM, Vernooij MW, Cordonnier C,et al. Cerebral microbleeds:a guide to detection and interpretation[J]. Lancet Neurol,2009,8 (2):165-174.
[6] Vernooij MW, van der Lugt A, Ikram MA,et al. Prevalence and risk factors of cerebral microbleeds:the Rotterdam Scan Study[J].Neurology,2008:70 (14):1208-1214 .
[7] Lee SH, Bae HJ, Kwon SJ, et al. Cerebral microbleeds are regionally associated with intracerebral hemorrhag [J].Neurology,2004,62(1):72-76.
[8] Lee SH, Kim BJ, Roh JK. Silent microbleeds are associated with volume of primary intracerebral hemorrhage[J].Neurology,2006,66(3):430-432.
[9] Fan Y, Zhang L, Lam WW, et al. Cerebral microbleeds as a risk factor for subsequent intracerebral hemorrhages among patients with acute ischemic stroke[J].Stroke,2003,34 (10):2459-2462 .
[10] Greenberg SM, Eng JA, Ning M,et al.Hemorrhage burden predicts recurrent intracerebral hemorrhage after lobarhemorrhage[J].Stroke,2004,35 (6):1415-1420.
[11] Lee GH, Kwon SU, Kang DW. Warfarininduced intracerebral hemorrhage associated with microbleeds [J]. J Clin Neurol,2008,4(3):131-133.
[12] Lee SH, Ryu WS, Roh JK. Cerebral microbleeds are a risk factor for warfarinrelated intracerebral hemorrhage[J].Neurology,2009,72(2):171-176.
[13] Cordonnier C,Al-Shahi Salman R,Wardlaw J . Spontaneous brain microbleeds:systematic review, subgroup analyses and standards for study design and reporting [J].Brain,2007,130 (8): 1988-2003.
[14] Vernooij MW , Ikram MA , Wielopolski PA , et al.Cerebral microbleeds: accelerated 3D T2*- weighted GRE MR imaging versus conventional 2D T2*-weighted GRE MR imaging for detection[J].Radiology,2008,248 (1):272-277.
[15] Cordonnier C, Potter GM, Jackson CA,et al .Improving interrater agreement about brain microbleeds: development of the Brain Observer MicroBleed Scale (BOMBS) [J].Stroke,2009,40 (1):94-99.
[16] Marques JP, Bowtell R.Application of a Fourier-based method for rapid calculation of fi eld inhomogeneity due to spatial variation of magnetic susceptibility[J].Concepts Magn Reson Part B Magn Reson Eng,2005,25B (1): 65-78 .
[17] Liu T, Liu J, de Rochefort L, et al. Morphology enabled dipole inversion (MEDI) from a single-angle acquisition: Comparison with COSMOS in human brain imaging[J].Magn Reson Med,2011,66 (3):777-783.
[18] Liu J , Liu T , de Rochefort L ,et al.Quantitative susceptibility mapping by regulating the fi eld to source inverse problem with a sparse prior derived from the Maxwell equation: validation and application to brain [abstr]. In: Proceedings of the Eighteenth Meeting of the International Society for Magnetic Resonance in Medicine[M].Berkeley,Calif: International Society for Magnetic Resonance in Medicine,2010:4996.
[19] Smith SM . Fast robust automated brain extraction[J].Hum Brain Mapp,2002,17 (3):143-155.
[20] Kressler B,de Rochefort L, Liu T, et al. Nonlinear regularization for per voxel estimation of magnetic susceptibility distributions from MRI fi eld maps[J].IEEE Trans Med Imaging,2010 ,29 (2):273-281.
[21] Cusack R, Papadakis N.New robust 3-D phase unwrapping algorithms:application to magnetic fi eld mapping and undistorting echoplanar images[J].Neuroimage,2002,16 (3 Pt 1):754-764.
[22] Shmueli K,de Zwart JA,van Gelderen P,et al. Magnetic susceptibility mapping of brain tissue in vivo using MRI phase data[J].Magn Reson Med,2009,62 (6):1510-1522 .
[23] Liu T, Khalidov I, de Rochefort L , et al .A novel background fi eld removal method for MRI using projection onto dipole fi elds (PDF) [J].NMR Biomed,2011,5:8.
[24] Haacke EM , Xu Y, Cheng YC , et al.Susceptibility weighted imaging (SWI) [J].Magn Reson Med,2004,52 (3): 612-618 .
[25] Langkammer C,Krebs N,Goessler W,et al.Quantitative MR imaging of brain iron:a postmortem validation study[J].Radiology, 2010,257 (2):455-462.
[26] Bartko JJ , Carpenter WT Jr. On the methods and theory of reliability [J].J Nerv Ment Dis,1976,163 (5): 307-317 .
[27] Oppo K, Leen E,Angerson WJ, et al. Doppler perfusion index: an interobserver and intraobserver reproducibility study[J].Radiology,1998 ,208 (2): 453-457.
[28] Schrag M, McAuley G, Pomakian J, et al .Correlation of hypointensities in susceptibility- weighted images to tissue histology in dementia patients with cerebral amyloid angiopathy: a postmortem MRI study [J].A cta Neuropathol,2009,11:25.
[29] Liu T, Spincemaille P, de Rochefort L ,et al . Calculation of susceptibility through multiple orientation sampling (COSMOS): a method for conditioning the inverse problem from measured magnetic fi eld map to susceptibility source image in MRI[J].Magn Reson Med,2009,61(1):196-204.
[30] Liu T,Spincemaille P, de Rochefort L,et al .Unambiguous identifi cation of superparamagnetic iron oxide particles through quantitative susceptibility mapping of the nonlinear response to magnetic fi elds[J].Magn Reson Imaging,2010,28 (9): 1383-1389.
[31] Xi G, Keep RF, Hoff JT. Mechanisms of brain injury after intracerebral haemorrhage[J].Lancet Neurol,2006 ,5 (1): 53-63 .
[32] Lou M,Lieb K,Selim M.The relationship between hematoma iron content and perihematoma edema:an MRI study[J].Cerebrovasc Dis,2009,27(3):266-271.
[33] McAuley G,Schrag M, Sipos P,et al.Quantifi cation of punctate iron sources using magnetic resonance phase[J].Magn Reson Med,2010,63 (1):106-115.
[34] Schweser F,Deistung A, Lehr BW,et al. Differentiation between diamagnetic and paramagnetic cerebral lesions based on magnetic susceptibility mapping[J].Med Phys,2010, 37 (10): 5165-5178 .
[35] Gudbjartsson H, Patz S.The Rician distribution of noisy MRI data[J].Magn Reson Med,1995,34 (6): 910-914 .
[36] de Rochefort L, Brown R, Prince MR, et al.Quantitative MR susceptibility mapping using piece-wise constant regularized inversion of the magnetic fi eld[J].Magn Reson Med,2008 ,60 (4):1003-1009.
[37] Zurkiya O, Chan AW, Hu X. MagA is suffi cient for producing magnetic nanoparticles in mammalian cells, making it an MRI reporter[J].Magn Reson Med,2008,59 (6):1225-1231.
10.3969/j.issn.1674-1633.2012.04.001
1674-1633(2012)04-0001-08
本文英文原版出自《放射学》杂志[2011年;261卷;258-265页]。
©2011年北美放射学会对本文保留一切权利。翻译及转载均经过北美放射学会许可。北美放射学会对在翻译过程中出现的译文不准确及错误现象概不负责。
©北美放射学会(RSNA),2011
基金支持:该研究获美国国立卫生研究院基金项目支持(1R01EB013443-01与1R01NS072370-01A1)。潜在的利益冲突在文末列出。
2011-02-04
修稿通知发出日期:2011-04-05
修回稿接收日期:2011-05-31
通过审核日期:2011-06-23
定稿日期:2011-08-03
邮件请寄:Y.W. (e-mail: yiwang@med.cornell.edu)
