分段血浆醛固酮/肾素活性比值对原发性醛固酮增多症的诊断效力
2012-07-21艾雪松李黎明
艾雪松 林 毅 李黎明
原发性醛固酮增多症(PA)是由于肾上腺皮质病变,导致醛固酮分泌增多及肾素-血管紧张素系统(RAS)受抑制,表现出以高血浆醛固酮水平和低血浆肾素活性为主要特征,以高血压伴或不伴低血钾为主要临床表现的综合征,主要包括分泌醛固酮的腺瘤(APA)和特发性醛固酮增多症(IHA)。对PA的认识是不断深入的过程,过去一直认为PA比较少见,占高血压患者2%以下。自1981年Hiramatsu等[1]以血浆醛固酮/血浆肾素活性比值(ARR)为指标,成功地从384例高血压患者中筛查出9例APA以来,ARR逐渐成为PA筛查的常用指标。目前认为PA约占高血压人群的10%,在顽固性高血压患者中高达20%[2]。但迄今为止,ARR测定仍缺乏标准化,其判断的切点值差异很大,可在20~112 ng·dL-1/(ng·mL-1·h-1)不等[3-4](1 ng·dL-1=27.7 pmol·L-1)。本研究就分段ARR对PA的诊断效力进行探讨。
1 资料与方法
1.1 一般资料 收集我院2000年1月—2010年12月的PA患者279例,同期随机抽取内科原发性高血压患者(PH)70例。纳入标准:所有PA患者均经“金标准”即病理确诊,采血前均经药物洗脱期;PH的诊断包括:影像学检查阴性,经临床和实验室检查排除继发性高血压的PH患者。PA患者中男117例,女162例,年龄19~76岁,平均(43.8±11.6)岁,其中原醛瘤患者240例,特发性醛固酮增多症患者36例,皮质癌患者3例;PH患者中男43例,女27例,年龄35~69岁,平均(56.3±12.7)岁。
1.2 方法 为避免药物的影响,所有患者在采血前停用钙离子拮抗剂、血管紧张素转化酶抑制剂、血管紧张素受体拮抗剂、β受体阻滞剂、短效二氢吡啶类和可乐定等2周以上,利尿剂为4周以上。如果患者不适宜停用药物,则换用对RAS影响较小的药物,如缓释维拉帕米或α1受体拮抗剂特拉唑嗪等。在充分停药或换药基础上再进行ARR的测定。在进行ARR测定前,患者应保持正常钠盐摄入,纠正低血钾。夜间平卧8 h以上,于次日7:00卧位采肘正中静脉血测卧位血浆肾素活性(PRA)和血浆醛固酮(ALD)。低血钾患者需口服补钾至正常或接近正常水平后再进行。PRA和ALD的检测均使用放免法测定。所用试剂盒为北京北方生物技术研究所生产的125I醛固酮放射免疫分析药盒和125I血管紧张素Ⅰ放射免疫分析药盒。我院实验室正常值参考范围为PRA水平(卧位)0.05~0.79 μg(/L·h),ALD水平(卧位)50~175 ng/L。
1.3 统计学分析 采用SPSS 17.0软件包进行统计分析。计量资料以均数±标准差(±s)表示。以10为组距,得ARR各组段PA和PH患者的频数,并由此计算各组段的ARR对诊断原醛的敏感度、特异度和Youden指数,并绘出ARR诊断原醛的受试者工作特征曲线(ROC曲线)。两样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 ARR各组段PA和PH患者的频数 ARR<30时,PH患者较多,而PA患者较少;ARR≥30时,PH患者较少,而PA患者较多,见表1。
2.2 PH组与PA组、APA组与IHA组实验室资料比较 PA组的ALD水平和ARR值高于PH组,PRA水平低于PH组,差异有统计学意义(P<0.05),见表2。因肾上腺皮质癌患者仅有3例,样本不足,未参与比较,PA患者中的APA组与IHA组ALD、PRA水平和ARR值间差异无统计学意义(P>0.05),见表3。
2.3 各组段的ARR对诊断PA的敏感度、特异度和Youden指数 随着ARR值的增加,其诊断PA的特异度呈上升趋势,而敏感度却呈下降趋势,而Youden指数越大,诊断效力越高。ARR值于30~60时,Youden指数较大,见表4。ARR诊断PA的ROC曲线,见图1。曲线最接近左上方的点即诊断的最佳位点,本研究中该点位于ARR值30~60间。
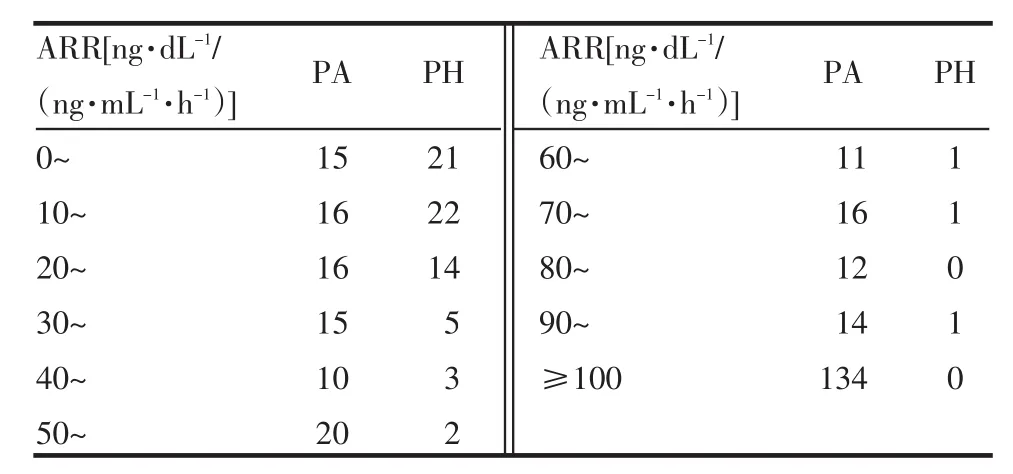
Table 1 Frequency number of aldosterone renin ratio in patients with primary aldosteronism and patients with primary hypertension表1ARR各组段PA和PH患者的频数 (例)
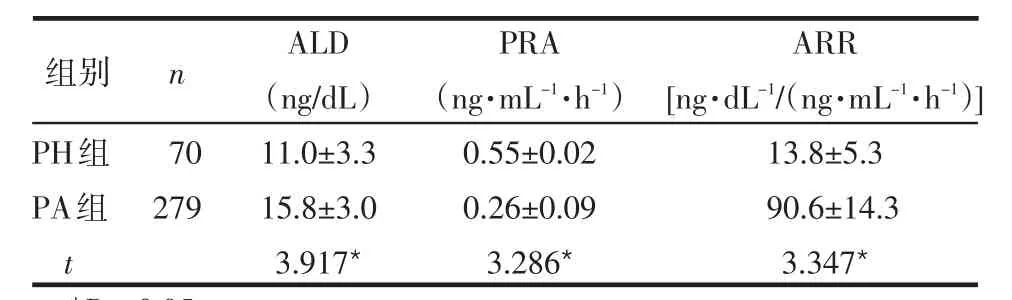
Table 2 Comparison of laboratory data between patients with primary aldosteronism and patients with primary hypertension表2 PH组与PA组实验室资料比较
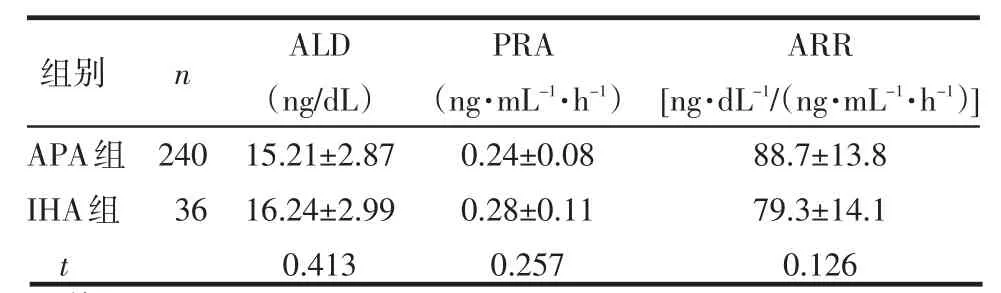
Table 3 Comparison of laboratory data between patients with aldosterone-producing adenoma and patients with idiopathic hyperaldosteronism表3APA组与IHA组实验室资料比较
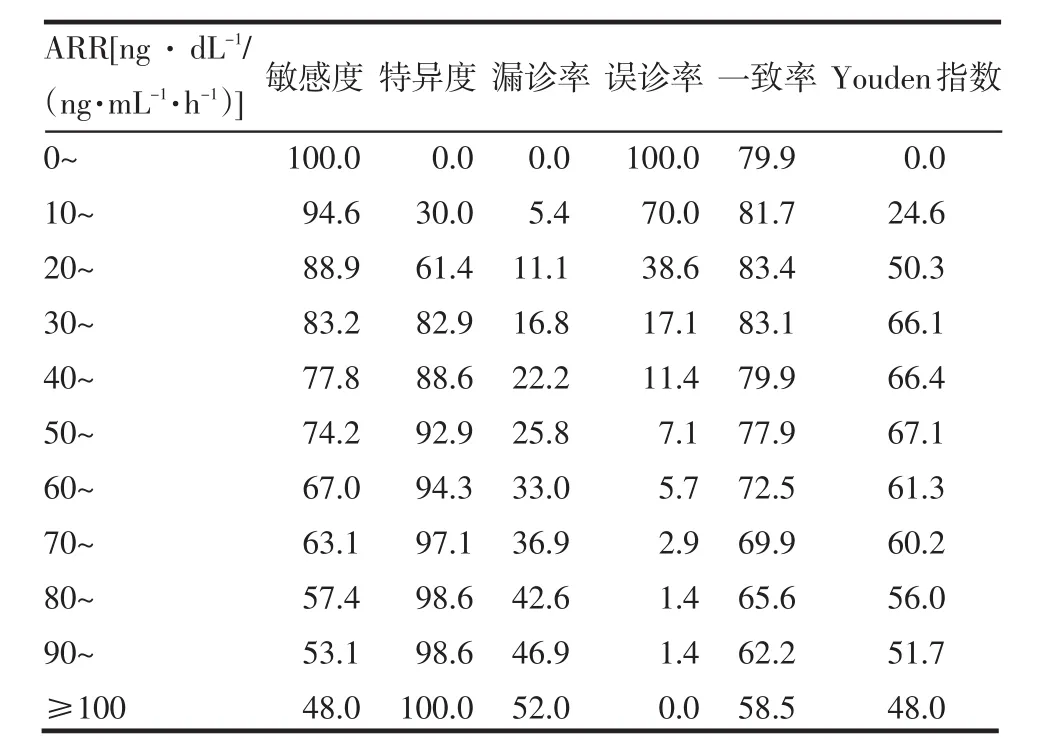
Table 4 Evaluation results of diagnostic test表4 诊断试验评价结果 (%)
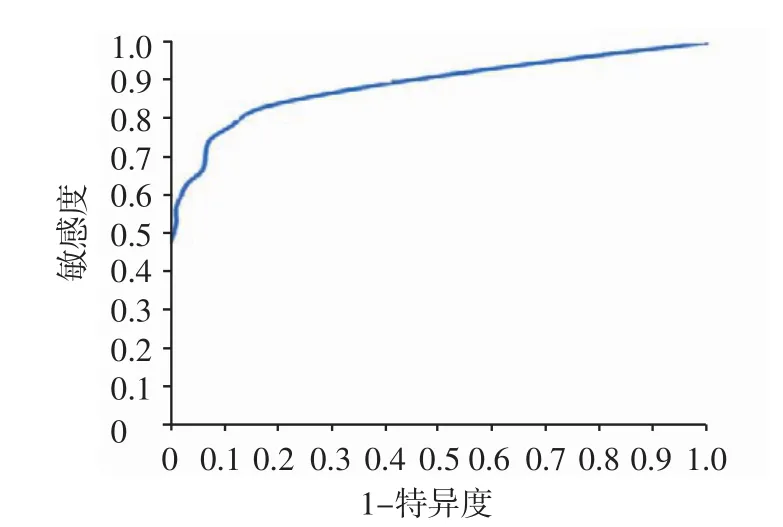
Figure 1 The ROC curve of the aldosterone renin ratio in the diagnosis of primary aldosteronism图1ARR诊断PA的ROC曲线
3 讨论
随着诊断水平的不断提高和对原发性醛固酮增多症认识的不断深入,PA患者的发现率在临床呈上升趋势,由于醛固酮具有独立于血压外的不良作用,近年来发现醛固酮不仅可以导致水钠潴留,而且可以促进组织胶原沉积、纤维化,导致心脑血管和肾脏损害的并发症的发生率高于PH患者[5]。有研究显示PA患者中心肌梗死、心律失常和脑卒中的发生率是PH患者的3~5倍[6]。PA与PH均以高血压为主要临床表现,而且部分PA不伴有低血钾,临床上鉴别诊断较为困难,但两者的治疗方法及预后不同,PA的治疗主要依靠外科手术,原发性醛固酮增多症的主要类型为APA和IHA,APA可占PA的65%~90%,IHA在成人原醛中占第二位,约占32%[7]。有研究显示APA患者一侧肾上腺手术后,超过70%的患者从中受益,包括血压恢复正常、低血钾纠正、降压药物使用数量减少、血压容易控制等[8]。而PH由于病因未完全明了,目前的治疗方式是生活方式的改变和药物治疗。因此,将PA和PH在临床上做一有效的鉴别诊断,以使PA患者得到更有效的治疗并降低并发症的发生率就显得十分重要。
ARR法作为PA初步筛查方法,于1994年由Gordon等[9]首先采用,在调查199例PH患者后发现至少有8.5%的患者为PA。但目前影响ARR值的因素较多,主要由于PRA是采用放射免疫法测定内源性血管紧张素原生成的血管紧张素Ⅰ来表示PRA活性,它不能完全真实地反映活性PRA的浓度,由于肾素的不稳定性,ARR的精确性受PRA的检测方法的影响较大,不同PRA放射免疫盒的敏感度差异也很大,这些因素无疑影响着ARR的可靠性。另外,患者的年龄、生活环境、人种、服用药物情况、各实验室检测水平不同,均造成数据在一定程度上缺乏可比性。也是导致ARR波动和切点值不统一的原因[10],故目前尚无确定的ARR值来诊断PA。
上述因素导致ARR的测定方法及阳性标准难以统一,尤其对ARR检查不同截断值的敏感性、特异性的系统研究较少,本研究显示,ARR在30~60之间时诊断原醛的敏感度、特异度及Youden指数较高,即ARR<30时,依据该指标,无法鉴别患者的高血压是由PA或PH所致,ARR于30~60时,应高度怀疑患者的高血压由PA所致,行肾上腺CT及肾上腺静脉插管取血(adrenal venous sampling,AVS),以进一步明确诊断。为选择治疗方法提供依据。
总之,作为一种诊断原发性醛固酮增多症的实验室检查方法,ARR简单实用。虽然ARR的结果受多因素的影响,对测定ARR的体位时间允许服用的降压药饮食状况检测方法进行标化,将提高ARR诊断PA的准确性和可比性。我院实验室检查ARR在30~60时诊断原醛的Youden指数较高,可以作为临床诊断原醛的一项重要辅助指标,但其不能对APA和IHA有效鉴别。
[1]Hiramatsu K,Yamada T,Yukimura Y,et al.A screening test to iden⁃tify aldosterone producing adenoma by measuring renin activity.Re⁃sults in hypertensive patients[J].Arch Intern Med,1981,141(12):1589-1593.
[2]Funder JW,Carey RM,Fardella C,et al.Case detection,diagnosis,and treatment of patients with primary aldosteronism:an endocrine society clinical practice guideline[J].Clin Endocrinol Metab,2008,93(9):3266-3281.
[3]Niizuma S,Nakahama H,Kamide K,et al.The cutoff value of aldo⁃sterone to renin ratio for the diagnosis of primary aldosteronism in patients taking antihypertensive medicine[J].Clin Exp Hypertens,2008,30(7):640-647.
[4]Tzanela M,Effremidis G,Vassiliadi D,et al.The aldosterone to re⁃nin ratio in the evaluation of patients with incidentally detected ad⁃renal masses[J].Endocrine,2007,32(2):136-142.
[5]朱理敏.原发性醛固酮增多症的诊断与治疗[J].内科理论与实践,2009,4(6):498-501.
[6]Catena C,Colussi G,Nadalini E,et al.Cardiovascular outcomes in patients with primary aldosteronism after treatment[J].Arch Intern Med,2008,168(1):80-85.
[7]李黎明.肾上腺疾病的外科治疗[M].北京:科学技术文献出版社,2011:161.
[8]Letavernier E,Peyard S,Amar L,et al.Blood pressure outcome of ad⁃renalectomy in patients with primary hyperaldosteronism with or without unilateral adenoma[J].Hypertens,2008,26(9):1816-1823.
[9]Gordon RD,Stowasser M,Tunny TJ,et al.High incidence of primary aldosteronism in 199 patients referred with hypertension[J].Clin Exp Pharmacol Physiol,1994,21(4):314-318.
[10]Nishikawa T,Saito J,Omura M.Prevalence of primary aldosteron⁃ism:should we screen for primary aldosteronism before treating hy⁃pertensive patients with medication[J]?Endocr J,2007,54(4):487-495.
