脑胶质瘤组织中的细胞周期分析与意义*
2012-07-21刘馨莲
刘馨莲 殷 舞 李 欣
细胞分子生物学研究认为,肿瘤的本质在于细胞周期的调控紊乱,细胞呈现失控性生长和凋亡减少[1]。细胞周期是细胞生命活动的基本过程,正常细胞周期是指正常连续分裂的细胞从前一次有丝分裂结束到下一次有丝分裂完成所经历的连续动态过程。主要分为4期:G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)和M期(有丝分裂期)。随着正常细胞周期和肿瘤细胞周期的深入研究,许多学者认为细胞生长周期的失调与多种肿瘤的发生、发展有关,且对肿瘤的恶性生物学行为及肿瘤的预后有重要意义[2-4]。本研究主要探讨细胞周期蛋白(Cyclin)D1、Cyclin A、Cyclin B1和核分裂特异性抗体(PHH3),分别代表G1期、S期、G2期和M期在脑胶质瘤中的表达特征和规律,以期为脑胶质瘤的早期诊断和预后评价提供理论依据。
1 资料与方法
1.1 一般资料 选取2003年9月—2008年2月广西壮族自治区人民医院手术切除的脑胶质瘤组织标本59例。其中男31例,女28例,年龄4~73岁,平均(46.2±19.6)岁。根据2000年WHO神经系统肿瘤分类标准:Ⅰ级10例,Ⅱ级15例,Ⅲ级15例,Ⅳ级19例。另外选取同时在该院接受因颅脑损伤行内减压术患者的正常脑组织37例为对照,全部标本均经10%甲醛固定,普通石蜡包埋,4 μm连续切片。
1.2 试剂 鼠抗人Cyclin D1、Cyclin A、Cyclin B1单克隆抗体购自BD Pharmingen公司,兔抗人PHH3多克隆抗体购自Upstate Group LLC公司,S-P试剂盒和SAP-9100试剂盒购自北京中杉生物技术开发公司,DAB试剂盒购自福州迈新生物技术开发公司。
1.3 方法 免疫组化染色采用S-P法。石蜡切片脱蜡水化后,微波抗原修复,过氧化酶阻断剂灭活内源性过氧化物酶活性,羊血清工作液封闭,滴加一抗4℃过夜,滴加生物素标记的二抗,滴加链亲和素—过氧化物酶溶液。PHH3标记用坚固红显色,其余标记均用DAB显色,苏木精复染。用已知阳性组织切片为阳性对照,用PBS代替一抗作为阴性对照。1.4 结果判断 Cyclin D1、Cyclin A、Cyclin B1蛋白染色均以细胞核出现棕黄色颗粒为阳性细胞,PHH3染色以细胞核出现红色颗粒为阳性细胞。计算Cyclin D1、Cyclin A、Cyclin B1及PHH3的标记指数(LI):选取10个阳性细胞最密集、背景最清晰区域,每个区域高倍视野(×400)下计算100个细胞中的阳性细胞数,计算1 000个肿瘤细胞中阳性细胞所占的百分比,取其平均值即为LI。
1.5 统计学方法 采用SPSS 13.0软件进行分析,所有数据采用均数±标准差(±s)表示,多组间均数比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
37例正常脑组织均无Cyclin D1、Cyclin A、Cy⁃clin B1和PHH3的表达。在59例人脑胶质瘤标本中,Cyclin D1阳性表达41例(69.5%),阳性染色信号出现于胞核,见图1。Cyclin A阳性表达41例(69.5%),阳性染色信号出现于胞核,见图2。Cy⁃clin B1阳性表达37例(62.7%),阳性染色信号出现于胞核,见图3。PHH3阳性表达50例(84.7%),阳性染色信号出现于胞核,见图4。4级脑胶质瘤的Cyclin D1、Cyclin A、Cyclin B1和PHH3的阳性LI比较差异均有统计学意义(P<0.01),见表1。
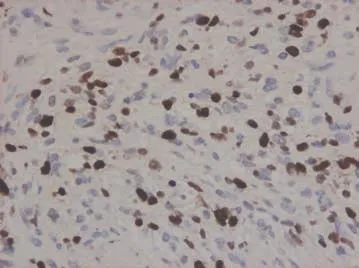
Figure 1 The positive expression of protein Cyclin D1 in gradeⅣ glioma(SP×400)图1 Cyclin D1蛋白在Ⅳ级胶质瘤细胞核中的阳性表达(SP×400)

Figure 2 The positive expression of protein Cyclin A in gradeⅢ glioma(SP×400)图2 Cyclin A蛋白在Ⅲ级胶质瘤细胞核中的阳性表达(SP×400)

Figure 3 The positive expression of protein Cyclin B1 in gradeⅣ glioma(SP×400)图3 Cyclin B1蛋白在Ⅳ级胶质瘤细胞核中的阳性表达(SP×400)

Figure 4 The positive expression of protein PHH3 in gradeⅣ glioma(SP×400)图4 PHH3蛋白在Ⅳ级胶质瘤细胞核中的阳性表达(SP×400)
Table 1 Comparison of Cyclin D1,Cyclin A,Cyclin B1 and PHH3 expressions between different grades of gliomas表1 各级胶质瘤中Cyclin D1、Cyclin A、Cyclin B1和PHH3的LI比较 (±s)
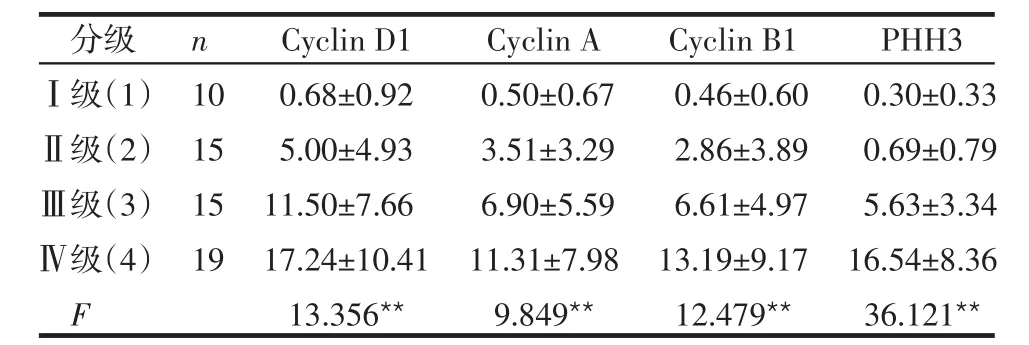
Table 1 Comparison of Cyclin D1,Cyclin A,Cyclin B1 and PHH3 expressions between different grades of gliomas表1 各级胶质瘤中Cyclin D1、Cyclin A、Cyclin B1和PHH3的LI比较 (±s)
**P<0.01
分级Ⅰ级(1)Ⅱ级(2)Ⅲ级(3)Ⅳ级(4)F n 10 15 15 19 Cyclin D1 0.68±0.92 5.00±4.93 11.50±7.66 17.24±10.41 13.356**Cyclin A 0.50±0.67 3.51±3.29 6.90±5.59 11.31±7.98 9.849**Cyclin B1 0.46±0.60 2.86±3.89 6.61±4.97 13.19±9.17 12.479**PHH3 0.30±0.33 0.69±0.79 5.63±3.34 16.54±8.36 36.121**
3 讨论
肿瘤的发生及发展是复杂而漫长的过程,有多种可能的机制,如癌基因的过度扩增,抑癌基因的缺失,生长因子信号传导通路的持续激活等。目前认为,这些机制可直接或间接影响细胞周期调控因子的功能,促进细胞周期持续演进,细胞进入自主无限制的增殖和分裂,表现出旺盛的增殖活性而发生恶性转化。从一定程度上讲,细胞周期是所有这些机制的“最后公路”。
Cyclin D1是G1期细胞周期素,与细胞同期依赖激酶(CDK4)或CDK6在G1期结合形成复合物,通过激活CDK4或CDK6,使后者催化一系列关键底物(如Rb蛋白)磷酸化导致转录因子释放,促进DNA合成而发挥加速细胞增殖的正性调节作用。正常情况下,Cyclin D1蛋白只是在G1期呈一过性表达,任何原因引起Cyclin D1持续高表达都将使细胞增殖失控,最终形成肿瘤。许多人类肿瘤组织中均发现染色体11q13区域的Cyclin D1基因扩增和Cyclin D1蛋白的过度表达,在肿瘤的进展和转移中起重要作用[5]。本研究结果显示Cyclin D1在正常脑组织中不表达,在各病理等级的脑胶质瘤组织中均存在Cyclin D1的表达,且其表达水平随着肿瘤恶性程度增高而呈升高趋势,说明胶质瘤组织中Cyclin D1的表达是存在的,并且在胶质瘤的发生发展过程中起重要作用,与肿瘤的恶性程度密切相关。
Cyclin A基因定位在染色体4q27上,它必须与CDK结合才能显示酶的活性。Cyclin A是细胞周期进入S期所必须的调节蛋白[6],它的过表达将导致处于S期的细胞明显增多,促进细胞增殖。Cyclin A不仅在S期与DNA复制有关,而且在有丝分裂的起始阶段也起着重要作用[7]。本研究结果显示Cyclin A在正常脑组织中不表达,在各病理等级的脑胶质瘤组织中均存在Cyclin A的表达,并且其表达水平随着肿瘤恶性程度增高而呈升高趋势,提示随着肿瘤级别的增加,有越来越多的细胞增殖活跃。
在G2期主要是Cyclin B1的表达增加,有丝分裂结束时降低[8]。Cyclin B1蛋白的浓度变化控制着细胞由G2期向M期的过渡,Cyclin B1在G2/M检测点的异常增高,是细胞恶性增殖的主要表现。Cy⁃clin B1在癌细胞中过表达,可能与激酶CDK1形成复合物,启动有丝分裂,越过细胞周期检查点,导致失控性的细胞增殖有关。本研究结果显示Cyclin B1在正常脑组织中不表达,在各病理等级的脑胶质瘤组织中均存在Cyclin B1的表达,并且其表达水平随着肿瘤恶性程度增高而呈升高趋势,提示Cyclin B1的过表达可增加进入G2/M期的细胞百分比,从而影响细胞周期的进程,促进细胞增殖。
真核细胞染色质的基本结构单位为核小体,组蛋白H3是核小体的组成成分之一。在分裂间期,组蛋白H3的丝氨酸残基的磷酸化是微不足道的,而在分裂期,磷酸化则达到了最高峰。PHH3是一种抗磷酸化的组蛋白H3的抗体,组蛋白H3的磷酸化与有丝分裂染色体的浓缩相关,并且在细胞的凋亡过程中没有组蛋白H3的磷酸化。本研究结果显示PHH3在正常脑组织中不表达,在各病理等级的脑胶质瘤组织中均存在PHH3的表达,并且其表达水平随着肿瘤恶性程度增高而呈升高趋势。因此,PHH3可以作为核分裂的特殊标记以快速、有效、客观地进行细胞增殖的定量分析[9]。
综上,Cyclin D1、Cyclin A、Cyclin B1和PHH3在细胞周期调控过程中起关键作用,检测脑胶质瘤组织中的Cyclin D1、Cyclin A、Cyclin B1和PHH3蛋白的表达水平,可辅助常规病理诊断并为判断预后提供信息。
[1]Sherr CJ.Cancer cell cycles[J].Science,1996,274(5293):1672-1677.
[2]张雷.Cyclin B1与肿瘤发生发展[J].第三军医大学学报,2003,25(18):1676-1678.
[3]孙永刚,彭贵勇,肖天利,等.食管癌组织中S期激酶相关蛋白2 mRNA的表达意义[J].第四军医大学学报,2006,27(6):565-567.
[4]黄曼玲,杨玉珍.细胞周期蛋白与消化道肿瘤[J].胃肠病学和肝病学杂志,2004,15(5):558-560.
[5]Nadal A,Cardesa A.Molecular biology of laryngeal squamous cell carcinoma[J].Virchows Arch,2003,442(1):1-7.
[6]叶菲,金银姬,金晓明,等.周期蛋白A,E在胃低分化腺癌中表达的研究[J].哈尔滨医科大学学报,2006,40(1):1-3.
[7]Pagano M,Pepperkok R,Verde F,et al.Cyclin a is required at two points in the human cell cycle[J].EMBO J,1992,11(3):961-971.
[8]Dynlacht BD.Regulation of transcription by proteins that control the cell cycle[J].Nature,1997,389:149-152.
[9]Orchel J,Slowinski J,Mazurek U,et al.H3 mRNA level as a new pro⁃liferative marker in astrocytomas[J].Biochim Biophys Acta,2004,1689(1):42-46.
