中华真地鳖抗肿瘤蛋白纯化、鉴定及活性研究
2012-07-21王凤霞吉爱国
王凤霞,刘 明,王 惠,刘 格,吉爱国
(1.山东大学药学院,山东 济南 250012;2.中国科学院海洋研究所,山东 青岛 266071;3.山东省科学院生物研究所,山东 济南 250014)
中华真地鳖(Eupolyphaga sinensis Walker)俗称土鳖子、土元等,是一种土栖的蜚蠊目(Blattodea)昆虫,广泛分布于全国各地,目前已实现大规模人工饲养。中华真地鳖作为一种传统中药,在我国具有悠久的药用历史。现代研究表明中华真地鳖具有抗血栓[1]、抗肿瘤[2-3]、促进骨折愈合[4]、免疫保护[5]等十分广泛的药理作用。近年来,国内学者相继从中华真地鳖中分离得到了抗肿瘤活性组分[2-3]及溶栓活性组分[6-8]等。本研究采用现代生化技术从该昆虫中分离得到了一分子质量约为72 kD的抗肿瘤蛋白组分(EPS72),并初步探讨了其体外抗肿瘤活性。
1 材料与方法
1.1 材料
中华真地鳖购于山东潍坊春源昆虫食品有限公司,-20℃ 冷冻保存备用。
人肺癌细胞株A549、肝癌细胞株Bel-7402、宫颈癌细胞株Hela、结肠癌细胞株RKO以及胰腺癌细胞株Panc-28均购自中国科学院上海细胞库。
CM-Sepharose Fast Flow、DEAE-Sepharose Fast Flow、HiTrap Q-Sepharose HP 柱(1 mL)、HiTrap Butyl Sepharose HP柱(1 mL)、Superdex 75 10/300GL柱均为瑞典GE Healthcare公司产品;10 kD MWCO离心超滤管购于美国Millipore公司;BCA蛋白含量检测试剂盒购于美国Pierce公司;蛋白Marker为美国Fermentas产品;四甲基偶氮唑盐(MTT)和二甲亚砜(DMSO)购于美国Sigma公司;RPMI 1640培养基、F-12K培养基、胎牛血清(FBS)、青链霉素、胰蛋白酶为美国Gibco公司产品。
QuixStand膜过滤分离系统以及AKTA Explorer 100快速蛋白质纯化系统(FPLC),瑞典GE Healthcare;Mini-电泳系统,北京六一仪器厂;Elx800酶标仪,美国Bio Tek;Du650紫外/可见分光光度计,美国Beckman公司。
1.2 中华真地鳖蛋白粗提物的制备
取洗净的昆虫材料加入2 L/kg预冷的生理盐水进行组织匀浆,4℃浸提过夜,脱脂棉过滤,4℃条件下10 000 r/min离心15 min,小心刮去上层油脂,弃沉淀。上清经400目滤网过滤后,加入硫酸铵至50%饱和度,4℃静置4 h进行盐析,然后在4℃条件下10 000 r/min离心15 min,弃沉淀。上清液继续加入硫酸铵至80%饱和度,置4℃冰箱4 h,同样条件下再次离心,弃上清,收集沉淀,用适量水溶解沉淀。将溶解后的硫酸铵分级沉淀部分先用QuixStand膜过滤分析系统进行微滤,滤出液用UFP-10-C-4MA膜组件(截留分子质量为10 kD)进行超滤去除小分子并脱盐,大于10 kD组分经冷冻干燥后即得到蛋白粗提物。
1.3 抗肿瘤活性成分的色谱分离与纯化
1.3.1 CM-Sepharose Fast Flow 阳离子交换色谱取一定量的蛋白粗提物溶于缓冲液A(50 mmol/L乙酸缓冲液,pH 5.5),将样品上样于预先用缓冲液A平衡的CM-Sepharose FF阳离子交换柱(2.6 cm×10 cm),流速为10 mL/min。上样后柱子先用缓冲液A冲洗5个柱体积洗脱未充分结合的蛋白,结合的蛋白先后用0.15和1.0 mol/L NaCl溶液(溶于缓冲液A中)洗脱2个柱体积。整个色谱过程采用280 nm检测蛋白质洗脱情况,分别收集各洗脱峰,采用活性跟踪法确定活性组分。
1.3.2 DEAE-Sepharose Fast Flow 阴离子交换色谱
取1.3.1项下得到的活性组分采用离心超滤(10 kD超滤管)的方法转到缓冲液B(20 mmol/L Tris-HCl缓冲液,pH 8.0)后上样于用缓冲液B平衡的阴离子交换柱DEAE-Sepharose FF(2.6 cm×10 cm),流速为10 mL/min。未充分结合的蛋白先用缓冲液B 洗5 个柱体积,结合的蛋白先后用 0.1,0.2,0.3和1.0 mol/L NaCl溶液(溶于缓冲液B中)洗脱2个柱体积。收集活性峰。
1.3.3 Q-Sepharose High Performance 阴离子交换色谱 将1.3.2项下的活性组分采用离心超滤的方法转到缓冲液C(50 mmol/L磷酸缓冲液,pH 7.0)后上样于用缓冲液C平衡的HiTrap Q-Sepharose HP离子交换柱(1 mL),流速为1 mL/min。充分洗脱未结合蛋白后,结合的蛋白先用0~0.5 mol/L NaCl溶液(溶于缓冲液C)进行线性梯度洗脱,洗脱体积为20 mL,然后用1.0 mol/L NaCl溶液(溶于缓冲液C)洗脱2个柱体积。收集活性组分。
1.3.4 Butyl Sepharose High Performance 疏水色谱
将1.3.3项下的活性组分的pH和电导调整至与缓冲液D(含有1.0 mol/L硫酸铵的50 mmol/L磷酸缓冲液,pH 7.0)一致,上样于用缓冲液D平衡的HiTrap Butyl Sepharose HP疏水色谱柱(1 mL),流速为1 mL/min。柱子先用缓冲液D 5 mL充分冲洗,结合的蛋白采用线性梯度的1.0~0 mol/L硫酸铵溶液(溶于50 mmol/L磷酸缓冲液,pH 7.0)进行洗脱,洗脱体积为20 mL。收集活性组分。
1.3.5 Superdex 75凝胶过滤色谱 将1.3.4项下的活性组分进行超滤脱盐和浓缩后,取100 μL上样于用0.15 mol/L NaCl溶液平衡的Superdex 75 10/300GL凝胶过滤柱。用相同的洗脱液洗脱2个柱体积,洗脱流速为0.8 mL/min。收集活性峰组分,进行超滤脱盐并浓缩后冷冻干燥备用。
1.4 BCA蛋白分析试剂盒测定蛋白浓度
蛋白浓度的测定采用Pierce公司的BCA Protein Assay Kit,依据说明书进行操作。
1.5 分子质量的测定
纯化的活性组分的纯度及表观分子质量采用SDS-PAGE方法进行判定。参照LaemmLi方法[9]实验,其中分离胶浓度为12%,浓缩胶浓度为5%,稳压操作,浓缩胶电压为80 V,分离胶电压为120 V。采用考马斯亮蓝R-250染色。用预染的中低分子质量的蛋白Marker作对照,判定纯化组分的纯度及表观分子质量。同时采用MALDI-TOF质谱仪进行分子质量的测定。将纯化的活性组分样品冻干后,送至中国科学院上海生命科学研究院蛋白质组学研究分析中心,进行MALDI-TOF质谱检测。
1.6 细胞培养及MTT活性分析
A549细胞采用 F-12K培养基,Bel-7402、Hela、RKO以及Panc-28细胞采用RPMI 1640培养基。将肿瘤细胞接种于含10%FBS、100 u/mL青霉素和100 mg/mL链霉素的F-12K或RPMI 1640培养液中,置于37℃、5%CO2培养箱内培养,取对数生长期细胞用于实验。
MTT活性分析参照Mosmann方法[10]。取对数生长期的癌细胞,用胰酶消化后调整细胞悬液的密度,以5×103个/孔的密度接种于96孔板中,每孔100 μL,在37℃条件下贴壁培养24 h。然后每孔加入含不同浓度纯化组分的培养液100 μL,对照组用培养液代替EPS72,空白组用相应的培养液代替细胞悬液和EPS72,各组设3个平行孔,置于细胞培养箱中继续培养48 h。每孔加入5 mg/mL MTT溶液30 μL,继续培养4 h,弃除孔中培养液,然后每孔加入DMSO 150 μL,振动15 mim以充分溶解甲瓒结晶。酶标仪检测各孔在570 nm波长处吸光度(A)值,实验至少重复3次。细胞抑制率 =[(A对照-A样品)/A对照]×100%。采用 Excel分析软件计算半数抑制浓度IC50。
1.7 统计学处理
数据使用SPSS16.0分析软件进行处理,数据以(x±s)表示,显著性检验采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CM-Sepharose FF阳离子交换色谱分离纯化结果
超滤得到的蛋白粗提物(命名为活性组分I)首先通过CM-Sepharose FF弱阳离子交换柱进行色谱分离,色谱图见图1。在该条件下,大部分蛋白未挂柱(C0),而用0.15 mol/L NaCl溶液洗脱时出现2个不能完全分开的峰(C1和C2),故将2个峰合并收集,用1.0 mol/L NaCl溶洗脱出1个较小的峰(C3)。分别收集上述3个组分,超滤脱盐并冻干后进行MTT体外抗肿瘤活性检测,细胞株为人肝癌细胞Bel-7402。结果发现,0.15 mol/L NaCl溶液洗脱组分(即C1和C2合并组分)对Bel-7402细胞具有较强细胞毒活性,而另外2个组分(C0和C3)无明显活性。因此,选取0.15 mol/L NaCl溶液洗脱组分(命名为活性组分Ⅱ)进行下一步实验。从图中可以看出,此步色谱有效捕获了活性成分。

图1 中华真地鳖蛋白粗提物(活性组分Ⅰ)CM-Sepharose FF阳离子交换色谱图谱Fig.1 CM-Sepharose FF cation exchange chromatography of E.sinensis crude protein extracts(bioactive fractionⅠ)
2.2 DEAE-SepharoseFF阴离子交换色谱分离纯化结果
将活性组分Ⅱ通过DEAE-Sepharose FF弱阴离子交换柱进行进一步色谱分离,分别收集图2所示的5个峰,脱盐冻干后进行体外抗肿瘤活性检测。结果表明,活性组分为0.3 mol/L NaCl溶液洗脱部分(D3),选取0.3 mol/L NaCl溶液洗脱组分(命名为活性组分Ⅲ)进行下一步实验。从图2中可以看出,此步色谱进一步有效捕获了活性成分。
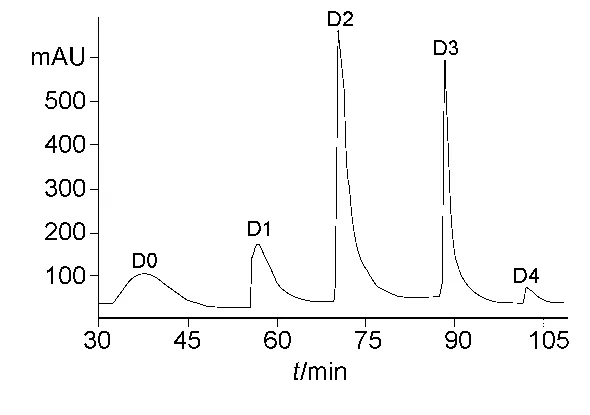
图2 活性组分Ⅱ的DEAE-Sepharose FF阴离子交换色谱图谱Fig.2 DEAE-Sepharose FF anion exchange chromatography of the bioactive fractionⅡ
2.3 Q-Sepharose HP阴离子交换色谱分离纯化结果
将活性组分Ⅲ经Q-Sepharose HP强阴离子柱进行色谱纯化,色谱图见图3。可以分离到4个组分,其中组分Q0(未挂柱)和Q1(挂柱)含量较高,组分Q3含量较低,而Q2含量甚微。分别收集Q0、Q1和Q3等3个组分脱盐冻干后进行活性检测,结果表明,峰Q1为活性组分(命名为活性组分Ⅳ),收集活性组分进行下一步精制纯化。
2.4 Butyl SepharoseHP疏水色谱分离纯化结果

图3 活性组分Ⅲ的Q-Sepharose HP阴离子交换色谱图谱Fig.3 Q-Sepharose HP anion exchange chromatography of the bioactive fractionⅢ
将活性组分Ⅳ经Butyl Sepharose HP进行进一步纯化,见图4。可以分离到4个组分,其中组分B0(未挂柱)和B2(挂柱)含量较高,而组分B1和B3含量较低。分别收集这4个组分脱盐冻干进行活性检测,结果表明,峰B2为活性组分(命名为活性组分Ⅴ),收集活性组分进行下一步精制纯化。

图4 活性组分Ⅳ的Butyl Sepharose HP疏水色谱图谱Fig.4 Butyl Sepharose HP hydrophobic interaction chromatography of the bioactive fractionⅣ
2.5 Superdex 75凝胶过滤色谱分离纯化结果
取浓缩后的活性组分V 100 μL上样于Superdex 75 10/300GL柱进行进一步精制,色谱图见图5。活性组分Ⅴ经此步色谱纯化后共得到3个组分,其中峰f1含量最高,而峰f3含量甚微。分别收集f1和f2组分进行活性检测,结果表明,峰f1为活性组分(命名为活性组分Ⅵ),收集活性组分冻干后进行纯度鉴定及分子质量分布测定。

图5 活性组分V的Superdex 75凝胶过滤色谱图谱Fig.5 Superdex 75 gel filtration chromatography of the bioactive fraction V
2.6 组分Ⅵ分子质量测定
SDS-PAGE测定活性组分Ⅵ的分子质量结果见图6。活性组分Ⅵ在SDS-PAGE中显示为单一的条带,表明其达到了电泳纯。根据预染蛋白Marker的迁移位置判定其表观分子质量为72 kD,该结果与MALDI-TOF质谱法分析得到的分子质量为71 737.3的结果(图7)接近,说明我们从中华真地鳖中纯化得到的抗肿瘤活性成分是分子质量约为72 kD的单链蛋白,命名为EPS72。

图6 纯化的活性组分Ⅵ的SDS-PAGE电泳图谱Fig.6 SDS-PAGE pattern of the purified bioactive fractionⅥ

图7 纯化的活性组分Ⅵ的MALDI-TOF质谱图Fig.7 The MALDI-TOF mass spectra of the purified bioactive fractionⅥ
2.7 分离过程中各活性组分的体外抗肿瘤活性检测
采用MTT比色法对分离过程中各活性组份进行追踪,将每步得到的活性组份用于下一步分离。纯化过程中各活性组分对人肝癌Bel-7402细胞株48 h的细胞毒性(IC50)见表1。由表1可知,蛋白粗提物经过5步色谱分离与纯化后,得到抗肿瘤蛋白成分对肝癌Bel-7402细胞表现出较好的细胞毒性。
2.8 EPS72对肿瘤细胞生长存活的影响
Bel-7402、A549、Hela、RKO 及 Panc-28 细胞分别用不同浓度(5,10,20,30 和 40 μg/mL)的 EPS72处理48 h,MTT法分析其对细胞生长的影响,结果见表 2。当 EPS72浓度达到 10 μg/mL以上时,EPS72对5株肿瘤细胞均有不同程度的抑制作用,且呈明显量效关系。显示该活性蛋白成分具有较强的广谱抗肿瘤活性。通过比较EPS72对各种细胞的IC50发现,EPS72除对人胰腺癌细胞株Panc-28的IC50较高外,对人肝癌Bel-7402细胞、肺癌A549细胞、宫颈癌Hela细胞以及结肠癌RKO细胞的IC50比较接近,均在18.76 ~20.05 μg/mL 范围内。
表1 纯化过程中各活性组分对人肝癌Bel-7402细胞株的细胞毒性(± s,n=3)Tab.1 The cytotoxicity against Bel-7402 cells of the separate bioactive fractions from E.sinensis Walker(± s,n=3)

表1 纯化过程中各活性组分对人肝癌Bel-7402细胞株的细胞毒性(± s,n=3)Tab.1 The cytotoxicity against Bel-7402 cells of the separate bioactive fractions from E.sinensis Walker(± s,n=3)
纯化步骤 粗提物(组分Ⅰ)CM-Sepharose FF(组分Ⅱ)DEAE-Sepharose FF(组分Ⅲ)Q-Sepharose HP(组分Ⅳ)Butyl Sepharose HP(组分Ⅴ)Superdex 75(组分Ⅵ)IC50/(μg/mL)458.22 ±6.97 206.75 ±4.61 98.54 ±3.23 47.18 ±1.74 31.36 ±1.36 20.01 ±1.13
表2 EPS72对体外培养A549、Bel-7402、Hela、RKO及Panc-28癌细胞48 h的抑制率(± s,n=3)Tab.2 Growth inhibitory effects of EPS72 on A549,Bel-7402,Hela,RKO and Panc-28 cells in vitro(± s,n=3)

表2 EPS72对体外培养A549、Bel-7402、Hela、RKO及Panc-28癌细胞48 h的抑制率(± s,n=3)Tab.2 Growth inhibitory effects of EPS72 on A549,Bel-7402,Hela,RKO and Panc-28 cells in vitro(± s,n=3)
与对照组比较:1P <0.05,2P <0.01 1P <0.05,2P <0.01 vs control group
剂量(μg/mL)抑制率/%Bel-7402 A549 Hela RKO Panc-28 0(对照组)00000 5 3.82 ±2.45 4.49 ±1.77 7.08 ±2.321 6.86 ±2.741 1.03 ±3.06 10 20.47 ±3.212 18.97 ±2.882 25.72 ±2.812 21.65 ±3.072 7.04 ±2.201 20 62.68 ±1.912 63.26 ±1.862 66.59 ±1.992 62.95 ±2.362 39.06 ±2.602 30 83.84 ±2.522 84.03 ±2.452 86.17 ±1.332 85.12 ±1.802 63.82 ±2.312 40 92.17 ±1.512 91.69 ±1.692 92.83 ±2.442 94.60 ±1.422 73.81 ±1.822 IC50/(μg/mL) 20.01 ±1.13 20.05 ±0.96 18.76 ±0.84 19.39 ±0.72 26.80 ±1.35
3 讨论
关于药用土鳖虫中华真地鳖的化学成分及药理作用方面的研究进展,我们曾做过综述[11]。本研究依次采用硫酸铵分级沉淀、超滤、CM-Sepharose FF阳离子交换色谱、DEAE-Sepharose FF阴离子交换色谱、Q-Sepharose HP阴离子交换色谱、Butyl Sepharose HP疏水色谱以及Superdex 75凝胶过滤色谱等蛋白质分离纯化技术,以人肝癌细胞株Bel-7402作为受试细胞,通过MTT活性追踪法,从中华真地鳖体内分离纯化出一种抗肿瘤活性蛋白成分。SDSPAGE以及MALDI-TOF质谱结果表明,该活性成分是分子质量约为72 kD的单链蛋白,命名为EPS72。韩雅莉等[3]曾从中华真地鳖中分离得到抗肿瘤糖蛋白组分,但由于他们未对获得的组分进一步进行鉴定,我们得到的抗肿瘤成分与他们报道的是否属于同一种物质不得而知。据已有的文献报道,EPS72是第一个明确确定分子质量的抗肿瘤蛋白成分。我们曾尝试对该成分进行氨基酸末端序列分析,但分析结果表明,由于该成分存在末端封闭现象,我们无法获知其准确的N端序列。下一步将考虑采用酶解后分段测序的方法获知其序列。
体外抗肿瘤活性实验表明,EPS72对人肝癌Bel-7402细胞、肺癌A549细胞、宫颈癌Hela细胞、结肠癌RKO细胞以及胰腺癌Panc-28细胞具有明显的增殖抑制作用,并且呈明显的量效关系。显示该活性蛋白具有较强的广谱抗肿瘤活性。而且,该活性蛋白对人肝癌Bel-7402细胞及肺癌A549细胞显示较高的体外抗肿瘤活性,显示其具有潜在的抗肝癌和肺癌作用,其抗肿瘤机制及体内疗效、安全性等方面的内容还有待进一步研究。
[1]王 征,陈晓光,吴 岩.土鳖虫溶栓酶抗凝血及抗血栓作用的实验研究[J].中国实验诊断学,2007,11(9):1143-1145.
[2]邹 玺,刘宝瑞,钱晓萍,等.土鳖虫脂肪酸乳剂的制备及体内抗肿瘤作用[J].肿瘤,2007,27(4):333-334.
[3]韩雅莉,谢 昆.土鳖虫糖蛋白的提取及抗肿瘤活性初步研究[J].汕头大学学报:自然科学版,2006,21(4):46-50.
[4]罗佩强.土鳖虫促进骨折愈合的实验研究[J].中国骨伤,1992,5(6):6-7.
[5]杨耀芳,彭名淑,杨翊雯,等.土鳖虫对血虚小鼠红细胞免疫功能的实验研究[J].中国免疫学杂志,2003,19(10):686-689.
[6]李卫星,王中枢.地鳖血纤维蛋白溶酶原激活物样成分的研究[J].中国生物化学与生物物理学学报,1989,21(4):299-306.
[7]王淑敏,赵学良,王本祥,等.中药土鳖虫溶栓成分的分离纯化研究[J].分析化学,2005,33(10):1385-1388.
[8]韩雅莉,李张伟.地鳖虫纤溶成分的分离纯化和活性测定[J].中药材,2006,29(8):765-767.
[9]LaemmLi U K.Cleavage of structural protein during the assembly of head of bacteriophages T4[J].Nature,1970,227:680-685.
[10]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1-2):55-63.
[11]王凤霞,吉爱国.药用土鳖虫化学成分及药理作用研究进展[J].中国生化药物杂志,2009,30(1):61-64.
