IL-1通过PKC/MAPK激活蛋白激酶通路上调泡沫细胞ACAT-1的表达及活性
2012-07-18王庸晋王治平周胜华
王庸晋,王治平,魏 武,周胜华
(长治医学院1.附属和平医院心内科;2.心血管病研究所;3.内科学教研室,山西长治046000;4.中南大学湘雅二医院,湖南长沙 410011)
脂酰CoA胆固醇酯酰转移酶-1(ACAT-1)是调节体内胆固醇代谢平衡的关键蛋白之一,在动脉粥样硬化(Atherosclerosis,AS)发生的早期起重要作用。IL-1是调节炎性反应的始动因素,可诱发包括AS在内的多种心血管疾病[1]。前期研究发现IL-1可上调单核细胞向泡沫细胞分化过程中ACAT-1的表达及酶活性[2-3]。另有研究证实,IL-1可通过丝裂原激活蛋白激酶(MAPK)信号通路导致炎性反应,蛋白激酶C(PKC)可直接磷酸化MAPK上游的原癌基因产物raf-1,从而激活ras介导的MAPK活化[4]。本研究旨在观察IL-1是否通过PKC/MAPK信号通路上调泡沫细胞中ACAT-1的表达及活性。
1 材料与方法
1.1 材料
1.1.1 人单核细胞白血病细胞系/THP-1细胞(武汉大学典型培养物保藏中心)。
1.1.2 细胞培养及实验分组:细胞复苏后,用含10%胎牛血清的RPMI 1640的完全培养基在37℃、5%CO2的环境下培养。取对数生长期细胞,根据干预因素不同设置3个组:泡沫细胞组(巨噬细胞+Ox-LDL培养24 h,FC组)、泡沫细胞+IL-1组(巨噬细胞+Ox-LDL+IL-1培养24 h,FC+IL-1组)、泡沫细胞加IL-1/Anti-IL1组(巨噬细胞+Ox-LDL+IL-1+Anti-IL1培养24 h,FC+IL-1+Anti-IL1组)。1.1.3 主要试剂:RPMI1640培养基和胎牛血清(Gibco BRL公司),乙酸肉豆蔻佛波酯(PMA)(Calbiochem公司),IL-1 alpha(蛋白)与 IL-1 alpha(抗体)(AMS公司),低密度脂蛋白(AppliChem公司),Tris-Base、SDS、胆固醇油酰酯、油酰 CoA和 Triton WR-1339等(Sigma公司),PKC抑制剂 GF109203和MAPK抑制剂Apigenin(上海吉泰生物科技有限公司),PepTag蛋白激酶C活性检测试剂盒(Progema公司),MAPK及ACAT-1单克隆抗体(Santa Cruz公司),二抗稀释液(湖南省力欣生物科技公司),油红O(湖南欧迈生物科技有限公司)。
1.2 方法
1.2.1 主要细胞培养液体的配制:1)PMA的配制:加DMSO溶解PMA粉剂为终浓度100 mmol/L的PMA 原液,取原液10 μL加入 DMSO 240 μL,得到终浓度为4 mmol/L的PMA工作液。每毫升培养基加PMA工作液5 μL为终浓度200 nmol/L。2)氧化型低密度脂蛋白(Ox-LDL)的制备:将LDL置于无EDTA的0.01 mol/L,pH 7.4的 PBS溶液中透析40 h,然后加入含CuSO4的PBS溶液中(Cu2+终浓度为5 μmol/L)37℃氧化24 h。氧化结束后,加入含有EDTA(终浓度为10 μmol/L)的PBS溶液中透析24 h,4℃避光保存。BCA法测定Ox-LDL的浓度以确定LDL的氧化程度。
1.2.2 油红O染色:细胞爬片取出,PBS冲洗3次,滤纸吸去多余水分;10%中性甲醛固定10 min,油红O液中染3~5 min;60%异丙醇洗去多余染液,PBS冲洗3次;苏木素复染10~15 min,1%盐酸分色及返蓝10 s,蒸馏水洗3次;甘油明胶封固,显微镜下观察并拍照记录。
1.2.3 PKC活性检测:常规RIPA裂解液提取细胞总蛋白并采用Bradford法测定总蛋白的浓度。采用非放射性酶法PepTag蛋白激酶C活性检测试剂盒检测PKC活性。原理如下:PKC作用于底物后,磷酸化的底物向正极泳动,而未磷酸化的底物向负极泳动,利用电泳琼脂糖凝胶技术显示2种不同蛋白,将显示的不同蛋白定量,以磷酸化PKC与非磷酸化PKC灰度值的比值表示PKC的活性。
1.2.4 Western blot各组细胞蛋白质提取:取出所需细胞,倒去培养液,加入细胞裂解液100 μL;冰上放置20 min后,用细胞刮子刮下细胞,转移到离心管中;4℃,12 000 ×g离心20 min,吸取上清液。取上清液3 μL-i-DEPC 水57 μL(即稀释20 倍)+考马斯亮蓝G-250 3 mL,充分摇匀约15 min,同时以考马斯亮蓝G-250 3 mL作为空白对照,用Bradford法测定蛋白质的浓度,其余蛋白80℃冰箱保存备用。经制胶、样品制备、上样、电泳、转膜、抗原抗体反应及显迹等操作步骤,最后以凝胶成像分析系统摄像并分析。
1.2.5 ACAT-1活性检测:用低张休克法[5]获取细胞中的蛋白质。酶反应液中包括100 μg待测蛋白、1 mg BSA、游离胆固醇和 Triton WR-1339(20 μg∶600 μg); 加0.1 mmol/L 磷 酸钾 缓 冲液(pH 7.4,含10 mmol DTT) 至180 μL,37℃孵育30 min后加入20 μL〔1-14C〕油酰CoA溶液 (用未标记的油酰CoA,3.7×105Bq,反应体系终浓度为20 μmol/L)37℃ 孵育10 min,加入氯仿∶甲醇(2∶1,V/V)终止反应,加入0.8 mL水使有机相分离;取下层相液体 (氯仿相)进行薄层层析,展层系统为正己烷∶已醚∶冰已酸 (V∶V∶V)=170∶30∶1,以胆固醇油酰酯作对照,用碘蒸气显色后剪下胆固醇斑点 (Rf=0.71)放入装有5 mL闪烁液中,用液体闪烁计数仪检测酶活性[酶活性单位为nmol/(mg·min)]。
1.3 统计学方法
实验数据用SPSS统计软件进行分析,实验结果以均数±标准差表示(±s),各组数据间的统计采用方差分析。
2 结果
2.1 泡沫细胞的诱导建立
THP-1单核细胞呈圆形、悬浮式、非贴壁形式生长(图1A);经PMA诱导48 h后,细胞体积增大,由圆形变成卵圆形、梭形、不规则形,贴壁式生长,转化为巨噬细胞(图1B);经Ox-LDL诱导24 h后,细胞体积进一步增大,细胞膜突触形成明显,胞质增加,疏松化,可见大量脂质小滴;经油红O染色后,细胞质内可见红染物质(图1C)。
2.2 PKC活性检测结果
FC+IL-1组PKC活性为0.959±0.02,显著高于FC组的0.618±0.01(P<0.05),FC+IL-1+Anti-IL1组PKC活性为0.593±0.02显著低于FC+IL-1组(P<0.05)(图2)。
2.3 MAPK蛋白表达检测结果
FC+IL-1组磷酸化的MAPK蛋白表达为0.773±0.02显著高于FC组0.601±0.01(P<0.05),FC+IL-1+Anti-IL1组磷酸化的MAPK蛋白表达为0.558±0.01显著低于FC+IL-1组(P<0.05)(图3)。
2.4 PKC抑制剂和MAPK抑制剂对ACAT-1蛋白表达的影响
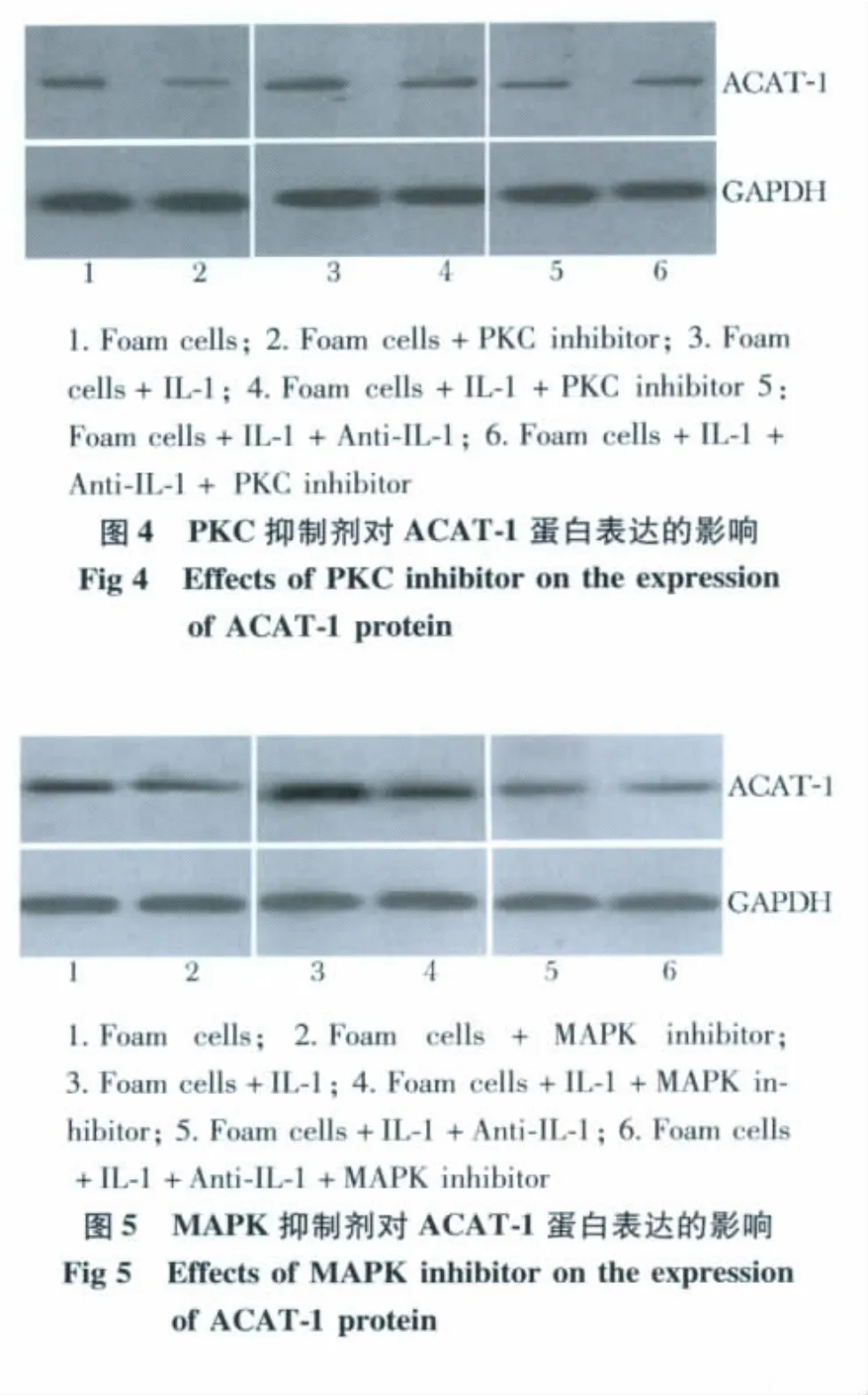
各组中加抑制剂前后相比,3组细胞ACAT-1蛋白表达均下调(P<0.05)(表1,图4,5)
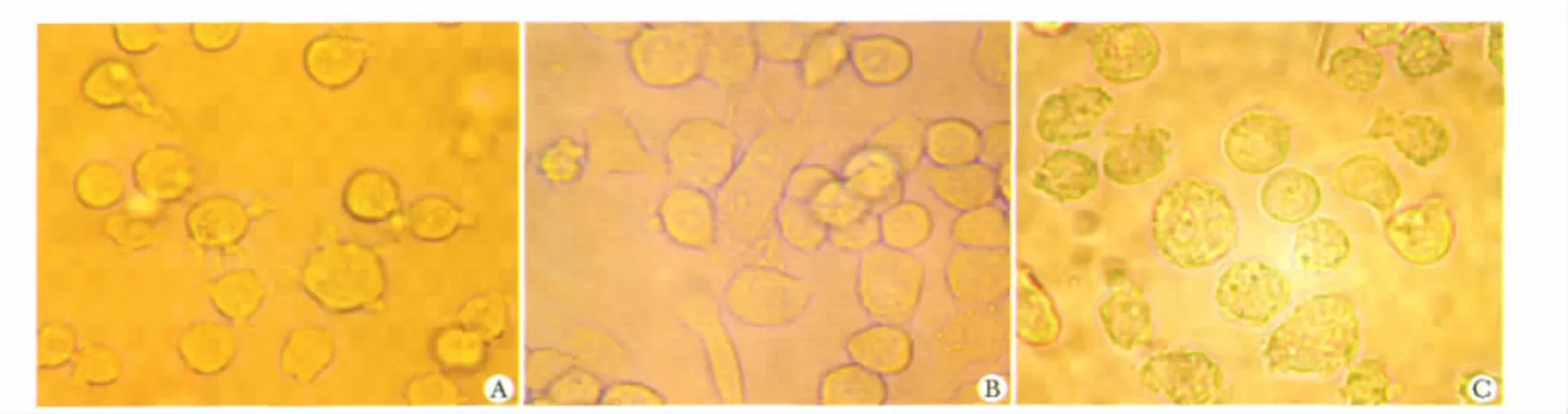
图1 3种细胞的形态学变化Fig 1 Morphological changes of three cells(×400)
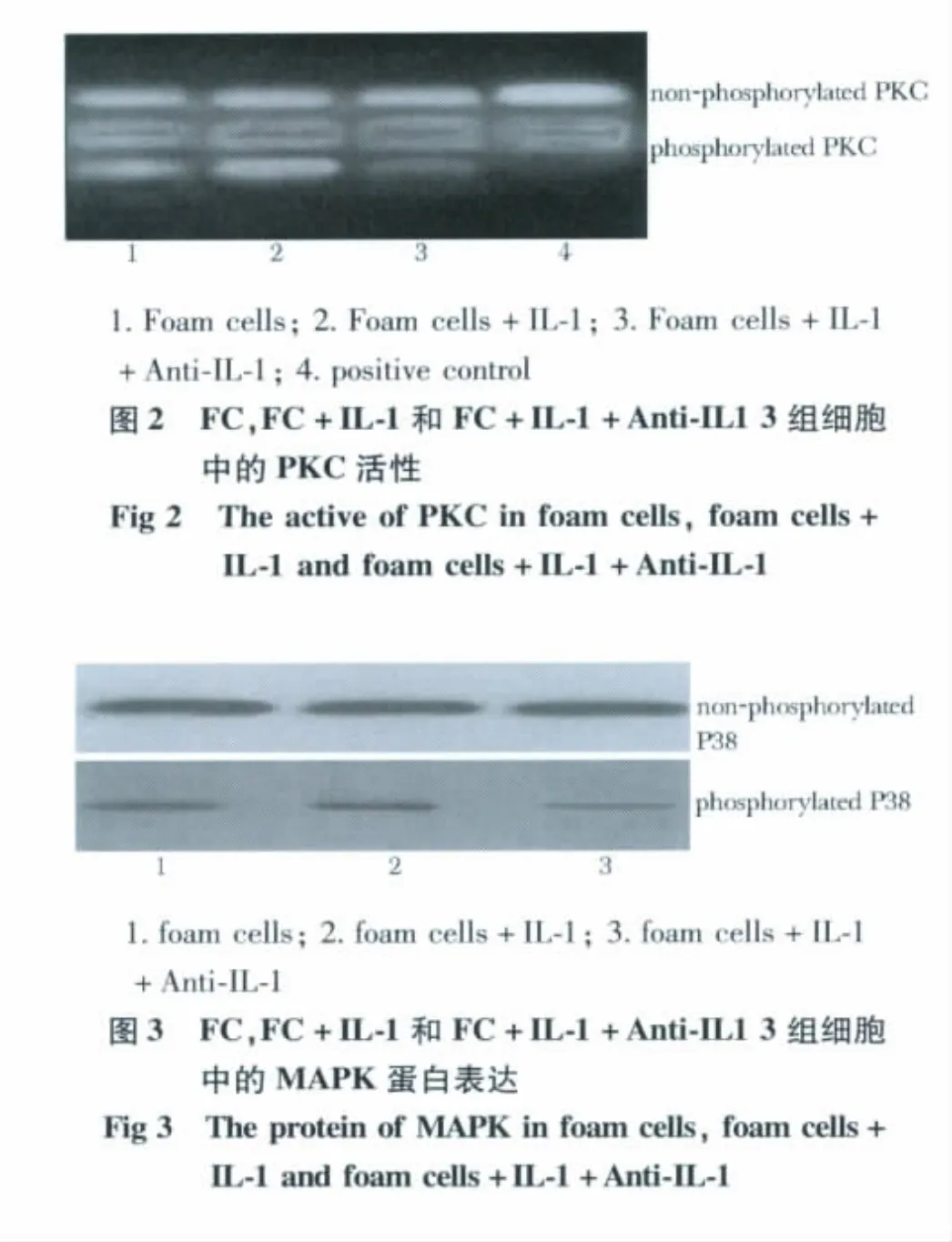
2.5 PKC和MAPK抑制剂对ACAT-1酶活性的影响
各组中加抑制剂组前后相比,3组细胞的ACAT-1酶活性均明显下调(P<0.05)(表1)。
3 讨论
ACAT是细胞内唯一催化胆固醇与长链脂肪酸酯化形成胆固醇酯的酶,它在生物体吸收、运输和储存胆固醇过程中起着极其重要的作用[6],在单核-巨噬细胞内主要以ACAT-1的形式存在[7]。研究发现,在AS斑块分离的泡沫细胞中,胆固醇酯的合成速率及ACAT-1的活性明显增加[8]。泡沫细胞中的胆固醇酯富含油酰胆固醇,主要通过胆固醇酯循环由ACAT-1催化重新合成[9]。ACAT-1活性增高,导致细胞内胆固醇酯合成速率增加,含量增多,单核-巨噬细胞随之向泡沫细胞转化。本研究以人单核细胞白血病细胞系/THP-1细胞为模型,经PMA诱导转化为巨噬细胞,继续经Ox-LDL作用后,巨噬细胞吞噬脂质,脂质在细胞内转化为胆固醇酯并发生聚积,最终转化为泡沫细胞。
表1 PKC抑制剂和MAPK抑制剂对ACAT-1蛋白表达及酶活性的影响Table 1 Effects of PKC inhibitor and MAPK inhibitor on the expression of ACAT-1 protein and active[±s,nmol/(mg·min),n=6]
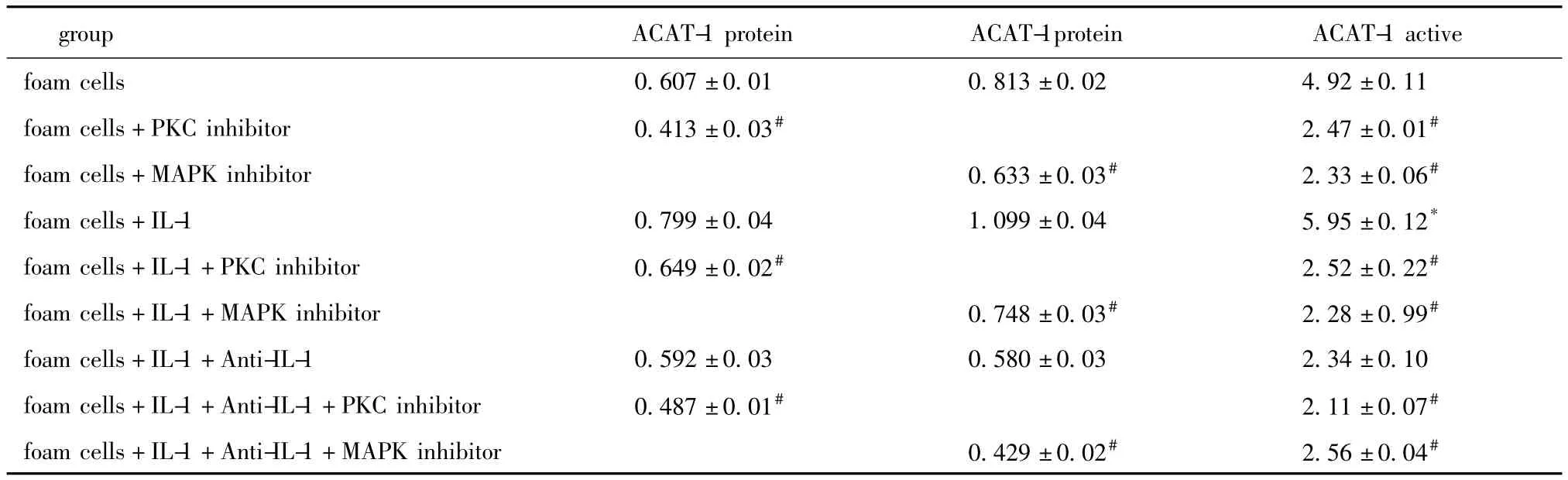
表1 PKC抑制剂和MAPK抑制剂对ACAT-1蛋白表达及酶活性的影响Table 1 Effects of PKC inhibitor and MAPK inhibitor on the expression of ACAT-1 protein and active[±s,nmol/(mg·min),n=6]
*P<0.05 compared with foam cells;#P<0.05 compared with the control group respectively.
group ACAT-1 protein ACAT-1protein ACAT-1 active foam cells 0.607±0.01 0.813±0.02 4.92±0.11 foam cells+PKC inhibitor 0.413±0.03# 2.47±0.01#foam cells+MAPK inhibitor 0.633±0.03# 2.33±0.06#foam cells+IL-1 0.799±0.04 1.099±0.04 5.95±0.12*foam cells+IL-1+PKC inhibitor 0.649±0.02# 2.52±0.22#foam cells+IL-1+MAPK inhibitor 0.748±0.03# 2.28±0.99#foam cells+IL-1+Anti-IL-1 0.592±0.03 0.580±0.03 2.34±0.10 foam cells+IL-1+Anti-IL-1+PKC inhibitor 0.487±0.01# 2.11±0.07#foam cells+IL-1+Anti-IL-1+MAPK inhibitor 0.429±0.02# 2.56±0.04#
IL-1又称淋巴细胞激活因子,主要由单核-巨噬细胞分泌,其主要功能是激活淋巴细胞,参与炎性反应。在AS发生发展过程中,IL-1可促使单核细胞和血管平滑肌细胞向泡沫细胞转化,但作用机制不明确[1]。前期研究发现,在单核细胞向泡沫细胞转化过程中,IL-1可上调 ACAT-1的表达及酶活性[2-3]。有研究证实,IL-1可通过 MAPK 信号通路导致炎性反应,PKC可直接磷酸化MAPK上游的原癌基因产物raf-1,从而激活 ras介导的 MAPK活化[10]。本研究通过体外诱导产生的单核细胞源性泡沫细胞模型,进一步探讨IL-1是否能通过PKC/MAPK信号通路上调泡沫细胞中ACAT-1的表达及活性。结果显示,与泡沫细胞相比,泡沫细胞加IL-1组ACAT-1的表达增加、活性升高,PKC及MAPK活性增加,而泡沫细胞加IL-1/Anti-IL1组中ACAT-1的表达、活性,PKC及MAPK活性均无明显变化。表明IL-1能够增加泡沫细胞中ACAT-1的表达及活性,同时上调泡沫细胞中PKC及MAPK的活性。PKC抑制剂GF109203,MAPK抑制剂Apigenin可分别抑制PKC和MAPK的磷酸化而抑制其活性[11-12]。结果显示,与各自对照组相比,加 PKC 或MAPK抑制剂后,ACAT-1的表达及活性明显下调,从而表明IL-1上调泡沫细胞中ACAT-1的表达及活性的作用可能是通过PKC/MAPK信号通路来实现。但由于细胞内信号传导途径十分复杂,一条通路可同时被多种因子激活,而一种因子亦可同时激活多条信号通路。因此,对IL-1在泡沫细胞中上调ACAT-1表达及活性的信号传导机制尚需进行更为深入的研究。
[1]Barksby HE,lea SR,Preshaw PM,et al.The expanding family of in-terleukin-leytokines and their role in destructive intlarmnatory disorders[J].Clin Exp Inmmnol,2007,149:217-225.
[2]王庸晋,王治平,石变华,等.IL-1对单核细胞向泡沫细胞诱导分化过程中ACAT-1 mRNA表达的影响[J].长治医学院学报,2008,22:401 -404.
[3]王庸晋,王治平,魏武,等.IL-1对单核细胞向泡沫细胞分化过程中酰基辅酶A-胆固醇酰基转移酶蛋白表达和活性的影响[J].中国心血管病研究,2011,9:784 -786.
[4]Friedrich K,Kammer W,Erhardt I.Activation of STAT5 by IL-4 relies on Janus kinase function but not on receptor tyrosine phosphorylation,and can contribute to both cell proliferation and gene regulation[J].Int Immunol,1999,11:1283-1294.
[5]Brown AJ,Mander EL,Gelissen IC,et al.Cholesterol and oxysterol metabolism and subcellular distribution in macrophage foam cells:accumulation of oxidized esters in lysosomes[J].J Lip Res,2000,41:226 - 236.
[6]Chan TY,Li BL,Chang CC,et al.Acyl-coenzymeA:cholesterol acyltransferases[J].Am J Physiol Endocrinol Metab,2009,297:1-9.
[7]高小花,王庸晋.酰基辅酶A胆固醇酰基转移酶-1与动脉粥样硬化[J].心血管病学进展,2011,32:604-606.
[8]Tabas I.The stimulation of the cholesterol esterification pathway by atherogenic lipoproteins in macrophages[J].Curr Opin Lipidol,1995,6:260 -268.
[9]Sakashita N,Chang CC,Lei X,et al.Cholesterol loading in macrophages stimulates formation of ER-derived vesicles with elevated ACAT1 activity[J].J Lipid Res,2010,51:1263-1272.
[10]Maya-Monteiro CM,Almeida PE,D'Avila H,et al.Leptin induces macrophage lipid body formation by a phosphatidylinositol 3-kinase-and mammalian target of rapamycin-dependent mechanism[J].J Biol Chem,2008,283:2203 -2210.
[11]李志伟,张艳桥,范鹰,等.磷酸化PKCδ参与6-OHDA诱导的多巴胺能神经细胞凋亡[J].中国病理生理杂志,2007,23:1145 -1148.
[12]刘世英,蒋宇扬,曹健,等.蛋白激酶C的抑制剂[J].科学通报,2005,50:405 -415.
