P38 MAPK抑制剂对神经病理性疼痛大鼠脊髓TNF-α合成的影响
2012-07-18虞雪融黄宇光
许 力,虞雪融,黄宇光
(中国医学科学院北京协和医学院北京协和医院麻醉科,北京 100730)
痛觉过敏和触诱发痛是神经病理性疼痛的突出特点,现有的治疗方法效果十分有限[1]。大量研究发现,前炎性细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可能在神经病理性疼痛中发挥重要作用。例如,TNF-α作用于坐骨神经后可造成伤害性初级传入纤维自发性兴奋,并呈剂量依赖;外周神经损伤后脊髓背角中 TNF-α表达增加[2]。此外,TNF-α抑制剂可以缓解慢性压迫性损伤(chronic constrictive injury,CCI)引发的痛觉过敏[3]。然而,参与脊髓TNF-α合成过程的信号传导精确细节,尚未明确。体外培养的小胶质细胞在脂多糖诱导下可以产生大量TNF-α,而这一过程是通过脂多糖激活P38 MAPK通路完成的[4]。小胶质细胞是神经系统中的巨噬细胞,能够产生释放多种细胞因子,包括TNF-α。以往通过多种神经病理性疼痛模型证实,外周神经损伤后脊髓小胶质细胞中P38将被激活(激活的 P38形式为磷酸化-P38 MAPK,即 p-P38)[5]。由此可见,TNF-α 与 P38 之间可能存在着重要联系,并且在神经损伤后的神经病理性疼痛形成过程中发挥重要作用。
1 材料与方法
1.1 实验动物和试剂材料
SPF级雄性SD大鼠,体质量160~200 g(北京维通科华实验动物技术有限公司,合格证SCXK京2003220043),12 h亮、暗间隔,适应性喂养1周后,开始进行实验。P38抑制剂:4-(4-氟苯)-2-(4-甲磺酰苯)-5-(4-吡啶基)-1 氢-咪唑(SB203580)、抗β-actin抗体(Sigma公司),蛋白酶和磷酸酶抑制剂的缓冲液、辣根过氧化物酶标记二抗、辣根酶标记链霉卵白素、抗TNF-α抗体和ECL发光试剂盒(Santa Cruz公司),SDS-PAGE凝胶和醋酸纤维素膜(Bio-Rad公司),抗磷酸化-P38抗体和抗总-P38抗体(Cell Signaling公司)生物素-亲和素 SP试剂盒(Zymed公司)。
1.2 CCI模型建立
经中国协和医科大学动物研究管理委员会批准,118只SD大鼠纳入本研究。实验分组包括:1)空白对照组(n=14),2)假手术组(n=14),3)CCI手术后未治疗组(n=42),4)CCI手术0.9%氯化钠注射液治疗组(n=24),5)CCI手术P38抑制剂SB203580治疗组(n=24)。第4和第5组,0.9%氯化钠注射液或SB203580(2 μg,每天两次)分别于手术前1天、手术后第1和第7天,鞘内注射入大鼠体内,持续注射7 d。
大鼠在戊巴比妥钠(40 mg/kg,腹腔注射)麻醉下进行CCI模型制作:在显微解剖镜下(放大倍数×40)暴露左侧坐骨神经主干约7 mm,使用4-0羊肠线将坐骨神经松结扎4道,每个结相隔1 mm。结扎仅使坐骨神经轻度受压[6],然后逐层缝合伤口。没有进行手术的大鼠作为空白对照,而假手术组大鼠仅暴露坐骨神经而并未结扎。
1.3 鞘内置管
鞘内置管于CCI手术前进行。戊巴比妥钠麻醉下切除大鼠L6椎体,切开硬脑膜,将PE-10聚乙烯导管置入大鼠蛛网膜下腔约1.5 cm,使其恰好位于脊髓L3-4节段。小心缝合伤口,固定导管。鞘内置管后大鼠休息24 h再进行CCI手术。
1.4 Western blot
各组大鼠分别在CCI术后不同时点(3、7和14 d)麻醉下断头处死,快速取出其手术侧腰膨大,匀浆后每个电泳道中放入30 μg总蛋白,采用SDSPAGE凝胶分离蛋白,然后转移至醋酸纤维素膜上。滤膜在室温下封阻约1 h后,在抗磷酸化-P38(p-P38)抗体、抗总-P38(total-P38)抗体、抗 TNF-α抗体以及抗β-actin抗体中,4℃孵育一夜。所得的印迹经二抗孵育1 h,在ECL试剂盒中显影1 min,后暴露于 X线片上约1~10 min。磷酸化 P38和TNF-α的数据分别与各自样本的β-actin在同一张滤膜上进行了内对照。
1.5 免疫组织化学
使用4%多聚甲醛灌注,小心完整取出大鼠腰膨大,使用固定液固定标本3~4 h,然后将标本置于25%蔗糖中过夜。冰冻切片机切取脊髓横断漂浮切片(片厚30 μm),与抗磷酸化-P38抗体孵育,然后染色。
1.6 行为学分析
在进行基础阈值测定前,大鼠将适应2周新的实验环境。大鼠均置于架好的金属网格垫上。测定脚掌机械阈值时,使用力度由0.2~26 g的一系列Von Frey细丝刺激大鼠后肢脚掌。将能够引发大鼠缩足反应的最小力度认定为机械阈值(mechanical withdrawal threshold,MWT)[7]。各组大鼠均在手术前3天、手术当天(手术前即刻)、以及术后3、7和14 d测定 MWT。
1.7 统计学分析
2 结果
2.1 CCI术后脊髓P38被激活
CCI术后第3天开始脊髓背角p-P38水平明显增高,并持续大约2周,而总P38(total-P38)水平没有明显变化(图1)。免疫组化结果进一步证实,对照组大鼠脊髓背角p-P38水平明显低于CCI组大鼠,CCI术后3 d脊髓背角p-P38染色强度和阳性细胞数量均明显增加(图2)。
2.2 CCI诱导脊髓TNF-α合成增加
与对照组和假手术组相比,CCI术后3、7和14 d脊髓背角TNF-α水平显著升高(图3)。
2.3 抑制P38活化能够缓解CCI诱导的机械性触诱发痛
与0.9%氯化钠注射液治疗组相比,SB203580预先给药组和疼痛早期给药组,CCI诱导的触诱发痛得到显著缓解,MWT明显升高(P<0.05)。然而,当CCI诱导的机械性触诱发痛持续存在后,即CCI术后7 d时再给予上述SB203580鞘内治疗,则不能有效缓解机械性触诱发痛(图4)。
2.4 P38抑制剂可以抑制CCI术后脊髓TNF-α合成
与0.9%氯化钠注射液治疗组相比,SB203580预先给药组和疼痛早期给药组,CCI诱导的脊髓背角TNF-α合成水平明显下降(P<0.05)。然而,当CCI诱导的机械性触诱发痛持续存在后,即CCI术后7 d时再给予SB203580治疗,则痛阈水平和脊髓TNF-α合成水平均无明显改变(图5)。
3 讨论
本研究结果提示,鞘内注射SB203580并不影响基础痛阈,但是预先或疼痛早期给药则可明显降低CCI诱发的病理性疼痛。然而,当疼痛持续存在后,P38抑制剂则无明显镇痛作用。另一项研究采用SNL模型得到了与本研究相似的结果,他们发现,只有在SNL手术前向大鼠鞘内输注SB203580才能起到镇痛作用,而SNL术后7 d给药则无效果[8]。
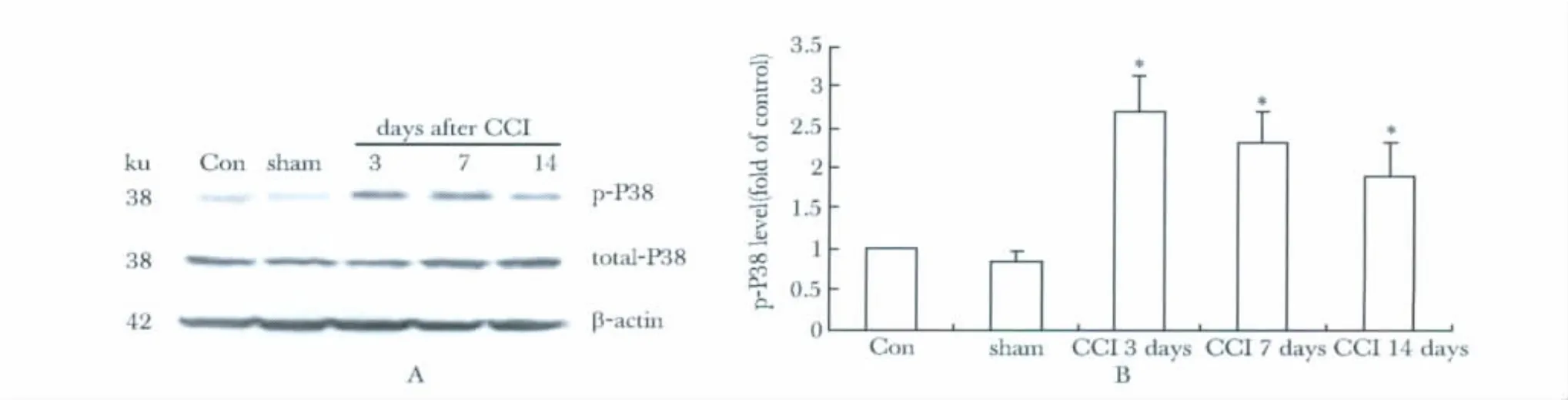
图1 CCI术后脊髓背角磷酸化P38 MAPK的Western blot检测结果Fig 1 Western blot analysis for P38 MAPK in the dorsal horn of the spinal cord after CCI(±s,n=6)

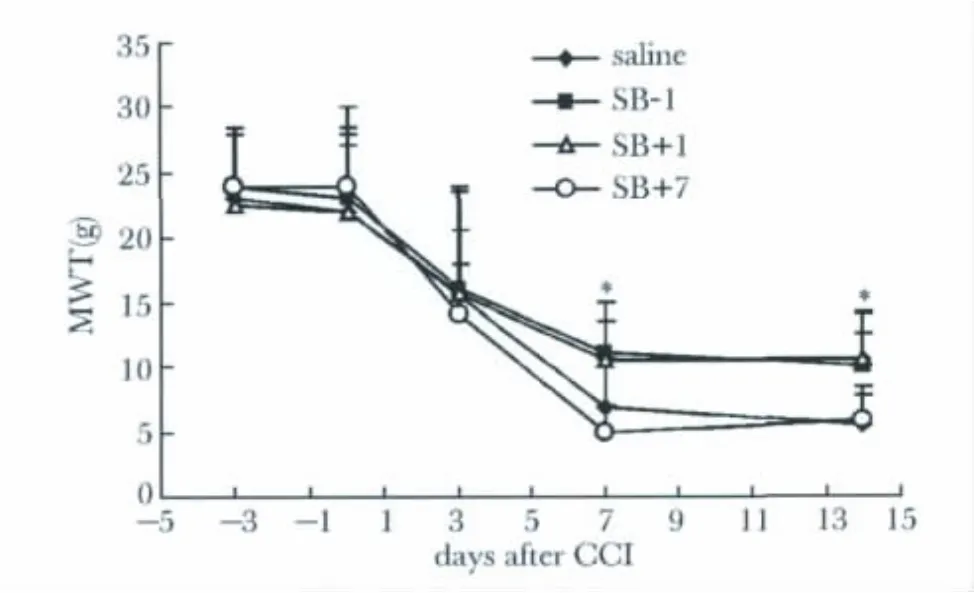
图4 不同时点鞘内注射P38抑制剂对CCI诱导的机械性触诱发痛的影响Fig 4 The analgesia effect of intrathecal inhibition of P38 on CCI induced mechanical allodynia in different time point(±s,n=8)
本研究结果提示,CCI能够诱导脊髓TNF-α合成增加。TNF-α作为一种前炎性因子在病理性疼痛形成过程中发挥着极其重要的作用:TNF-α注入正常背根神经节和大鼠肌肉均可诱导痛觉过敏;外周或中枢神经损伤后,脑和脊髓部位的TNF-α蛋白和mRNA 水平均增加[9-10]。
可见P38和TNF-α在神经病理性疼痛中均发挥着重要作用。本研究通过CCI模型观察了脊髓中P38与TNF-α合成之间的关系。在多种神经病理性疼痛模型中,外周神经损伤后,脊髓小胶质细胞P38将被激活[11]。同时,脊髓中TNF-α水平也增加。小胶质细胞是脊髓中重要的巨噬细胞,可以释放包括IL-1β、IL-6 和 TNF-α 等在内的多种细胞因子[5]。本研究结果提示,P38抑制剂可以抑制CCI诱导的脊髓TNF-α合成。因此,推出下面设想:外周神经损伤后,脊髓小胶质细胞中P38通路被激活,活化后的小胶质细胞可以释放大量细胞因子,包括TNF-α,从而引发疼痛。另一项研究证实了TNF-α与P38关系的另一面:他们向SNL模型大鼠腹腔内注射TNF抑制剂,发现TNF抑制剂可以抑制P38的活化,从而缓解了因SNL导致的触诱发痛[11]。本研究因此得出结论:在脊髓中,P38活化与TNF-α合成互为因果,一方面活化的P38可以诱导TNF-α表达上调,另一方面大量合成的TNF-α也可以促使P38激活。
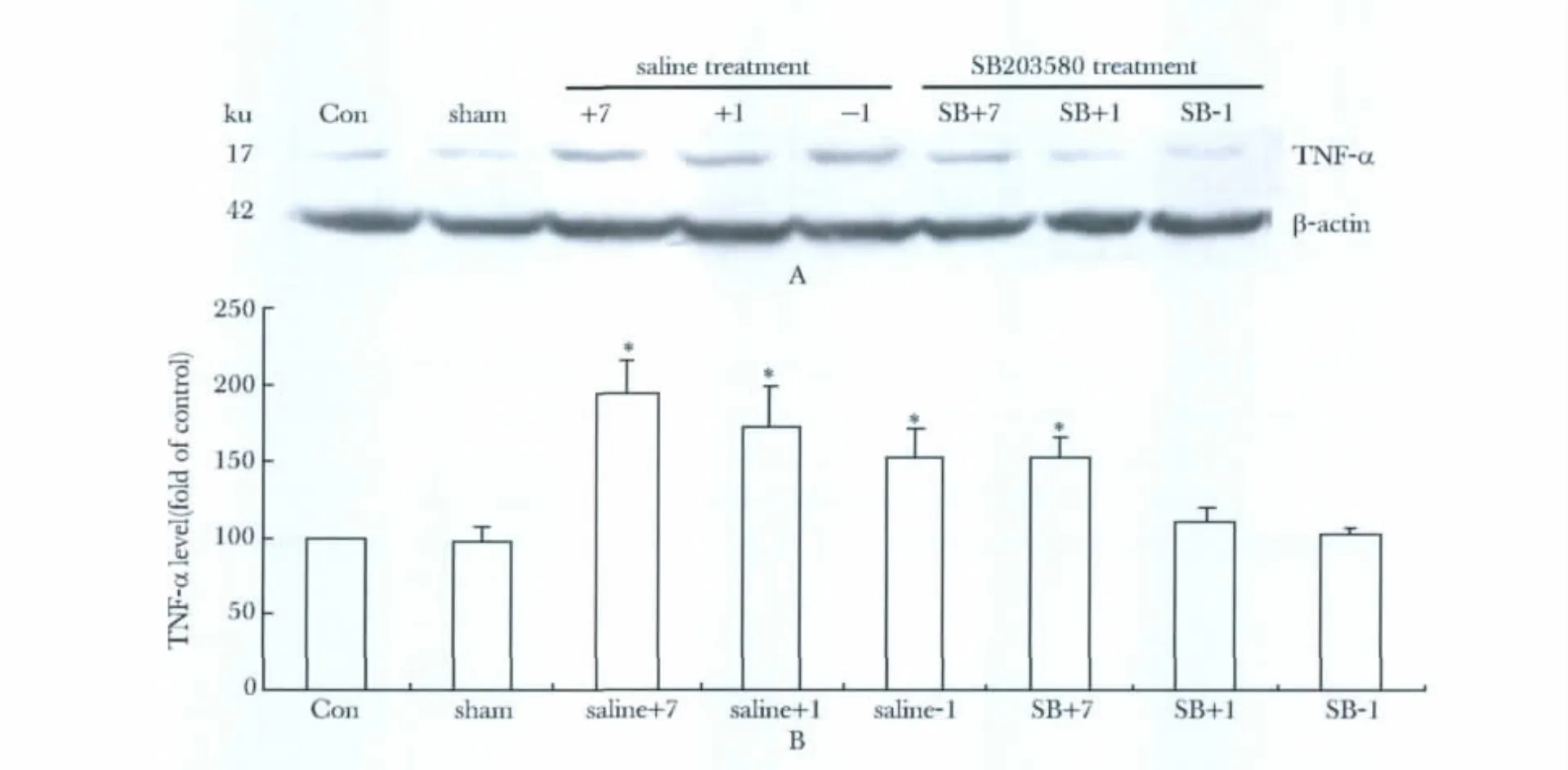
图5 P38 MAPK抑制剂SB203580对CCI大鼠脊髓TNF-α合成的影响Fig 5 The influence of P38 MAPK inhibitor SB203580 on synthesis of TNF-α in spinal cord of rats with CCI(±s,n=8)
通过分析P38抑制剂的治疗窗,本研究考虑P38更多地参与神经病理性疼痛的发生,而不是发展。CCI术后7 d,当神经病理性疼痛已经持续存在,大量细胞因子包括 TNF-α、IL-1、IL-6以及大量疼痛介质在脊髓中合成释放[12]。正如前面所述,如此众多的细胞因子可能激活P38通路,也有可能同时激活其他MAPK通路。因此,作为P38特异性抑制剂,SB203580无法在CCI引发的病理性疼痛持续存在数天后发挥镇痛作用。
综上,本研究证实P38抑制剂可以抑制CCI诱导的脊髓TNF-α合成。在CCI诱导的神经病理性疼痛中,P38 MAPK信号传导通路作为重要因素参与TNF-α合成。
[1]Vorobeychik Y,Gordin V,Mao J,et al.Combination therapy for neuropathic pain:a review of current evidence[J].CNS Drugs,2011,25:1023 -1034.
[2]Zhang L,Berta T,Xu ZZ,et al.TNF-alpha contributes to spinal cord synaptic plasticity and inflammatory pain:distinct role of TNF receptor subtypes 1 and 2 [J].Pain,2011,152:419-427.
[3]Sommer C,Marziniak M,Toyka KV.Etanercept reduces hyperalgesia in experimental painful neuropathy[J].J Peripher Nerv Syst,2001,6:67 -72.
[4]Nakajima K,Tohyama Y,Kohsaka S,et al.Protein kinase C requirement in the activation of P38 mitogen-activated protein kinase,which is linked to the induction of tumor necrosis factor in lipopolysaccharide-stimulated microglia[J].Neurochem Int,2004,44:205 -214.
[5]Wen YR,Tan PH,Cheng JK,et al.Microglia:a promising target for treating neuropathic and postoperative pain,and morphine tolerance[J].J Formos Med Assoc,2011,110:487-494.
[6]Bennett GJ,Xie YK.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33:87-107.
[7]Ji RR,Befort K,Brenner GJ,et al.ERK MAP kinase activation in superficial spinal cord neurons induces prodynorphin and NK-1 upregulation and contributes to persistent inflammatory pain hypersensitivity [J].J Neruosci,2002,22:478-485.
[8]Schafers M,Svensson CI,Sommer C,et al.Tumor necrosis factor-alpha induces mechanical allodynia after spinal nerve ligation by activation of P38 MAPK in primary sensory neurons[J].J Neurosci,2003,23:2517 -2521.
[9]He XH,Zang Y,Chen X,et al.TNF-α contributes to upregulation of Nav1.3 and Nav1.8 in DRG neurons following motor fiber injury[J].Pain,2010,151:266-279.
[10]Covey WC,Ignatowski TA,Renauld AE,et al.Expression of neuron-associated tumor necrosis factor alpha in the brain is increased during persistent pain[J].Reg Anesth Pain Med,2002,27:357 -366.
[11]Ji RR,Gereau RWt,Malcangio M,et al.MAP kinase and pain[J].Brain Res Rev,2009,60:135-148.
[12]Orhan CE,Onal A,Ulker S.Neurosci Lett.Antihyperalgesic and antiallodynic effect of sirolimus in neuropathic pain and the role of cytokines in this effect[J].2010,481:17-20.
