多层螺旋CT血管成像对主动脉壁内血肿的诊断价值
2012-07-11郭钧忠郭丹丹李春平陈天武
郭钧忠,郭丹丹,李春平△,李 睿,陈天武
(1.厦门市中医院放射科,福建 厦门 361000;2.医学影像四川省重点实验室,川北医学院附属医院放射科,四川 南充 637000)
主动脉壁内血肿(aortic intramural hematoma,IMH)是包含于急性主动脉综合征(acute aortic syndrome,AAS)中的一种潜在的致命性疾病,指主动脉壁中层血管滋养血管破裂出血而不伴内膜撕裂,血肿位于血管中膜与外膜之间,且血肿与主动脉管腔之间不存在交通[1-2],又称非交通性夹层或主动脉不典型夹层[3]。约13% ~29%的IMH进一步发展成为典型的急性主动脉夹层[2],IMH还可不经手术或内科治疗而吸收好转。其临床表现可表现为急性主动脉综合征,但其病理基础和影像表现独特,与主动脉夹层(aortic dissection,AD)、穿透性粥样硬化性主动脉溃疡(penetrating atherosclerotic ulcer,PAU)有本质上的区别。本研究探讨21例IMH的多层螺旋CT血管成像(multi-slice spiral computer tomography angiography,MSCTA)表现,旨在提高对本病的认识及诊断能力。
1 资料与方法
1.1 临床资料
收集2009年1月至2011年2月,经MSCTA诊断的连续性IMH 21例。其中男14例,女7例;年龄64~83岁,平均74岁。主要临床症状为突发胸背撕裂痛,同时向腹部放射,并伴有胸闷、气促等,其中有高血压病史16例。所有患者均于发病后12 h内行CT平扫及MSCTA检查。
1.2 CT 检查技术
所有患者均采用TOSHIBA Aquilion l6层螺旋CT行平扫和增强扫描,采用胸腹联合扫描,扫描范围自胸廓入口至盆腔。技术参数:电压120 kV,电流300 mA,FOV 400 mm,准直16×1 mm,扫描层厚7 mm,层间距7 mm,矩阵512×512,增强扫描时使用非离子型低渗透压高浓度含碘对比剂75~100 mL(碘海醇,通用电气药业生产),高压注射器经肘前静脉注入,注射速率3.8~4.0 mL/s。扫描后所有数据采用标准算法行薄层重建,重建层厚1 mm,层间距1 mm,并将重建数据传送到工作站(Vitrea 2.0),进行主动脉及其主要分支的多平面重建(multiplanar reconstruction,MPR)、最大密度投影(maximum intensity projection,MIP)及曲面重建(curved planar reconstruction,CPR)进行综合分析。
1.3 CT观察指标及CT诊断标准
所有影像学资料由2名经验丰富的放射科医师结合冠状位、矢状位进行分析,着重分析IMH受累解剖部位及其分型、IMH影像学特征(对钙化的统计只局限于病变区域,病变区域以外的主动脉壁钙化不纳入统计)、IMH厚度对受累主动脉管径的影响、并发主动脉溃疡情况、继发改变。如有意见分歧,则通过协商取得一致意见。
主动脉管壁呈环形或新月形增厚大于5 mm[1],增厚的主动脉管壁平扫表现为高密度影,增强扫描病灶无明显强化,无片状内膜瓣影像及主动脉真、假双腔影像形成[4]。
1.4 统计学分析
所有的数据采用统计软件包SPSS 13.0进行分析,IMH发病的部位、分型、与主动脉管壁钙化的关系及血肿厚度与受累主动脉管径比例行χ2检验。
2 结果
2.1 IMH受累部位
IMH受累部位包括主动脉弓、升主动脉、胸段降主动脉及腹主动脉,分别占2例、4例、12例及16例(患者总数21例,受累主动脉总数32例),受累部位之间差异有统计学意义(P=0.000),以降主动脉常见,占17/21(80.95%),胸段降主动脉与腹主动脉之间的差异无统计学意义(P=0.154),无腹腔干、肠系膜上动脉、双肾动脉及肠系膜下动脉受累。按照Stanford分类法将IMH分为A、B两型,累及升主动脉为Stanford A型,局限于降主动脉或腹主动脉为Stanford B型。本组IMH患者中,Stanford A型4例,Stanford B型17例。
2.2 IMH影像学特征
横断位及MPR、MIP及CPR均可显示病变特征。平扫呈环形或新月形的稍高密度影(图1),环形和新月形稍高密度影分别占2例、19例,CT值平均为(52.83 ±14.61)Hu,增强扫描无强化(图 2);血肿主要是沿着主动脉长轴剥离(图3);IMH壁内钙化内移(图1)占15/21(71.43%),与无壁内钙化内移(图4)之间的差异有统计学意义(P=0.013)。IMH的MSCT表现见表1。
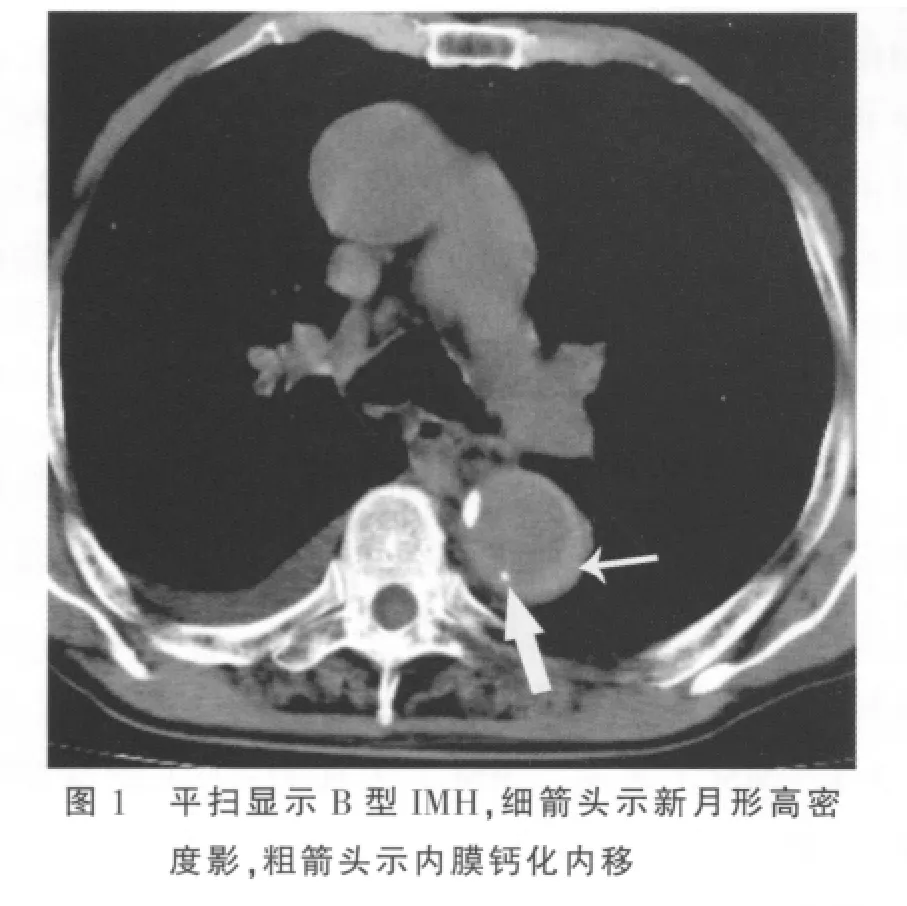
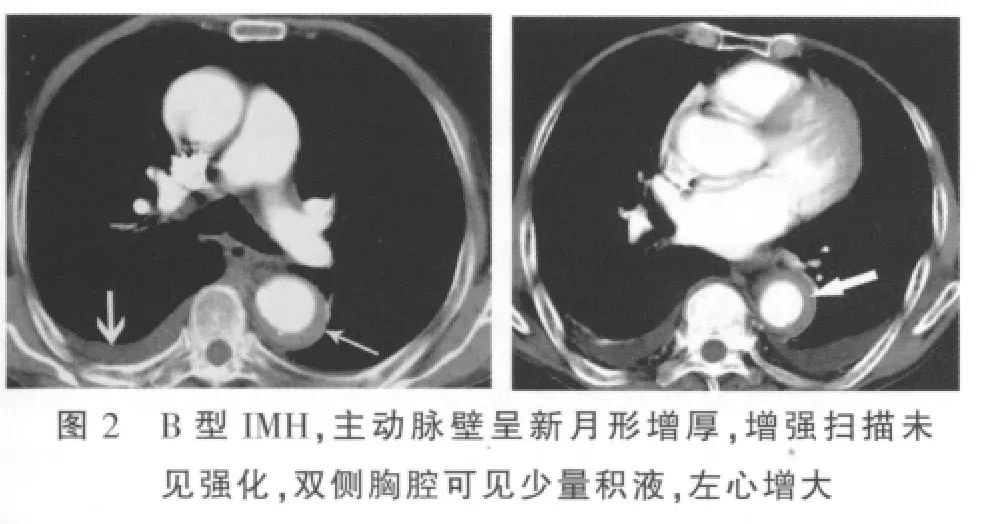
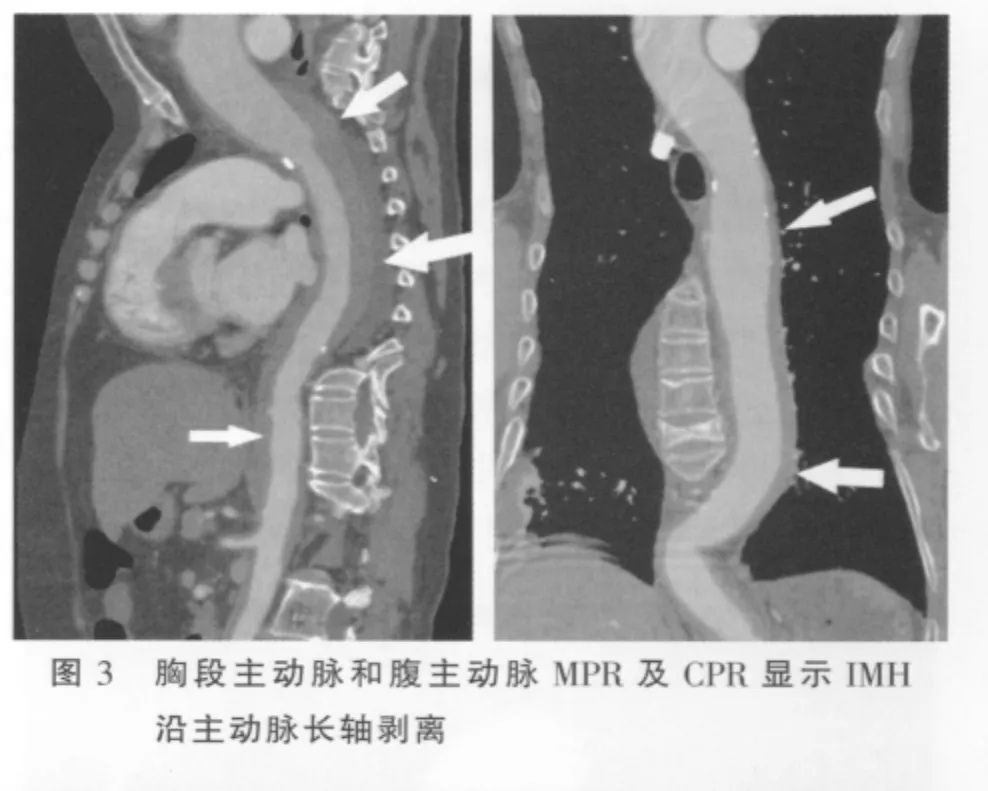
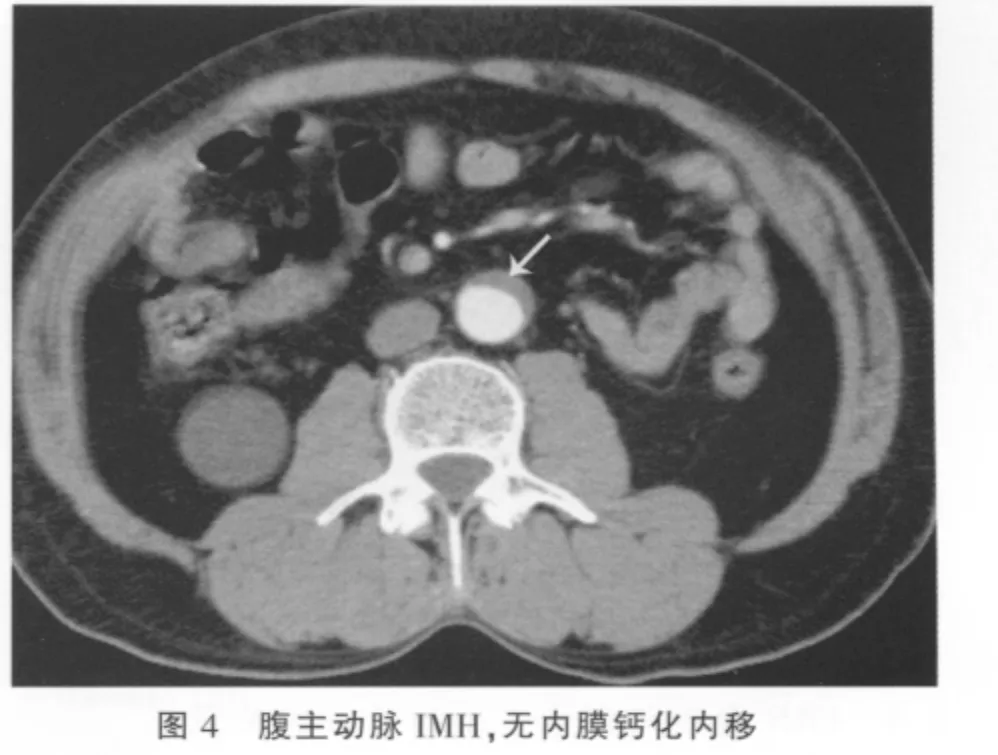
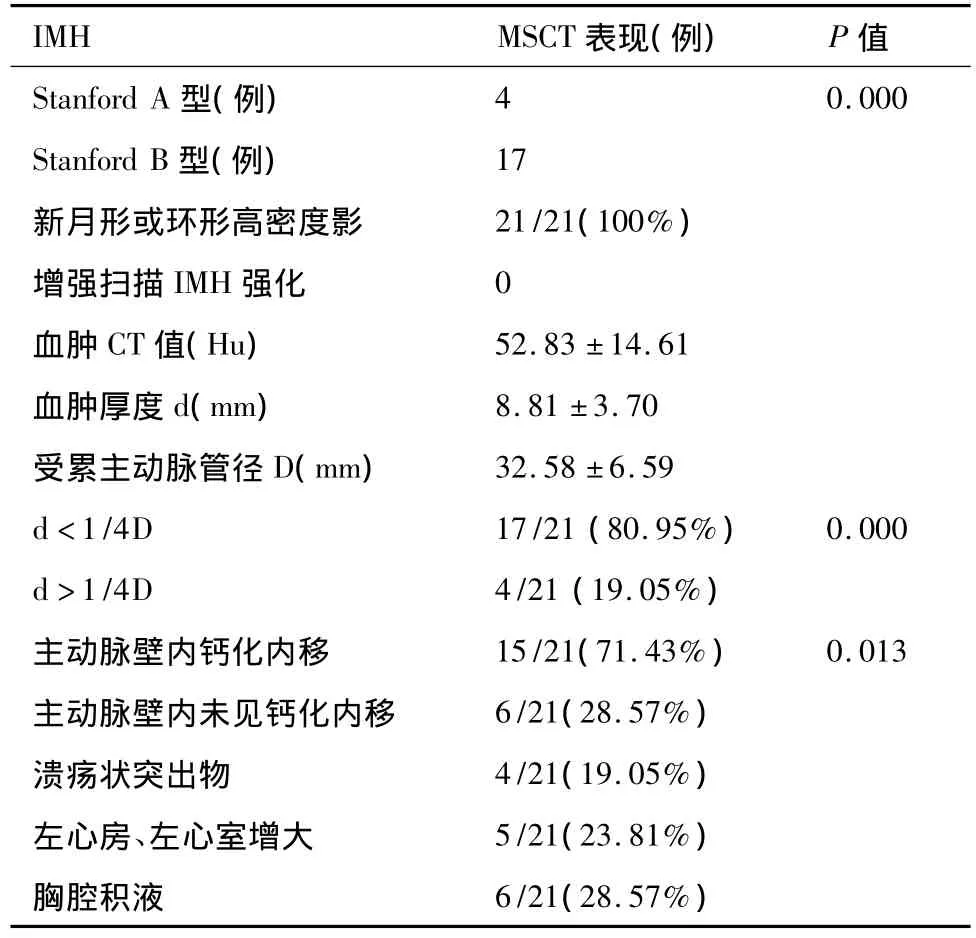
表1 IMH的MSCT表现
2.3 IMH的并发症及继发改变情况
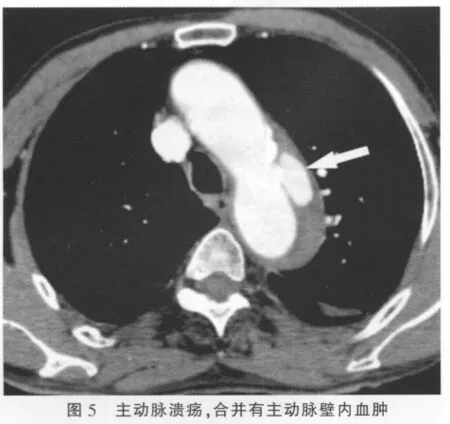
IMH的并发症主要有合并主动脉溃疡和主动脉夹层,本组所有患者中合并主动脉溃疡4例,表现为主动脉管壁不光滑,并可见局限性龛影形成(图5);未见有合并主动脉夹层患者。继发改变包括有左心室增大、左心房和左心室均增大、胸腔积液(图2)。本组病例中,合并有左心室增大2例、左心房和左心室均增大例4例,胸腔积液6例。
2.4 IMH厚度与受累主动脉管径的关系
受累主动脉血肿厚度平均值为(8.81±3.70)mm,血管管径平均值为(32.58±6.59)mm,两者之间比值以小于1/4者为主,占17/21(80.95%),大于1/4者占4/21(19.05%),两者之间的差异有统计学意义(P=0.000)。
3 讨论
3.1 病理学特点及临床表现
Krukenberg等[5]于1920年将 IMH描述为“主动脉壁内滋养血管破裂出血导致血肿形成,不伴内膜撕裂或穿透性溃疡”,不伴有内膜撕裂。主动脉壁内血肿的患者年龄一般较大,并且高血压为其主要易感因素,该病多数患者(约80%)有明确高血压病史[6-7]。本组21例病例中16例有明确的高血压病史,与文献报相近。IMH位于中膜与外膜之间,无内膜破裂,内膜可有或无动脉粥样硬化改变。血肿的存在将使主动脉管壁更加脆弱而易破裂,当其向内破裂时将形成典型的AD,向外扩张形成动脉瘤,严重者可向外破裂穿通主动脉壁[2]。IMH临床表现和AD一样,几乎所有患者都表现为突发的急性胸痛或背痛,部分患者表现为腹痛,其疼痛可以表现为锐性的切割样痛、撕裂样痛或钝痛[1],个别患者无明显临床症状。
IMH在临床上较少见,为较严重的心血管疾病,其危险性及病死率均较高。因此,及时准确的诊断为治疗IMH的关键。临床中常用的诊断方法包括MSCT、磁共振成像(magnetic resonance imaging,MRI)、数字减影血管造影术(digital subtract agiography,DSA)。其中,MSCT为最常用的检查方法,在诊断IMH上有其独特优势,其成像速度快,时间分辨率和密度分辨率均较高,横断位成像结合图像后处理技术如MPR、CPR等,可以直观的显示病变的纵向范围,并可准确的定位病变位置,清晰的展示病变的并发症等;能较好的与其他主动脉疾病如主动脉炎、血栓、动脉粥样硬化斑块相鉴别;在临床上为IMH患者制定合理的治疗决策有重要意义。其诊断IMH的敏感性和特异性均为100%[8]。与MSCT相比,MRI检查对内膜钙化的移位显示敏感性不高,检查时间相对较长,空间分辨率较低,且不能准确的判断血肿厚度。
3.2 IMH受累部位
IMH受累部位包括主动脉弓、升主动脉、胸段降主动脉及腹主动脉,以降主动脉常见。本研究结果中,IMH以Stanford B型常见。
3.3 MSCT表现及鉴别诊断
3.3.1 MSCT表现 MSCT表现为:①主动脉壁增厚,呈新月形或环形高、低密度影或高低混杂密度影,本组病例增厚的主动脉壁CT值平均(52.83±14.61)Hu,与文献报道的平均值 60~70 Hu相近[1]。病变轮廓清楚,范围可局限或广泛,病变较轻时局限于主动脉管壁局部,严重者可累及主动脉管壁全程。增强扫描示新月形或环形的壁内血肿未见有强化征象。②内膜可见高密度钙化影,其钙化的特点表现为点状钙化而非直线形钙化,当主动脉钙化向腔内移位大于5 mm时,提示IMH或主动脉夹层可能,且能够排除附壁血栓[1]。本组病例中壁内钙化内移占71.43%,这可能与主动脉壁内膜钙化与动脉粥样硬化变化及病理上位于主动脉内膜层有关,这对于解释老年人壁内膜有较高钙化率也有一定的意义[1]。本组病例中未见有增厚的主动脉壁呈离心性钙化,因此,对于主动脉壁呈离心性钙化者可以帮助我们排除IMH。测量主动脉最大内径、血肿的最大厚度及在血肿的最大厚度层面上测量主动脉壁的最小及最大横径是非常重要的,有助于壁内血肿的诊断。本组病例中所测量的血肿厚度及主动脉直径平均值与Thanongchai等[4]报道相一致,两者比值小于1/4,预示发生IMH的可能。③合并有主动脉穿透溃疡时,病变区血管局部可见向腔外突出呈龛影样改变,周围局部伴壁内血肿形成。继发改变如胸腔积液、左心房和左心室体积增大也有一定的辅助诊断意义。
3.3.2 鉴别诊断 IMH因其独特的病理生理过程,在临床治疗方案的选择上显得尤为重要。典型的 AD、IMH、PAU 同属于 AAS[9]。准确的鉴别上述疾病,才能制定正确的治疗方案,改善IMH的预后。
IMH与AD的鉴别尤为重要。AD多沿主动脉长轴螺旋剥离,并可见内膜片,而IMH为环绕主动脉的新月形或环形,无主要分支血管受累[8]。此征象可与AD相鉴别。IMH与PAU的主动脉壁增厚鉴别有一定难度,PAU的主动脉壁多不规则,而IMH的管壁规整;IMH常可合并有PAU。IMH还应与附壁血栓鉴别,前者沿主动脉长轴走形且病变较广泛,管腔可表现为扩张或不扩张,并可见内膜的钙化移位,而血栓则相对局限,且形态较不规则,常伴有管腔的扩张。从发病机制来看,只要IMH妥善控制,不穿透内膜,则随着时间的推移将演变成附壁血栓[10]。
IMH属于心血管急症,及时的诊断和治疗是关键。由于IMH临床表现缺乏特异性,其诊断主要依靠影像学手段。MSCTA有成像时间短、空间分辨率高、可以直观显示主动脉及其分支血管情况等诸多优势,可明确诊断IMH及其并发症,为IMH影像学诊断的重要检查方法。
[1]Chao CP,Walker TG,Kalva SP,et al.Natural history and CT appearances of aortic intramural hematoma [J].Radiographics,2009,29(3):791 -804
[2]Buckley O,Rybicki FJ,Gerson DS,et al.Imaging features of intramural hematoma of the aorta[J].Int J Cardiovasc Imaging,2010,26(1):65-76
[3]支爱华,戴汝平,蒋世良,等.主动脉不典型夹层转归的电子束CT 研究[J].中华放射学杂志,2006,40(5):507-510
[4]Siriapisith T,Wasinrat J,Slisatkorn W.Computed Tomography of Aortic Intramural Hematoma and Thrombosed Dissection[J].Asian Cardiovasc Thorac Ann,2010,18(5):456 -463
[5]Krukenberg E.Beitrage zur frage des aneurysma dissecans[J].Beitr Pathol Anat Allg Pathol,1920,67:329 – 351
[6]Song JK,Yim JH,Ahn JM,et al.Outcomes of Patients With Acute Type A Aortic Intramural Hematoma[J].Circulation,2009,120(1):2046-2052
[7]Sueyoshi E,Sakamoto I,Uetani M,et al.CT Analysis of the Growth Rate of Aortic Diameter Affected by Acute Type B Intramural Hematoma[J].AJR,2006,186(Suppl.2):S414 - S420
[8]Diana Litmanovich,Alexander AB,Luce C,et al.CT and MRI in Diseases of the Aorta[J].AJR,2009,193(4):928-940
[9]杜渭清,张雪林,郑敏文,等.急性主动脉综合征的多层螺旋CT 诊断[J].实用放射学杂志,2008,24(5):628 -630
[10]邹建华,郑 巧,付传明,等.不典型夹层动脉瘤的VCT血管造影及临床应用[J].放射学实践,2010,25(1):47 -50
