siRNA靶向沉默B7-H4基因对人前列腺癌DU145细胞增值和凋亡的影响
2012-07-04朱森良孙晓青
朱森良 孙晓青
1)徐州医学院肿瘤实验室 徐州 221002 2)徐州医学院附属医院泌尿外科 徐州 221002
前列腺癌是老年男性生殖系统常见的恶性肿瘤之一,以手术和内分泌治疗为主。对于晚期、复发性或激素非依赖性的患者尚无有效治疗方案。国内外许多学者都在探求基因水平的调控方法和寻找治疗新靶点,以期在前列腺癌的治疗上取得突破。B7-H4(也称为B7x,B7S1)是最近发现的B7家族负性协同刺激分子[1-3]。近年来的研究发现B7-H4在多种肿瘤细胞中异常表达,可溶性B7-H4还见于肿瘤病人的血液样本中,且与肿瘤发生、发展及预后状况存在密切关系[4-5],因此,认为B7-H4可能是肿瘤基因治疗的分子靶点之一。RNA干扰(RNA interference,RNAi)是一种双链RNA分子在mRNA水平上诱发的转录后基因沉默机制(PTGS)[6]。由于RNAi对基因表达的阻断具有高效、特异性,已迅速发展成为代替基因敲除的遗传工具。目前已广泛应用于泌尿系肿瘤生物治疗的研究[7-9]。本研究应用siRNA沉默人前列腺癌DU145细胞的B7-H4基因,观察其对DU145细胞增殖凋亡的影响,为前列腺癌的基因治疗提供理论依据。
1 材料与方法
1.1 材料 (1)细胞株(人前列腺癌DU145细胞株购自中科院上海细胞研究所)。(2)主要试剂:3条B7-H4 siRNA及阴性对照siRNA由上海吉玛制药技术有限公司合成;Ham’sF12培养基购自Hyclone公司;胎牛血清(FBS)购自美国Gibco公司;LipofectamineTM2000购自Invitrogen公司;(3)反转录试剂盒(Prime-Script RT reagent Kit)购自宝生物工程(大连)有限公司;(4)PCR试剂盒(Taq® Version 2.0)购自日本TaKaRa公司;(5)B7-H4和内参照β-actin引物由上海生物工程技术服务有限公司合成;(6)兔抗人B7-H4多克隆抗体购自Santa Cruz公司;(7)山羊抗兔IgG购自北京中山金桥有限公司;(8)CCK-8购自日本株式会社同仁化学研究所;(9)TRNzol总RNA提取试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒(增强型)和AnnexinV/PI染色试剂盒均购自北京TIANGEN公司。
1.2 方法 细胞培养:DU145细胞用含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素的Ham’sF12培养,置于37℃、5%CO2培养箱中培养,待细胞达到90%汇聚时用0.25%胰蛋白酶消化传代。在6孔细胞培养板中按细胞数3×105/孔接种细胞,每孔加入含10%FBS的Ham’sF12培养基在37℃、5%CO2培养箱中培养24 h,转染时细胞融合度达30% ~50%,弃去原培养液,用新无血清培养液轻洗2次,参照LipofectamineTM2000说明书进行细胞转染。
1.2.1 siRNA 转染:三条 B7-H4 siRNA:siRNA -1(897):Sense 5’-GCCCUUACCUGAUGCUAAATT-3’,Anti-sense 5’-UUUAGCAUCAGGUAAGGGCTT-3’;siRNA -2(446):sense 5’-GGCACCUACAAAUGUUAUATT-3’,Anti-sense 5’-UAUAACAUUUGUAGGUGCCTT-3’;siRNA -3(99):sense 5’-GGAGCAUAAUUAGCAUCAUTT-3’,Anti-sense 5’ -AUGAUGCUAAUUAUGCUCCTT- 3’;negative control:Sense 5’-UUCUCCGAACGUGUCACGUTT- 3’,Anti-sense 5’-ACGUGACACGUUCGGAGAATT-3’。实验分5组:siRNA-1组,siRNA-2组,siRNA-3组,negative control(NC)组和空白对照组。将100 pmol siRNA用250 μL无抗生素、无血清的Ham’sF12培养液稀释,轻混,室温静置5 min,在250 μL无抗生素、无血清Ham’sF12培养液中稀释5 μL LipofectamineTM2 000转染试剂,轻混,室温静置5 min,混合稀释的siRNA和转染试剂,室温静置20 min,将500 μL转染复合物加入到6孔细胞培养板中,混匀,在37℃、5%CO2培养箱中培养,转染6 h后更换含10%胎牛血清的Ham’s F 12培养液继续培养,按照实验的孵育时间分别收集细胞,进行后续试验。
1.2.2 RT-PCR检测B7-H4表达:由GenBank检索目的基因序列,利用Primer-BLAST在线设计引物,序列如下:B7-H4上游引物5’-CACCAGGATAACATCTCTCAGTGAA -3’,下游引物5’-TGGCTTGCAGGGTAGAATGA -3’,产物长度 120bp。同时以β-actin作为内参照,上游引物5’-ACTCGTCATACTCCTGCT-3’,下游引物5’-GAAACTACCTTCAACTCC -3’,产物长度255bp。参照Trizol试剂说明书提取各组细胞总RNA,紫外分光光度计测定A280和A260值,计算其浓度和纯度,每一样品重复3次。利用oligo(dT)20引物和宝生物PrimeScript RT reagent Kit试剂盒逆转录成cDNA,在50 μL反应体系中按照PCR试剂盒(Taq® Version 2.0)说明书进行扩增,反应条件为94℃ 2min,98℃ 10 s,55℃ 30 s,72℃ 15 s,35 个循环,72℃ 5min。PCR 产物经2%琼脂糖电泳检测,电泳摄像仪扫描记录摄影。结果用图象处理仪(Gene Company)分析处理。测定各个条带的灰度值,B7-H4条带灰度值与其相应的β-actin条带灰度值的比值作为各组间相互比较的参数。
1.2.3 Western blotting检测B7-H4蛋白表达:收集转染后的5组细胞,冷PBS冲洗2次后,RIPA裂解液提取细胞总蛋白,冰浴30 min裂解混匀、4℃ 12 000 r/min离心5 min后,BCA法行总蛋白测定,SDS-PAGE凝胶电泳后,半干转印到硝酸纤维素膜,5%脱脂奶粉封闭2 h后,加入一抗(1∶500),4℃孵育过夜,Washing buffer洗膜后,加入二抗(1∶1 000)室温孵育2 h,Washing buffer洗膜后,NBT/BCIP显色。内参照选用β-actin,电泳及转膜条件同上,其他步骤相同,待NC膜晾干后扫描仪输出结果,结果用图象处理仪(Gene Company)分析处理。测定各个条带的灰度值,B7-H4条带灰度值与其相应的β-actin条带灰度值的比值作为各组间相互比较的参数。
1.2.4 CCK-8检测细胞增殖:转染后将各组细胞胰酶消化离心,加入适量含10%FBS的Ham’sF12培养基后,调整其浓度为1×104/mL的单个细胞悬液,100 μL/孔的细胞悬液接种于3个96孔板,分3组:空白组、NC组和B7-H4-siRNA-3组,每组设3个时间点(24 h、48 h、72 h),每个时间点设5个复孔,每孔100 mL。将各组细胞放入37℃、5%CO2恒温培养箱中培养。每个时间点取出一块相应的96孔板,向每孔加入10 μL CCK-8溶液。放入培养箱中继续培养2 h后取出培养板,用酶标仪测定在450 nm处的吸光度(OD值)。取各孔平均值,绘制生长曲线。并计算细胞生长抑制率表示,细胞生长抑制率(IR)=(1-实验组平均OD值/空白对照组平均OD值)×100%。
1.2.5 AnnexinV-FITC检测细胞凋亡:转染后细胞用冷的PBS洗涤2次,以1×107/mL的密度重悬细胞于1×binding buffer(含Ca2+)中,取100 μL细胞于1.5 mL塑料离心管中,加入5 μL Annexin V 和10 μL 碘化丙啶(propidium iodide,PI),轻轻混匀,避光室温孵育15 min,每个样品再加入400 μL 1×binding buffer,1 h内流式细胞仪检测,AnnexinV-FITC为绿色荧光,PI为红色荧光。获取的数据用AnnexinV-FITC荧光强度为X轴,PI荧光强度为Y轴的散点图分析。
1.3 统计学处理 用SPSS 13.0统计软件处理,数据以均数±标准差(±s)表示,分析方法采用单因素方差分析(One-Way ANOVA)。假设检验水准按α=0.05判定,P<0.05差异有统计学意义,所有实验均至少重复3次。
2 结果
2.1 RT-PCR法半定量检测DU145细胞B7-H4 mRNA的表达相对量(相对于β-actin mRNA) 结果显示扩增片段大小与所设计的大小完全一致,分别为120bp和255bp。电泳结果可见siRNA-2和siRNA-3转染组B7-H4 mRNA的表达水平有不同程度的下调,其相对量与空白对照组,NC组比较,差别有统计学意义(P<0.05),其中以siRNA-3转染组下调最明显(与siRNA -2组比,P<0.05),表达相对量约为 0.328 ±0.057。siRNA-1及NC组与空白对照组比较,差别无统计学意义(P>0.05,见表1,图1)
表1 RT-PCR检测各组细胞B7-H4 mRNA的表达(± s,n=5)

表1 RT-PCR检测各组细胞B7-H4 mRNA的表达(± s,n=5)
注:*P <0.05 vs空白组、NC 组;△P <0.05 vs siRNA-2
组别B7-H4 mRNA空白组0.778 ±0.091 NC 组 0.735 ±0.066 siRNA -1组 0.714±0.087 siRNA -2组 0.592±0.083*siRNA -3组 0.328±0.057*△

图2-1 RT-PCR检测DU145细胞转染各siRNA后B7-H4 mRNA表达Lane1:空白组;Lane 2:NC;Lane 3:siRNA-1;Lane 4:siRNA-2;Lane 5:siRNA-3
2.2 Western-blot检测B7-H4蛋白表达水平 各组细胞Western-blot检测分析表明,内参照β-actin为均一显影条带,siRNA-2和siRNA-3转染组B7-H4蛋白的表达水平有不同程度的下调,其相对量与空白对照组及NC组比较,差别有统计学意义(P<0.05),其中以siRNA-3转染组下调最明显(与siRNA -2 组比,P <0.05),表达相对量约为0.153±0.023,这与 RT-PCR结果相符合,因此确定siRNA-3为最佳干扰序列,进行后续实验。siRNA-1及NC组与空白对照组比较,差别无统计学意义(P <0.05,见表2、图2)。
表2 Western-blot检测各组细胞B7-H4蛋白的表达 (±s)
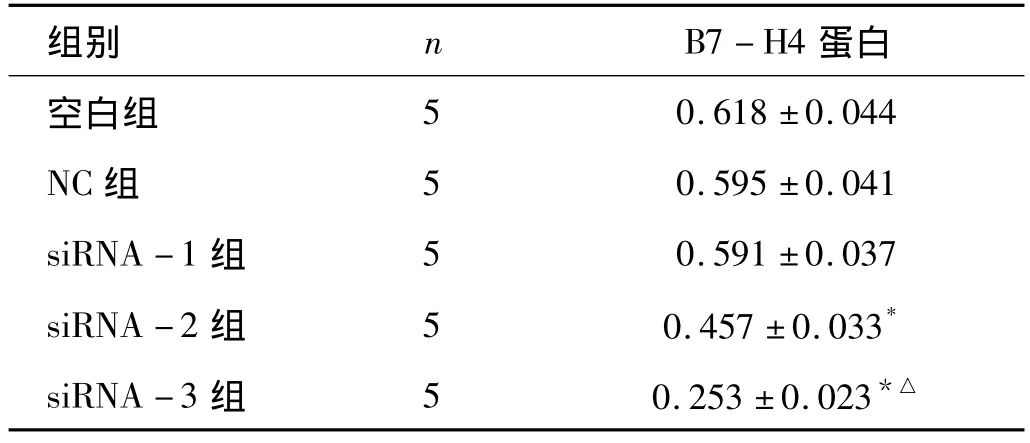
表2 Western-blot检测各组细胞B7-H4蛋白的表达 (±s)
注:*P <0.05 vs空白组、NC 组;△P <0.05 vs siRNA -2组
组别 n B7-H4蛋白空白组0.618 ±0.044 NC 组 5 0.595 ±0.041 siRNA -1 组 5 0.591 ±0.037 siRNA -2 组 5 0.457 ±0.033*siRNA -3 组 5 0.253 ±0.023 5*△

图3-1 Western-blot检测转染siRNA-1细胞B7-H4蛋白的表达Lane1:空白组;Lane 2:NC;Lane 3:siRNA-1;Lane 4:siRNA-2;Lane 5:siRNA-3
2.3 B7-H4基因沉默对DU145细胞增殖的影响 通过CCK-8法检测细胞吸光度,根据吸光度来评估DU145细胞的增殖情况实验结果显示,siRNA-3组对DU145细胞增殖生长有明显的抑制作用,在三个时间点,24 h、48 h和72 h的吸光度与空白组、NC组相比较,差别有统计学意义(P<0.05),而空白组与NC组相比,差别无统计学意义(P>0.05,见表3、图3)。转染siRNA-3组DU145细胞生长抑制率24 h、48 h、72 h依次为(25.3±1.9)%、(30.6 ±2.1)%和(34.1 ±2.2)%,提示随着时间的延长,DU145细胞增殖受到抑制效果增加。
表3 各组DU145细胞不同时间的OD值 (±s,n=5)

表3 各组DU145细胞不同时间的OD值 (±s,n=5)
注:*P <0.05 vs空白组、NC 组
时间 空白组 NC组 siRNA-3组24 h 0.419 ±0.031 0.403 ±0.026 0.313 ±0.020*48 h 0.493 ±0.024 0.482 ±0.023 0.342 ±0.022*72 h 0.651 ±0.029 0.668 ±0.022 0.429 ±0.019*
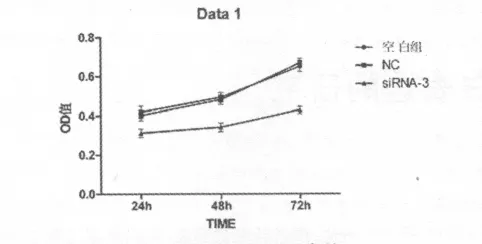
图3 各组DU145细胞不同时间点的OD值(±s)
2.4 干扰B7-H4对人前列腺癌DU145细胞凋亡的影响 流式细胞仪双参数图上,Annexin V和PI均阴性为正常,Annexin V阳性、PI阴性为早期凋亡细胞,Annexin V和PI均阳性为凋亡后坏死细胞及部分坏死细胞,Annexin V阴性而PI阳性则为坏死细胞,实验结果显示,各组细胞继续培养48h,siRNA-3组凋亡率为(28.43±1.29)%,与空白组和NC组相比凋亡率明显增高(P<0.05,见表4、图4-1~图4-3),表明沉默 B7-H4基因的表达能促进DU145细胞的凋亡
表4 各组DU145细胞的AnnexinV-FITC染色流式细胞仪分析结果 (±s)
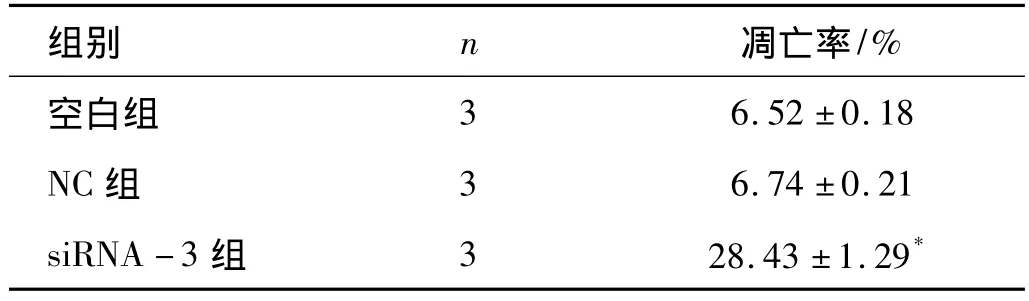
表4 各组DU145细胞的AnnexinV-FITC染色流式细胞仪分析结果 (±s)
注:*P <0.05 vs空白组、NC 组
组别 n 凋亡率/%空白组6.52 ±0.18 NC 组 3 6.74 ±0.21 siRNA -3 组 3 28.43 ±1.29 3*

图5 流式细胞仪检测细胞凋亡
3 讨论
机体抗肿瘤免疫主要是T介导的细细胞免疫。在T细胞活化和耐受的免疫调节中,B7-CD28家族成员介导的T淋巴细胞共刺激信号传导途径起着至关重要的作用。它们不仅在启动、增强和维持T细胞应答中提供了关键的正性信号,而且还可提供重要的负性信号来限制、终止或削弱T细胞的免疫应答。B7家族能提供刺激或抑制信号调节T细胞的反应,这取决于B7家族哪种配体和受体作用于靶细胞[10-11]。B7-H4是最近发现的B7家族新成员,位于人的染色体1p11.1,编码1个具有282个氨基酸的蛋白。体外T细胞增殖试验证实B7-H4细胞能显著抑制T细胞的增殖,能将T细胞阻滞在细胞增殖的G0/G1期,并降低IL-2、IL-4、IL-10和IFN-γ的分泌,尤其对IL-2更为显著[1-12-13]。Miyatake等[14]发现乳腺癌组织中 B7 -H4 表达强度与浸润性CD3+和CD8+T细胞的数量呈反比,提示B7-H4可抑制T细胞向肿瘤组织中趋化,从而介导肿瘤细胞的免疫逃逸。
B7-H4 mRNA广泛分布于外周组织,但蛋白表达检测阴性。说明正常外周组织B7-H4的表达在翻译水平被严格调控,目前在多种恶性肿瘤组织及细胞株中均检测到B7-H4异常高表达,Chen等[15]对112例食管鳞状细胞癌(ESCC)患者的癌组织切片进行B7-H4检测,发现B7-H4表达升高,并发现B7-H4表达强度与肿瘤转移,TNM分期正相关,与CD3+T细胞和CD8+T细胞的密度负相关,认为B7-H4可能是ESCC免疫治疗的潜在靶点。Qian等[16]发现B7-H4在前列腺癌组织中呈弥漫性高表达,而在正常组织中不表达,且肿瘤患者的B7-H4的表达水平随患者肿瘤分级的增高而升高,但其与前列腺癌增殖和凋亡的关系还未见报道。
Salceda等[17]首次提出B7-H4在促进上皮细胞的恶性转化中起着直接的作用,首先转染B7-H4基因到B7-H4-的人卵巢癌细胞株中,发现能促进肿瘤在SCID小鼠体内的生长,并抑制肿瘤细胞的凋亡,利用siRNA下调人类乳腺癌细胞B7-H4 mRNA的表达可提高肿瘤细胞中caspase的活性并诱导肿瘤细胞的凋亡。本研究在证明所设计合成的siRNA能够有效抑制B7-H4表达后,将这段siRNA转染DU145细胞。结果显示:在对干扰组进行转染后,干扰组DU145细胞生长增殖明显慢于空白对照组和阴性对照组,凋亡率明显高于其他两对照组。而两个对照组之间的细胞生长情况则无显著性差异。由此可以说明B7-H4的表达与DU145细胞的生长是具有相关性的。沉默B7-H4基因在一定程度上可诱导DU145细胞凋亡,发挥抗肿瘤效应。这与Salceda等的研究基本一致。B7-H4可能通过抑制T细胞活性,逃避机体的免疫监视或者直接抑制肿瘤细胞凋亡两个方面促进肿瘤的恶性生物学行为。然而,B7-H4在促进肿瘤生长,抑制凋亡的准确作用还不是很清楚。
[1]Sica GL,Choi IH,Zhu G.B7 -H4,a molecule of the B7 family,negatively regulates T cell immunity[J].Immumity,2003,18(6):849-861.
[2]Prasad DV,Richards S,Mai XM.et al.B7S1,a novel B7 family member that negatively regulates T cell activation[J].Immunity,2003,18(6):863 -873.
[3]Zang X,Loke P,Kim J,et al.B7x:a widely expressed B7 family member that inhibits T cell activation[J].Prac Natl Acad Sci USA,2003,100(18):10 388 -10 392.
[4]Arigami T,Uenosono Y,Hirata M,et al.Expression of B7 -H4 in blood of patients with gastric cancer predicts tumor progression and prognosis[J].J Surg Oncol,2010,102(7):748 -752.
[5]Krambeck AE,Thompson RH,Dong H,et al.B7 - H4 expression in renal cell carcinoma and tumor vasculature:associations with cancer progression and survival[J].Proc Natl Acad Sci USA,2006,103(27):10 391 -10 396.
[6]Arigami T,Uenosono Y,Ishigami,et al.Clinical significance of the B7-H4 coregulatory molecule as a novel prognostic marker in gastric cancer[J].World J Surg,2011,35(9):2 051 -2 057.
[7]Zhang Y,Chen ZD,Du CJ,et al.siRNA targeting survivin inhibits growth and induces apoptosis in human renal clear cell carcinoma 786 - O cells[J].Pathol Res Pract,2009,205(12):823-827.
[8]Kunze D,Wuttig D,Fuessul S,et al.Multitarget siRNA inhibition of antiapoptotic genes(XIAP,BCL2,BCL - X(L))in bladder cancer cells[J].Anticancer Res,2008,28(4B):2 259 -2 263.
[9]Reagan-Shaw S,Ahmad N.Silencing of polo-like kinase(Plk)1 via siRNA causes induction of apoptosis and impairment of mitosis machinery in human prostate cancer cells:implications for the treatment of prostate cancer[J].FASEB J,2005,19(6):611 -613.
[10]Carreno BM,Collins M.The B7 family of ligands and its receptors:new pathways for costimulation and inhibition of immune responses[J].Annu Rev Immunol,2002,20:29 -53.
[11]Khoury SJ,Sayegh MH.The roles of the new negative T cell costimulatory pathways in regulating autoimmunity[J].Immunity,2004,20(5):529 -538.
[12]Kryczek I,Wei S,Zou L,et al.Cutting edge:induction of B7-H4 on APCs through IL-10:novel suppressive mode for regulatory T cells[J].J Immunol,2006,177(1):40 - 44.
[13]Suh WK,Wang S,Duncan GS,et al.Generation and characterization of B7 - H4/B7S1/B7x- deficient mice[J].Mol Cell Biol,2006,26(17):6 403 -6 411.
[14]Miyatake T,Tringler B,Liu W,et al.B7 -H4(DD -O110)is overexpressed in high risk uterine endometrioid adenocarcinomas and inversely correlated with tumor T-cell infiltration[J].Gynecol Oncol,2007,106(1):119 - 127.
[15]Chen LJ,Sun J,Wu HY,et al.B7 - H4 expression associates with cancer progression and predicts patient's survival in human esophageal squamous cell carcinoma[J].Cancer Immunol Immunother,2011,60(7):1 047 -1 055.
[16]Qian Y,Yao HP,Shen L,et al.Expression of B7 - H4 in prostate cancer and its clinical significance[J].Zhejiang Da Xue Xue Bao Yi Xue Ban.2010,39(4):345 -349.
[17]Salceda S,Tang T,Kmet M,et al.The immunomodulatory protein B7-H4 is overexpressed in breast and ovarian cancers and promotes epithelial cell transformation[J].Exp Cell Res,2005,306(1):128 -141.
