超声破碎变异链球菌后蛋白质提取条件的优化研究
2012-06-29何永红万呼春钟晓波
刘 果,何永红,万呼春,钟晓波,齐 进△
(1.重庆医科大学附属口腔医院400015;2.口腔疾病研究国家重点实验室/四川大学,成都610041;3.四川大学华西口腔医院内科,成都610041)
变异链球菌(streptococcus mutans,以下简称变链菌)属革兰阳性球菌,以其较强的产酸、耐酸及黏附能力成为牙菌斑生物膜中的优势菌,是导致龋病的重要致病菌之一[1]。目前,已有研究表明,多种药物成分可有效抑制变链菌生长,但具体作用机制未知。双向电泳(two-dimensional electrophoresis,2DE)作为蛋白质组学研究的核心技术,能够对近万种蛋白质实现分离,动态分析细菌蛋白质的表达变化,在研究致龋机制、药物抑菌机制等方面具有重要意义[2-4]。而如何增大样品蛋白质的提取量并提高其溶解度是蛋白质组研究的关键步骤[5]。超声法破碎细菌提取样品蛋白质是常用方法,本研究采用超声法破碎细菌,并对如何提高蛋白质的提取效率进行研究,为开展变链菌的蛋白质组学进行探索,为变链菌致龋机制的研究提供基础。
1 材料与方法
1.1 主要仪器和试剂 变异链球菌ATCC25175(四川大学口腔疾病研究国家重点实验室提供),TPY培养基,裂解液(30 mmol/L Tris-Hcl,7mol/L脲,2mol/L硫脲,4%CHAPS,1%DTT,5mmol/L PMSF),RC DC 蛋白定量试剂盒(BIO-RAD公司,美国),超声破碎仪(Sanyo公司,日本),微型垂直电泳系统和BIO-RAD 2000凝胶成像分析系统(BIO-RAD 公 司,美国)。
1.2 实验方法
1.2.1 细菌培养及收集 细菌复苏后接种TPY琼脂平板,37℃兼性厌氧(80%N2,10%H2,10%CO2)培养24h,挑取单菌落接种TPY液体培养基,37℃兼性厌氧培养18h,收集菌悬液。4℃12 000×g离心10min,弃上清液,细菌沉淀用含氯霉素(100μg/mL)双蒸水洗涤2次后重悬于不含氯霉素的双蒸水中。调整菌悬液Mcf(麦氏值)=1.8左右,浓缩40倍后将菌悬液按每管1mL分装于离心管中,4℃12 000×g离心10 min,收集菌沉淀,-20℃保存备用。
1.2.2 超声破碎菌体 取-20℃保存的菌沉淀,加入裂解液1mL,冰浴条件下采用超声法(超声功率300~350W,工作9.9s,间歇9.9s,循环152次)裂解细菌。超声结束时将菌悬液振荡混匀。
1.2.3 扫描电镜观察裂解前、后菌体形态 分别取等量裂解前和裂解后菌悬液。将细菌悬液与等量5%戊二醛混合,4℃固定过夜。经磷酸盐缓冲液(PBS)液(pH7.2)洗3次,调整细胞悬液浓度为108~107CFU。取10μL滴于1cm×1cm大小载玻片上,50℃干燥10min使细菌固定。30%、40%、50%、60%、70%、80%、90%和100%梯度乙醇梯度脱水各10min,由醋酸异戊酯浸泡2h。常规临界点干燥,镀金,扫描电镜观察样本。
表1 放置不同时间提取的蛋白质样本吸光度A值(s,CV,n=3)
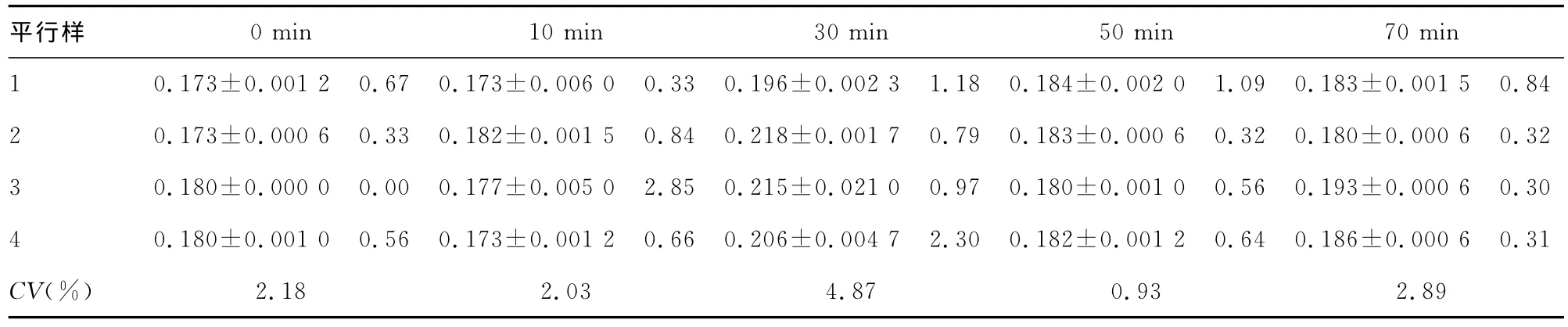
表1 放置不同时间提取的蛋白质样本吸光度A值(s,CV,n=3)
0min 10min 30min 50min 70min平行样.84 2.18 2.03 4.87 0.93 2.89
1.2.4 提取不同放置时间点菌悬液蛋白 将超声破碎后的菌悬液分装于1mL灭菌EP管中,分别编号为a、b、c、d、e,对应室温中放置时间0、10、30、50、70min。每个时间点设4个平行管。放置时间结束后,各管分别振荡混匀,然后4℃16 060×g离心10min,取上清液进行分析。
1.2.5 SDS-PAGE测定不同放置时间蛋白质构成的差异 按《蛋白质技术手册》制备SDS-PAGE,浓缩胶为5%,分离胶为12%。取各时间点的蛋白质提取液20uL,分别加入上样缓冲液混匀制成电泳样本。将电泳样本注入SDS-PAGE加样孔中,浓缩胶80V电泳30min,分离胶120V电泳90min停止。考马斯亮蓝染色30min,再用脱色液脱色至背景清晰。每个电泳样本重复2孔,电泳及染色重复3次。凝胶成像分析系统观察并采集图像。
1.2.6 RC DC法测定不同时间点蛋白质浓度
1.2.6.1 蛋白质标准系列配制 称取一定量BSA溶解于提取液对照中,配制蛋白质标准系列,标准系列浓度为0、0.25、0.5、0.75、1.0和1.5mg/mL。
1.2.6.2 蛋白质浓度测定 从各时间点的上清液中分别取25μL于EP管。按照RC DC试剂盒说明操作,取最终的反应液200μL于96孔板中,在750nm波长处测定每孔的吸光度值(A)。每个样本设3个平行孔。
1.3 统计学处理 采用SPSS13.0统计软件对数据进行处理,对蛋白质质量浓度的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 细菌破碎程度分析 未处理的变链菌收集后互相重叠呈团聚状,数量多,密度大,如图1A所示。高倍镜下观变链菌菌体形态完整饱满,在同一平面上分裂并相互粘连,如图1B所示。超声处理后绝大部分细菌破碎成絮状碎片,仅见极少量破裂不完全和形态完整的细菌,如图1C、D所示。
2.2 放置时间对提取蛋白质构成成分的影响 图2为裂解后从放置不同时间后的菌悬液中提取的蛋白质电泳图谱。由图显示放置不同时间后裂解液中的蛋白质经SDS-PAGE分离后的条带分布完全一致,同时条带丰度也无明显差异。
2.3 放置时间对提取蛋白质浓度的影响 蛋白质标准曲线为Y=0.118 9 X-0.002,相关系数为 0.996 1,其中 X为蛋白质浓度,Y为吸光度值。各时间点上清液样本的3个平行孔的变异系数CV(%)范围在0%~2.9%之间。各时间点4个平行样本吸光度值变异系数CV(%)范围为0.93%~4.87%之间,结果见表1。各时间点上清液的蛋白质浓度见图3所示。由图可见,超声结束后室温放置30min时裂解液中蛋白质含量最高。对5组进行单因素方差分析,结果显示放置30min和70min时裂解液中的蛋白质含量均高于其他3组,差异有统计学意义(P<0.05);同时,放置30min时裂解液中的蛋白质含量显著高于70min时(P<0.05);而放置0、10和50min的裂解液中的蛋白质含量比较差异无统计学意义(P>0.05)。
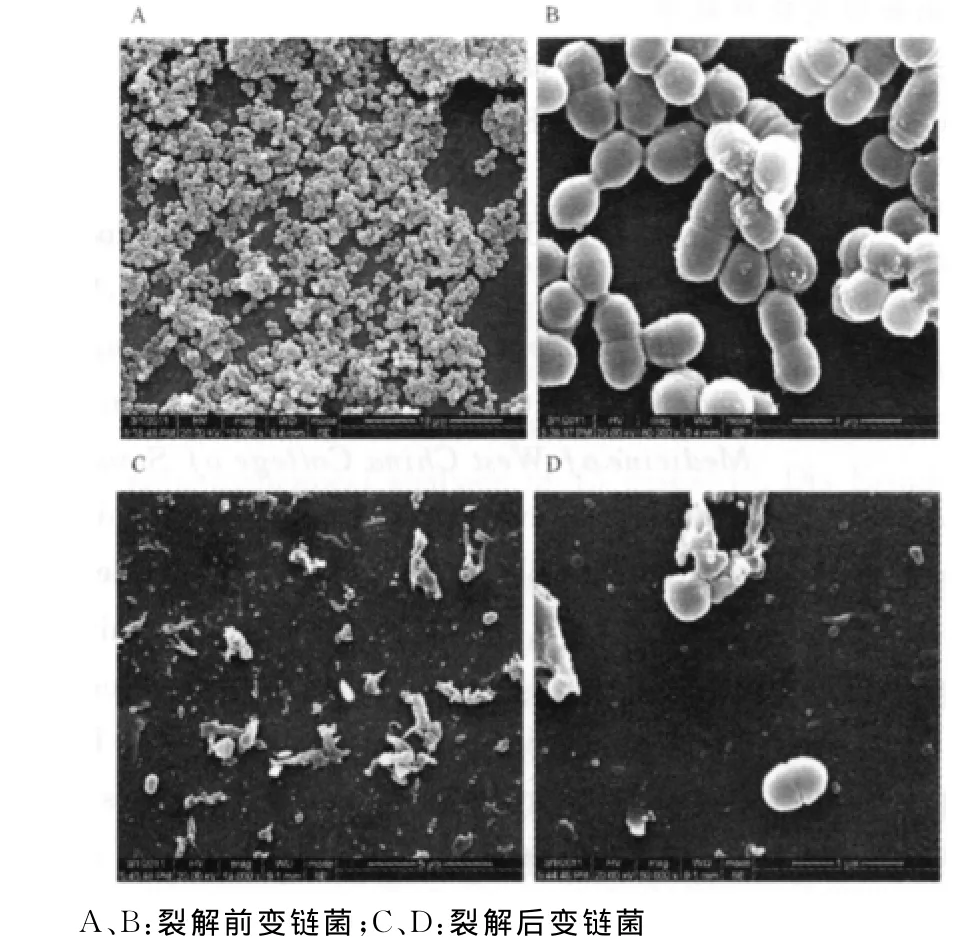
图1 超声裂解前、后的变链菌形态
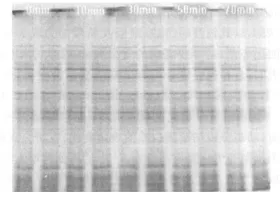
图2 裂解后放置不同时间提取的蛋白质SDS-PAGE图谱
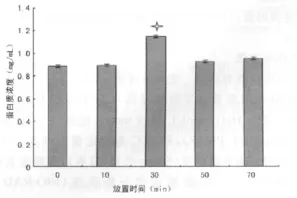
图3 放置不同时间提取的蛋白质样本质量浓度
3 讨 论
变异链球菌属于革兰阳性菌,细胞壁厚且坚韧难以破碎,一般采用的破碎方法有反复冻融结合超声法、氧化铝粉末混合研磨法、玻璃珠匀浆法以及高压法等[6-8]。超声波破碎法是目前提取细菌蛋白时常用的技术手段[9-10]。Thongboonkerd等[11]研究认为仅通过超声即可使化脓性链球菌达到80%的破碎,但无明确评价细菌破碎程度的指标。超声破碎法在大大提高蛋白质提取效果的同时,还能增加蛋白质的溶解性[12],且可避免外源性蛋白质对样本的污染[13]。已有实验表明超声破碎变链菌效果明显[9,14],而在变链菌蛋白质组研究中,如何提取样本的最大量对结果至关重要。本实验将超声破碎结束的变链菌菌悬液分别放置不同时间,在菌体内的蛋白质充分溢出并溶解后,对其中的蛋白进行构成及量的测定,探索放置时间对菌悬液中蛋白质提取效率的影响。SDS-PAGE电泳可根据相对分子质量的不同分离混合蛋白质,是分析各蛋白质构成变化的有效手段[14]。本实验电泳结果显示,超声后放置不同时间的菌悬液中蛋白质的条带分布及丰度基本相同,提示放置时间对菌悬液中蛋白质的构成无明显影响,但对浓度的影响无法通过SDS-PAEG电泳精确展示。本实验采用的RC DC试剂盒法以Lowry法为基础,并能够兼容裂解液中多种试剂成分,同其他蛋白质定量测定方法相比,具有精密度高、准确性好等特点[15-16]。定量结果表明,超声破碎后放置30min的菌悬液中蛋白质的浓度最高;放置时间少于30min的菌悬液,随时间的延长蛋白质浓度逐渐升高,而超过30min所提取的蛋白质随时间的延长浓度下降。
经扫描电镜观察,大部分细菌破裂后呈絮状碎片,极小部分细菌呈现清晰的残余菌体形态,个别变链菌菌体较为完整。提示胞壁破裂完全的细菌胞内物质已充分外流,蛋白质等内容物的释放较彻底。而形态完整的细菌胞壁上可能存在有较小的裂口,猜测它们和存在残余菌体的变链菌胞内物质的释放需要一定时间完成。在测定蛋白质质量浓度时,需保证菌体内释放的蛋白质充分溶解于提取介质中。而当蛋白质的释放量少,或出现蛋白降解、沉淀等情况时,即导致提取介质中蛋白质的溶解减少,使测量浓度偏低。本实验采用的提取液中含有的脲和硫脲等可以充分破坏蛋白质之间形成的氢键,防止由氢键引起的蛋白质聚集。还原剂DTT能够帮助打开蛋白质的二硫键,促进半胱氨酸残基被还原,使已变性的蛋白质展开更完全,溶解更彻底。而蛋白酶抑制剂PMSF可有效抑制细菌自身所释放的蛋白酶对蛋白质的降解。由数据可看出,蛋白质质量浓度与裂解后放置时间在0~30min范围内成正相关。由此提示,一方面,蛋白质的释放可能随时间的延长增加;另一方面,提取介质中复杂的试剂成分与蛋白质、水解酶的相互作用可能并没有伴随裂解过程的结束而终止,而在裂解后的一段时间内继续进行。同时,蛋白酶抑制剂PMSF主要抑制丝氨酸蛋白酶和巯基蛋白酶,而菌体内释放的其他蛋白酶可能仍存在活性,它们在溶解后与蛋白质相互作用,导致蛋白质浓度的降低。但放置30~70min与蛋白质浓度的相关性无明显规律,具体作用机制需进一步探索。
[1]周学东,肖晓蓉.口腔微生物学[M].成都:四川大学出版社,2002:12-28.
[2]Hrimech M,Mayrand D,Grenier D,et al.Xylitol disturbs protein synthesis,including the expression of HSP-70and HSP-60,in Streptococcus mutans[J].Oral Microbiol Immunol,2000,15(2):249-257.
[3]Visith TH,Jirapon L,Junkai C,et al.Fluoride exposure attenuates expression of streptococcus pyogenes virulence factors[J].J Biolog Chem,2002,277(19):16599-16605.
[4]Brighenti,Luppens.Effect of psidium cattleianum leaf extract on streptococcus mutans viability,protein expression and acid production[J].Caries Res,2008,42(2):148-154.
[5]谈旭翡,陈智.蛋白质组学研究中双向电泳样本的制备[J].医学分子生物学杂志,2008,5(5):462-465.
[6]Wilkins JC,Homer KA,Beighton D.Analysis of streptococcus mutans proteins modulated by culture under acidic conditions[J].Appl Environ Microbiol,2002,6(15):2382-2390.
[7]Welin J,Wilkins JC,Beighton D,et al.Effect of acid shock on protein expression by bioflm cells of streptococcus mutans[J].FEMS Microbiol Letters,2003,227(2):287-293.
[8]牛屹东,冯捷,崔恒,等.蛋白质双向电泳实验手册[M].北京:北京大学医学出版社,2006:1-13.
[9]何永红,田晓蓓,万呼春,等.变异链球菌蛋白提取方法研究[J].华西口腔医学杂志,2009,27(1):100-103.
[10]Alice C,Len L.Harty DW.Stress-responsive proteins are upregulated in streptococcus mutans during acid tolerance[J].Microbiology,2004,150(11):1339-1351.
[11]Thongboonkerd V,Luengpailin J,Cao JK,et al.Fluoride exposure attenuates expression of streptococcus pyogenes virulence factors[J].J Biol Chem,2002,19(277):16599-16605.
[12]Cañas B,Piñeiro C,Calvo E,et al.Trends in sample preparation for classical and second generation proteomics[J].J Chromatogr A,2007,1153(2):235-258.
[13]Rathsam C,Eaton RE,Simpson CL,et al.Two-dimensional fluorescence difference gel electrophoretic analysis of streptococcus mutans biofilms[J].J Proteome Res,2005,4(6):2161-2173.
[14]田晓蓓,韩建国.超声时间对提取变异链球菌蛋白质的实验研究[J].徐州医学院学报,2010,30(8):527-529.
[15]Mey MD,Lequeux GJ,Maertens J,et al.Comparison of protein quantification and extraction methods suitable for E.coli cultures[J].Biologicals,2008,36(3):198-202.
[16]Okutucu B,Dinçe A,Habibö,et al.Comparison of five methods for determination of total plasma protein concentration[J].J Biochem Biophys Methods,2007,70(5):709-711.
