猪博卡病毒实时荧光定量PCR 检测方法的建立
2012-06-29刘佩红周锦萍鞠厚斌葛菲菲华修国
邓 波,刘佩红,周锦萍*,王 建,刘 健,鞠厚斌,葛菲菲,崔 立,华修国
(1.上海市动物疫病预防控制中心,上海 201103;2.上海交通大学 上海市兽医生物技术重点实验室,上海 200240)
博卡病毒(Boka virus,BoV)属于细小病毒科,而细小病毒科属于最小、最简单的一类单链线状DNA病毒,包括感染鸟类和哺乳动物的细小病毒亚科和感染节肢动物的浓核病毒亚科2个亚家族。细小病毒亚科又包括5个属,即细小病毒属、红病毒属、依赖性病毒属、貂阿留申病毒属和博卡病毒属[1]。
Blom strom A等[2]利用随机多重置换扩增方法 (random multiple displacement amplification,MDA)在患仔猪断奶后多系统衰竭综合征的猪淋巴结中扩增出了一段长1879bp的核苷酸序列,该段序列与已知病毒序列比较,发现其完整的NP1基因及部分VP1/VP2基因与人类博卡病毒相近,故将该病毒暂时定义为猪博卡病毒(Porcine bocavirus,PBoV)。PBoV在病猪体内被检出,暗示其对猪有一定的致病性。翟少伦等[3]于2010年建立一种检测PBoV的PCR方法。
实时荧光定量PCR(Real-time fluorescent quantitative PCR,Real-time PCR)具有较高的特异性、灵敏度,以及可定量、有效解决PCR污染问题及自动化程度高等优点,在医学、微生物和动植物检疫方面得到广泛应用[4-6]。本研究目的在于建立Taq Man探针实时荧光定量PCR方法用于检测PBoV。
1 材料与方法
1.1 材料
1.1.1 阳性样品来源 阳性样品由上海交通大学上海市兽医生物技术重点实验室提供,按照参考文献[3]进行PCR检测,并将产物送上海英俊生物技术有限公司测序后通过NCBI核酸数据库进行同源性比对。
1.1.2 主要试剂 DNA Marker,宝生物工程(大连)有限公司产品;Agarose LE,Genebase Gene-Tech公司产品;6×loading buffer、dNTP、Taq DNA聚合酶、质粒抽提试剂盒、凝胶回收试剂盒、DH5α感受态大肠埃希菌,上海诺伦生物医药技术有限公司产品。
1.2 方法
1.2.1 引物及探针的设计和筛选 根据GenBank中已发表的Bocavirus 5′端非编码区的保守核苷酸序列 VP1/2区域,采用软件 Primer Express 2.0(ABI公司)设计引物和Taq Man荧光探针序列,并通过NCBI核酸数据库进行同源性比对验证(登录号:FJ872544),筛选获得的引物和探针如下:
PBo-F1:5'TCAGAGATCGAGCTATACAACCG3';PBo-R2:5'CTGTTTCGGAGATGTCCTTGC3';PBo-Probe:5'-FAM-AGCTCTTCGAATCGCCGCTCTCCT-BHQ-3';引物由上海生工生物工程技术服务公司合成,Taq Man探针由上海诺伦生物医药技术有限公司合成,PAGE纯化。扩增目标片段长度为85bp。
1.2.2 病毒DNA的抽提和模板的制备 病毒DNA的抽提选用血液病毒DNA快速提取试剂盒(LG-0105A),上海诺伦生物医药技术有限公司产品。
PCR扩增产物经回收、纯化、连接和转化,将扩增产物克隆到pGEMT-Vector载体中,构建阳性质粒。提取质粒进行PCR鉴定,并送至上海生工生物技术工程服务公司测序,并与GenBank中已知序列进行比较。
1.2.3 PBoV实时荧光定量PCR的建立和条件优化 扩增反应体系如下:10×扩增缓冲液6μL,4种dNTP混合物各200μmol/L,模板DNA2μL,Taq DNA聚合酶2U/μL,UNG酶Tris-HCl pH 8.6缓冲液5U/100μL,加双或三蒸水至30μL。按下列反应参数进行扩增:94℃5min,94℃,15s,60℃40 s,40个循环。
确定反应体系后,比较 Mg2+浓度分别为3.0、3.5、4.0、4.5、5.0mmol/L下,引物浓度分别为0.1、0.2、0.3、0.6、0.8、1.0、1.2μmol/L下,探针终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6μmol/L 下的PCR扩增效果,选择最适浓度[7]。每次检测时,设置阴性对照(健康猪的基因组DNA)和水为模板的空白对照;在阴性对照和阳性对照均成立时,整个试验有效,可判定结果[8]。
1.2.4 特异性试验 利用建立的实时荧光定量PCR反应体系,扩增临床保存的15例SPF猪血清、5份猪细小病毒(PPV)阳性、5份猪蓝耳病病毒(PRRSV)阳性、5份猪圆环病毒(PCV)阳性病料标本,检测其特异性。
1.2.5 灵敏度试验 提取DNA质粒,然后分级10倍稀释成1×1010copies/μL~100copies/μL,分别取每一数量级稀释液2μL作为PCR模板。在PCR的过程中由实时荧光定量PCR仪自动绘制线性标准曲线。按照参考文献[3]进行常规PCR,产物大小为496bp,比较两种方法灵敏度的差异。
1.2.6 重复性试验 以相同稀释度质粒作为模板,10倍梯度稀释成3个不同梯度模板,重复10次反应。并取质粒和阴性血清稀释液,提取核酸,重复多孔同步检测,考察重复性[9]。
1.2.7 稳定性试验 将检测试剂放入4℃冰箱中及37℃恒温箱中进行加速破坏试验,连续监测7d反应试剂检测性能的变化,从而判断反应体系的稳定性。1.2.8 标准曲线的建立 将101copies/μL~107copies/μL系列核酸样品设为标准品,以各标准品的拷贝数值为X轴,以Ct值为Y轴构建定量标准曲线。
2 结果
2.1 反应条件的优化
结果表明,不同Mg2+浓度、引物和探针终浓度对结果影响较大,经筛选后确定 Mg2+浓度为3.5 mmol/L、引物浓度为0.2μmol/L和探针浓度0.2 μmol/L。各反应条件优化后,每次检测的阴性对照和空白对照无Ct值,无扩增曲线。阳性对照的Ct值均小于31.00,并出现典型的扩增曲线,阳性对照扩增曲线基本上是重合的。
2.2 特异性试验结果
特异性结果显示,只有PBoV出现扩增曲线,Ct值分别为29.48和30.01,判为阳性。而其他病原和阴性对照均为阴性,表明建立的方法有较好的特异性(图1、图2)
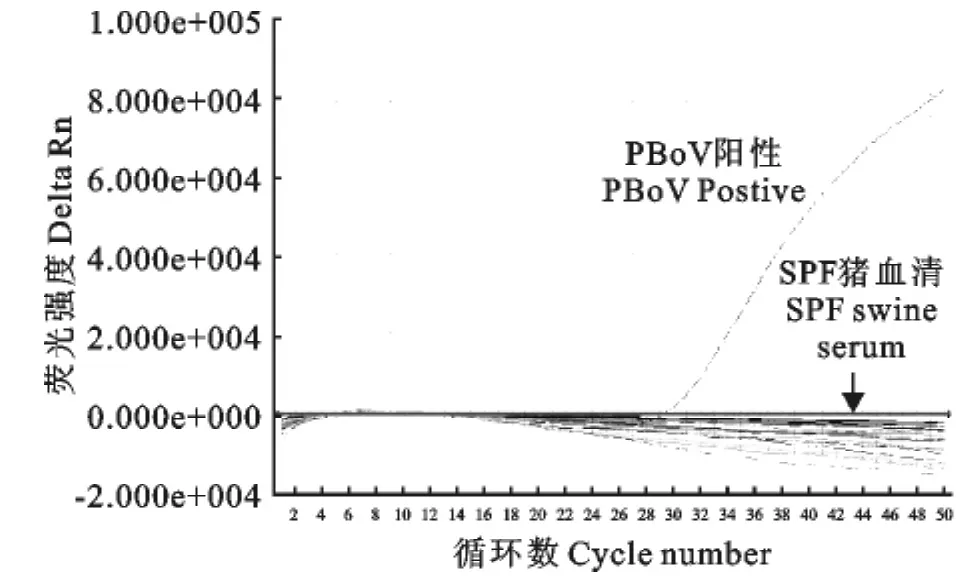
图1 15例SPF猪血清标本实时荧光PCR检测扩增图Fig.1 Amplification curves of 15SPF serum sample templates

图2 15例组织样品PBoV R普通PCR检测阴性标本实时荧光PC检测扩增图Fig.2 Amplification curves of 15negative sample templates
2.3 灵敏度试验结果
本试验可检测107copies/μL~101copies/μL病毒载量,区别于阴性对照的最低模板浓度即灵敏度为101copies/μL,即将质粒以10倍倍比稀释至浓度极限102copies/μL,多次重复试验测得实时荧光定量PCR反应系统的检测最低限度为101DNA拷贝每30μL反应体系(图3)。
同时用普通PCR方法和荧光定量PCR方法对上海及周边地区122份猪临床内脏样本进行猪博卡病毒检测(表1)。结果表明有4份样品荧光定量PCR方法检测为阳性,而普通PCR方法检测为阴性。将4份阳性产物送上海英俊生物技术有限公司测序后通过NCBI核酸数据库进行比对,同源性均在97%以上。

图3 从左至右分别为107copies/μL~101copies/μL八个不同浓度猪博卡阳性质粒标准品的荧光曲线Fig.3 From left to right:Amplification curves of(107copies/μL ~101copies/μL)PBoV plasmid templates
2.4 重复性试验
如表2结果所示,所有稀释梯度下变异系数均在0.25%~0.54%左右,远小于其他研制试验报道[10]的变异系数(CV)6.66%和6.84%,表明本检测系统对阳性质粒检测的重复性较好。
2.5 稳定性试验
如表3、表4与图4、图5所示,4℃试验中PBoV-1、PBoV-2和PBoV-3变异系数分别为1.38%、5.44% 和 3.79%。37℃试验中分别为2.37%、1.71%、5.61%。4℃和37℃试验7d连续检测后分析结果,其变异系数2%~5%左右,从试验结果可见,检验体系具有良好的稳定性。
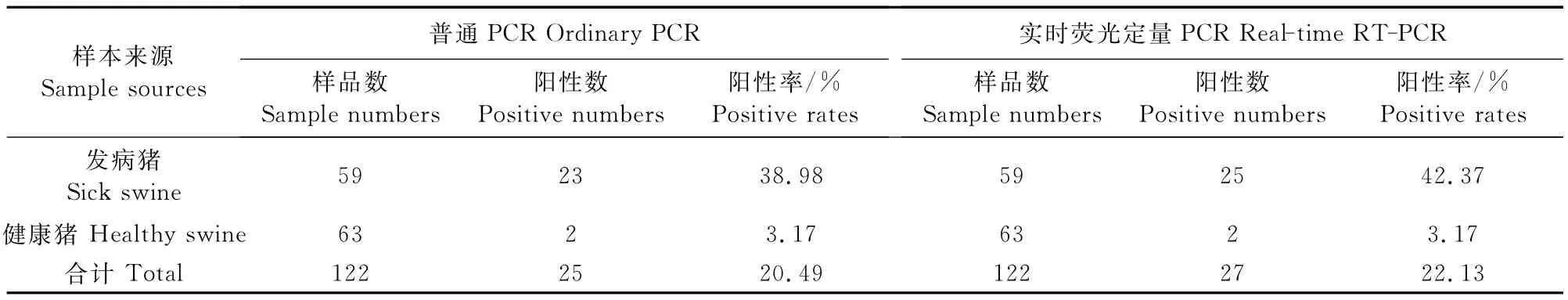
表1 两种方法对博卡病毒检测结果的比较Table1 The comparison results of two detection methods for PBoV

表2 重复性分析Table2 Repeatability analysis
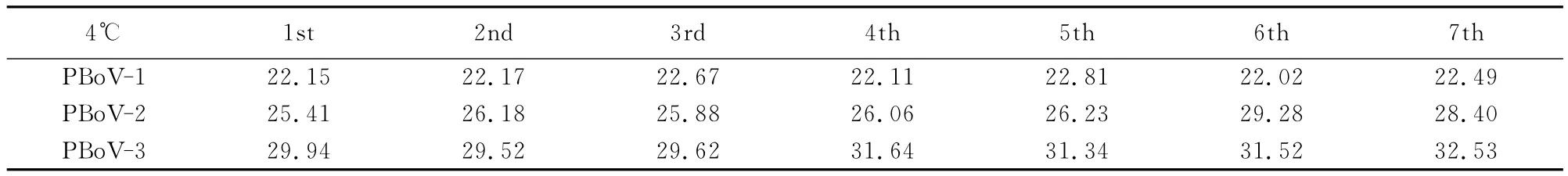
表3 4℃稳定性检测结果Table3 Stability test results at 4℃
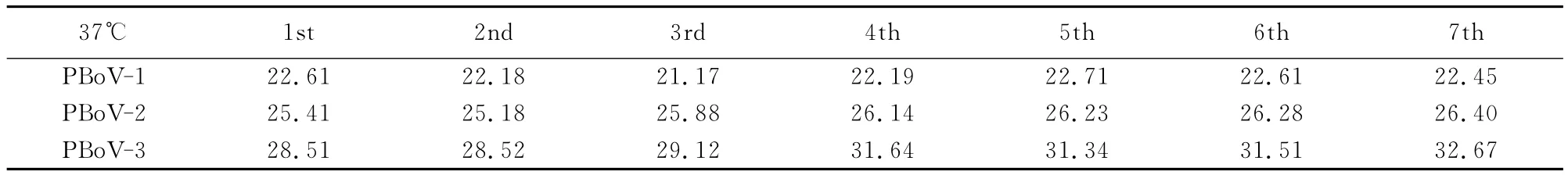
表4 37℃稳定性检测结果Table4 Stability test results at 37℃

图4 4℃稳定性定量结果分析Fig.4 Stability quantitative analysis at 4℃

图5 37℃稳定性定量结果分析Fig.5 Stability quantitative analysis at 37℃
2.6 定量标准曲线的建立
将稀释的DNA设为标准样品,建立标准曲线(图6)。由图可知,曲线斜率为-3.857,模板浓度在107~101范围内有较好的线性关系,相关系数为0.997。在对送检样品进行检测时,可根据获得的Ct值和标准曲线计算该样品所含病毒数量,但所检测到的只是病毒的DNA拷贝数,而非具有感染性的病毒颗粒。

图6 Real-time PCR 标 准曲线Fig.6 The standard curve for real-time PCR
3 讨论
猪博卡病毒是最新发现的一种DNA病毒,为了及时地评估其在我市的流行情况,本研究根据GenBank上递交的惟一一条猪博卡病毒核苷酸序列设计了一对特异性引物,并建立了猪博卡病毒的荧光定量PCR检测方法。Taq Man荧光探针法具有快速、特异性高、操作简便、重复性好、一次试验可以同时检测大批量样本等优点。试验所用的Taq Man技术对于整个试验的扩增检测都是在一个密闭体系中进行的,减少了扩增体系本身以及其对实验室环境的污染[3]。本试验建立的实时荧光定量PCR方法可以作为猪博卡病毒在临床上的一种诊断技术。
本方法灵敏度检测限度为101copies/μL;特异性方面,在对30例阴性标本的检测中未出现一例假阳性。稳定性试验,4℃试验中PBoV-1,PBoV-2,PBoV-3变异系数分别为1.38%,5.44%,3.79%。37℃试验中PBoV-1,PBoV-2,PBoV-3变异系数分别为2.37%、1.71%、5.61%4℃和37℃试验7d连续检测后分析结果,其变异系数2%~5%左右,从试验结果可见,本方法具有良好的稳定性。
综上所述,本试验所建立的实时荧光定量PCR检测的方法,具有灵敏度高,特异性好,在对猪博卡病毒株的基因诊断中具有广泛的临床应用前景,适合做大规模临床样本的检测。
[1]Tattersall P,Bergoin M,Bloom M E,et al.Family Parvoviridae[M].//Fauquet CM,MayoMA,ManiloffJ,et al.Virus taxonomy:classification and nomenclature of viruses.Eighthreport of the International Committee on the Taxonomy of Viruses.London,United Kingdom:Elsevier Academic Press,2005:353-369.
[2]Blomstrom A,Belak S,Fossum C,et al.Detection of a novel porcine boca-like virus in the background of porcine circovirus type 2induced postweaning multisystemic wasting syndrome[J].Virus Res,2009,146:125-129.
[3]翟少伦,岳 城,韦祖樟,等.猪博卡病毒PCR检测方法的建立及其应用[J].中国动物传染病学报,2010,18(2):14-17.
[4]Balka G,Hormyak A,Balint A,et al.Development of a onestep real-time quantitative PCR assay based on primer-probe energy transfer for the detection of porcine reproductive and respiratory syndrome virus[J].J Virol Meth,2009,158(1):41-45.
[5]Dina J,Nguyen E,Gouarin S,et al.Development of duplex realtime PCR for detection of two DNA respiratory viruses[J].J Virol Meth,2009,162(1-2):119-125.
[6]张 贺,李 波,周 虚,等.实时荧光定量PCR技术研究进展及应用[J],动物医学进展,2006,27(S):5-12.
[7]Yancy H F,Washington J D,Callahan L,et al.Development,e valuation,and peer verification of a rapid real-time PCR method for the detection of animal material[J].J Food Prot,2009,72(11):2368-2374.
[8]范 晴,谢芝勋,刘加波,等,牛病毒性腹泻病毒实时荧光RT-PCR检测方法的建立[J].动物医学进展,2010,31(10):10-14.
[9]Andre L,Hamel M.Rapid detection of bovine viral diarrhea vi-rus by using RNA extracted directly from assorted specimens and one-tube reverse transcription PCR assay[J].J Clinical Microbiol,1995,33(2):287-291.
[10]Allander T,Jartti T,Gupta S,et al.Human bocavirus and acute wheezing in children[J].Clin Infect Dis,2007,44(7):904-910.
