米曲霉碱性蛋白酶基因的克隆表达及水解特性*
2012-06-25柯野陈丹李家洲谢明权罗晓春
柯野 陈丹 李家洲 谢明权 罗晓春†
(1.华南理工大学生物科学与工程学院,广东广州510006;2.广东轻工职业技术学院食品与生物工程系,广东广州510300)
蛋白酶是一类重要的工业用酶,占整个工业用酶量的60%以上;其中,碱性蛋白酶约占蛋白酶总量的一半,广泛应用于食品加工、皮革、医药和化工等行业[1].目前商业化的碱性蛋白酶主要来源于芽孢杆菌,来源于真菌的极少[2].米曲霉(Aspergillus oryzae)是一种能产生多种蛋白酶的真菌,据2007年对该菌的全基因组序列报道,通过对该基因组的分析预测,发现该菌共有134个蛋白酶基因,其中69个为外肽酶、65个为内肽酶,但只有少数蛋白酶的功能与性质被解释清楚[3].该菌广泛应用于豆酱、酱油和酒类酿造等发酵工业.在酿造工业中,米曲霉产生的酸性蛋白酶活力较低(主要以产生碱性蛋白酶和中性蛋白酶为主),尤其是碱性蛋白酶对底物蛋白的水解程度对水解物产生的独特风味和脱苦味起着关键作用[1,4-5].目前,国内外学者对米曲霉的研究主要集中于通过优化固体(或者液体)发酵来提高米曲霉蛋白酶的产量或通过分离纯化其产生的部分酶进行性质研究[1,6].优化发酵条件很难大幅度提高碱性蛋白酶产量,且发酵过程易受多种因素(如易污染或菌株生长状态)影响.另外,米曲霉产生的蛋白酶种类较多,这增加了碱性蛋白酶的纯化难度,阻碍了其进一步的开发利用[7].有关该酶的酶学性质、异源表达和水解特性等的研究目前鲜见报道.
毕赤酵母(Pichia pastoris)表达系统是目前表达异源蛋白性能较好的系统之一,其操作工艺简单,表达量高.该系统能对表达的蛋白进行折叠和翻译后修饰,获得具有活性的目的蛋白,此目的蛋白能直接分泌至发酵液中便于分离与纯化.目前已有较多外源基因在该系统中成功表达的报道[8].文中主要通过克隆获得米曲霉碱性蛋白酶基因,以期能在毕赤酵母表达系统中进行异源表达,提高其产量,并对其酶学性质和水解性质进行初步研究,为该重组碱性蛋白酶在相关产业中的推广应用奠定基础,改变目前商业碱性蛋白酶主要来源于芽孢杆菌的局面,并为开发利用来源于真菌的碱性蛋白酶提供理论参考.
1 材料与方法
1.1 试验材料
1.1.1 菌株与质粒
米曲霉沪酿3.042菌株购自上海迪发酿造生物制品有限公司,毕赤酵母KM71菌株和表达载体pPIC9K试剂购自Invitrogen公司.
1.1.2 工具酶和试剂
各种工具酶购自Takara(大连)公司,PCR扩增引物和Trizol试剂购自Invitrogen(广州)公司,蛋白质分子质量标准物购自Fermentas公司,牛胰岛素氧化B链购自Sigma公司,其他试剂均为进口或国产分析纯.
1.2 试验方法
1.2.1 米曲霉碱性蛋白酶基因的克隆
将米曲霉菌株接种在装有麸皮的固体培养基(96.41% 麸皮、0.23% 麦芽糖、1.56% 蛋白胨、0.74%KH2PO4、0.06%FeSO4·7H2O,培养基起始含水量为每克麸皮含1.00 mL水)中,25.0℃恒温培养48 h.收集菌丝体,用液氮研磨,按Trizol试剂操作手册提取和鉴定RNA,-70℃保存备用.利用Takara(大连)公司反转录试剂盒合成第一链cDNA.据Genbank数据库报道的米曲霉碱性蛋白酶(Alp)基因序列(登录号:XM_001820092)设计引物.P1引物:5'ATGCAGTCCATCAAGCGTACCT3';P2引物:5'TTAAGCGTTACCGTTGTAGGCAAG3'.以 cDNA为模板,采用P1和P2引物进行50 μL体系的PCR反应.反应程序:94℃变性2min;98℃变性10s,55℃退火15 s,72℃延伸2 min;30个循环后72℃延伸5min.纯化回收PCR产物,克隆至载体 pSIMPLE-18EcoR V/BAP上,转化至大肠杆菌GT116中,筛选阳性克隆测序确认.
1.2.2 酵母重组表达载体的构建
设计碱性蛋白酶基因的P3和P4引物(该引物扩增的PCR产物不包括碱性蛋白酶基因的信号肽编码序列).P3引物:5'CCGGAATTCCCTGTGCAGGAAACCCGC3';P4引物:5'CTAGTTTAGCGGCCGCTTAGTGGTGGTGGTGGTGGTGAGCGTTACCGTTGTAGGCAAG3'.P3和P4引物下划线部分的序列上分别带有EcoR I和Not I限制性内切酶位点,斜体加粗序列表示增加6个编码组氨酸标签的序列.以测序确认后的克隆质粒载体作为模板,以P3和P4为引物进行50μL的PCR反应,反应程序同第1.2.1节;纯化回收PCR产物,然后分别对PCR产物与载体pPIC9K进行EcoR I和Not I双酶切,回收,对酶切产物进行连接,转化至大肠杆菌GT116中,筛选阳性克隆,测序鉴定,重组质粒命名为pPIC9K/Alp.
1.2.3 重组毕赤酵母的转化与筛选
将重组质粒pPIC9K/Alp采用限制性内切酶Sac I线性化,电击转化至毕赤酵母KM71菌株中,然后涂布于MD平板上培养,挑取培养出的酵母菌落,参照《分子克隆实验指南》[9]中酵母DNA的快速分离法提取酵母基因组,以酵母基因组为模板,以P3和P4为引物进行PCR扩增验证.
1.2.4 重组酵母在三角瓶和10 L发酵罐中的诱导表达
将筛选得到的阳性重组酵母菌株接种于装有25 mL BMGY培养基(pH=6.0)的250 mL三角瓶中,30℃振荡培养直至在600 nm波长下的吸光值D(600)约为5~6;然后离心收集菌体,转接至装有50mL BMMY培养基(pH=6.0)的500mL三角瓶中,每24h添加1%(体积分数)的甲醇进行诱导表达.诱导结束后,离心收集发酵上清液,采用Folin酚法测定发酵上清液中蛋白酶的酶活[10].酶活定义如下:在40℃下每分钟水解酪蛋白产生1μg酪氨酸为1个蛋白酶活力单位.通过SDS-PAGE凝胶电泳以及Invitrogen公司的InVisionTMHis-tag In-gel Stain分析鉴定重组表达蛋白酶.
将重组酵母菌株接种于700mL YPD培养基中,30℃振荡培养至D(600)约为8~10,将培养物接种于装有6.3 L BSM发酵培养基的10 L发酵罐中培养.培养过程分为3个阶段:(1)甘油培养阶段,该阶段是为了让接种后的酵母菌利用发酵罐中的培养基迅速生长,提高发酵罐中的菌体浓度,该阶段溶解氧含量控制在40%水平,pH=5.0,30℃,培养至发酵罐中的溶解氧含量陡然上升接近100%;(2)添加甘油阶段,该阶段添加甘油是为菌体补充碳源,使其菌体浓度进一步增加,来达到酵母菌的高密度发酵,该阶段以12 mL/(L·h)的流速添加50%(质量分数)甘油(混有微量元素)到发酵罐中,维持数小时,通过控制搅拌速率、通气量和罐压方式维持发酵罐中的溶解氧含量在20%~35%之间,停止补加甘油后,待发酵罐中的溶解氧含量升至接近100%,继续维持菌体“甘油饥饿”状态1h;(3)甲醇诱导表达阶段,即甲醇流加进行诱导,重组蛋白酶基因位于AOX启动子下游,因此添加甲醇可紧密调节、诱导AOX启动子启动,促进外源的碱性蛋白酶基因的表达,并且由于KM71菌株中含有AOX2基因,因此KM71菌株也利用甲醇作为碳源,利于自身的生长,该阶段诱导条件为pH=6.0,28.3℃,发酵罐中的溶解氧含量维持在25% ~30%之间,甲醇流加速度逐渐提高至终速为5mL/(L·h),定时测定发酵液的酶活和酵母菌体湿重.
1.2.5 重组碱性蛋白酶的纯化
将发酵上清液置于截留分子质量为6000~8000u的透析袋中,将透析袋置于饱和的PEG 10000水溶液中,4℃静置至发酵液浓缩至原来体积的30%左右.将浓缩后的发酵液pH值调至7.4~8.0后,首先用Ni柱对重组蛋白酶进行亲和层析,层析过程中利用缓冲液A(20mmol/L磷酸钠、0.5mol/L氯化钠、20~40mmol/L咪唑,pH=7.4)和缓冲液 B(20 mmol/L磷酸钠、0.5 mol/L 氯化钠、0.5 mol/L 咪唑,pH=7.4)对Ni柱进行梯度洗脱,收集洗脱液.接着,用超滤离心管浓缩洗脱液,然后加样于SephadexTMG-75凝胶柱中,采用0.05mol/L磷酸缓冲液洗脱,收集主要蛋白峰的洗脱液,再用超滤离心管浓缩收集,得到纯化的蛋白酶溶液,保存备用.
1.2.6 重组碱性蛋白酶的酶谱试验
参考Till等[11]的方法进行酶谱试验.在酶谱试验中,采用12.0%(质量分数)的分离胶(分离胶中含有0.3%酪蛋白)和5.0%(质量分数)的浓缩胶.蛋白酶样品与上样缓冲液混合后直接上样,4℃电泳.电泳后用超纯水浸洗凝胶两次,然后置于0.05mol/L甘氨酸-NaOH(pH 值为 10.0)缓冲液中,40℃酶解30min.采用考马斯亮蓝R-250染色的方法对酶解后的凝胶进行染色及脱色.
1.2.7 pH值和温度对重组碱性蛋白酶活性及稳定性的影响
将纯化的重组碱性蛋白酶置于0.02 mol/L pH缓冲液中(乙酸缓冲盐pH值为3.0~5.0,磷酸缓冲盐 pH 值为6.0 ~7.0,Tris-HCl pH 值为 8.0 ~9.0,硼砂-氢氧化钠pH值为9.0~11.0),然后分别测定其酶活,以确定最适反应pH值.将酶液置于不同的缓冲液中,25℃静置1 h,然后于pH=10.0条件下测定其酶活,考察不同pH值对酶稳定性的影响.
在不同的温度(40~70℃)下进行重组碱性蛋白酶的酶活测定,以此确定其最适反应温度.并在其稳定的pH条件下,将酶液分别置于不同温度中保温10、20、40、60、80 和 120 min,然后测定不同温度处理后余下的酶活,以考察温度对重组碱性蛋白酶稳定性的影响.
1.2.8 重组碱性蛋白酶对牛胰岛素氧化B链的水解试验
参考Bakhtiar等[12]的方法,取牛胰岛素氧化B链100μg溶解于1mL 0.02 mol/L(pH 值为9.0)乙醇胺-盐酸缓冲液中,加入一定量酶液(约30U),混合后放置于40℃水浴中酶解1h,沸水浴5min灭酶活.利用质谱鉴定在胰岛素B链上的酶切位点.
1.2.9 重组碱性蛋白酶对大豆蛋白和花生蛋白的水解试验
大豆蛋白和花生蛋白的水解试验参考潘进权等[13]的方法,分别用 pH 值为8.0 的0.05mol/L 磷酸盐缓冲液配制5%(质量分数)的大豆分离蛋白和花生分离蛋白,然后在沸水浴中热处理15 min.冷却后加入酶,50℃酶解4 h,将酶解液在4000r/min下离心10min,取上清液,采用甲醛滴定法测定其水解度.采用相同的水解试验方法分别测定木瓜蛋白酶和Alcalase碱性蛋白酶对大豆分离蛋白和花生分离蛋白的水解效率.
2 结果与分析
2.1 碱性蛋白酶基因的克隆和表达载体的构建结果
通过提取米曲霉的总RNA,反转录为cDNA,利用P1和P2引物进行PCR扩增出目的条带;将PCR产物与克隆载体相连接,转化至大肠杆菌中,挑取阳性克隆测序.测序结果表明克隆的碱性蛋白酶(Alp)基因序列与Genbank数据库中报道序列(登录号:XM_001820092)完全一致,未见任何突变.
以P3和P4为引物扩增的PCR产物经过酶切克隆至表达载体pPIC9K上,再分别以AOX引物(5'AOX:5'GACTGGTTCCAATTGACAAGC3'和3'AOX:5'GGCAAATGGCATTCTGACATCC3')和 P3、P4 引物进行菌落PCR,筛选出阳性克隆,测序结果表明重组质粒pPIC9K/Alp构建成功,其示意图见图1.
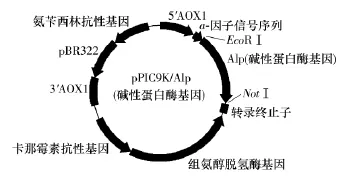
图1 重组表达质粒pPIC9K/Alp的构建示意图Fig.1 Sketch of construction of recombinant expression plasmid pPIC9K/Alp
2.2 重组酵母的筛选和鉴定结果
将限制性内切酶Sac I线性化后的重组表达质粒pPIC9K/Alp电转至毕赤酵母KM71中,挑取在MD培养基上生长出的单菌落,利用G418抗生素筛选出高拷贝菌株;然后对其培养,提取基因组,以P3和P4引物进行PCR,扩增出目的条带(见图2).图2表明米曲霉碱性蛋白酶基因已成功整合至酵母基因组中.

图2 酵母转化子的PCR鉴定结果Fig.2 PCR identification of yeast transformants M—DNA 标准物,DL1000;1,2—PCR 产物
2.3 重组酵母在三角瓶和发酵罐中的诱导表达结果
外源基因在毕赤酵母中表达的优点在于重组蛋白表达量大,分泌至胞外直接进入发酵液,便于分离纯化.本试验的重组酵母菌株在三角瓶和发酵罐中诱导表达时,其发酵液在SDS-PAGE凝胶电泳图谱的35ku处均有一明显的蛋白条带(见图3(a)).采用Invitrogen公司的InVisionTMHis-tag In-gel Stain试剂对发酵液的SDS-PAGE凝胶染色曝光,明显可见在考马斯亮蓝染色的35 ku处具有一白斑(见图3(b)).该试剂只能与带有组氨酸标签的蛋白结合,在紫外线的照射下激发产生荧光,形成可见的白斑.在构建重组表达质粒时,在碱性蛋白酶的C端设计增加了6个组氨酸标签,该重组蛋白酶在紫外线照射下可形成白斑.根据核苷酸序列推导的重组碱性蛋白酶的分子质量接近35ku;而对于整合了未带外源基因的空表达载体pPIC9K的KM71菌株而言,其发酵液在SDS-PAGE电泳图谱的35 ku处未见明显的蛋白条带(见图3(a)).此结果表明重组碱性蛋白酶在KM71中表达成功,电泳图谱上的35ku处的蛋白条带是重组碱性蛋白酶条带.
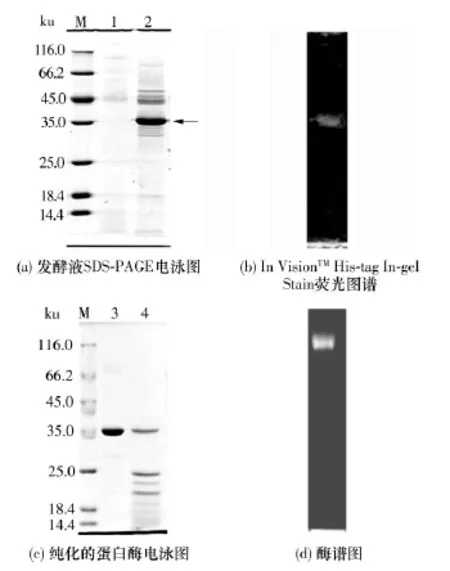
图3 重组碱性蛋白酶的电泳图谱Fig.3 Electrophoretic patterns of recombinant alkaline protease
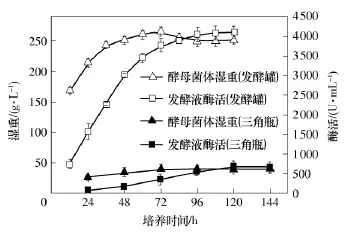
图4 重组酵母菌产酶及生长曲线图Fig.4 Curves of protease activities and growth versus time for recombinant P.pastoris strain
重组酵母菌产酶及生长曲线如图4所示.由图4可知,在三角瓶中诱导表达时,诱导至96h后酵母菌湿重达到最高(约45g/L),然后基本保持稳定;诱导至120h时,发酵液的酶活最高(700U/mL).在发酵罐中诱导表达时,酵母菌菌体湿重可达约250g/L,显著高于三角瓶中的湿重,诱导至108 h时,发酵液酶活达到4100 U/mL,显著高于三角瓶中发酵液的酶活.酵母菌是好氧微生物,特别是在高密度发酵生长时耗氧量更大;由于发酵罐具备供氧和搅拌装置,这为酵母菌的高密度生长提供了条件,因此发酵罐中的菌体浓度高于三角瓶.重组碱性蛋白酶是重组酵母菌自身分泌的胞外蛋白,酵母菌菌体越多,分泌的蛋白酶量越大,因此发酵罐中发酵液的酶活高于三角瓶中发酵液的酶活.工业上通常以麦麸或稻麸等作为培养基原料,采用固体发酵米曲霉生产碱性蛋白酶.固体发酵产酶量一般最高能达到1200U/g[6],而且发酵场所大,存在易污染、菌体生长难控制、产生酶种类多且不便于分离纯化等不足[7],因此,采用基因工程手段,构建重组菌株进行液体发酵来生产重组米曲霉碱性蛋白酶是一种较佳的途径.
2.4 重组碱性蛋白酶的纯化及酶谱试验结果
重组碱性蛋白酶仅需要几种纯化方式相结合就能从发酵液中得到纯化.首先,将发酵上清液置于饱和的PEG 10000水溶液中透析,这主要是对重组碱性蛋白酶进行浓缩以及降低发酵液的黏度,从而为层析做准备.接着,通过Ni柱层析将重组蛋白酶吸附于Ni柱上,而其他大部分杂蛋白通过穿过液被分离掉;然后,对Ni柱进行梯度洗脱,洗脱液中缓冲液B含量为30%时,重组碱性蛋白酶含量最高;最后,利用SephadexTMG-75凝胶层析柱的分子筛排阻效应,对不同分子质量的蛋白进行分离,得到纯化的重组碱性蛋白酶.采用SDS-PAGE电泳图谱对分离纯化的样品纯度进行比较分析(见图3(c)),发现经凝胶层析后,纯化的蛋白酶在SDS-PAGE电泳图谱中仅具有单一条带,表明该酶已经纯化至电泳纯.
将纯化后的重组碱性蛋白酶进行酶谱试验,电泳图谱上清晰地显示一条透明的水解条带(见图3(d)),这进一步表明分离纯化得到的蛋白是重组碱性蛋白酶.该条带比SDS-PAGE电泳中的条带靠后,主要是由于上样缓冲液和凝胶中均未加SDS以及未对重组碱性蛋白酶进行煮沸的变性处理过程,这使得该酶的表面带电荷较少以及空间结构未发生较大改变,因此其电泳速率较慢,水解条带靠后.
2.5 不同pH值和温度下重组碱性蛋白酶的活性和稳定性
图5给出了pH值对重组碱性蛋白酶活性及稳定性的影响.由图5结果可知:重组碱性蛋白酶的最适反应pH值为8.5~9.5;重组碱性蛋白酶经pH值为6.0~10.0的缓冲液处理后,pH值对其酶活影响不显著,这表明该酶具有较好的pH稳定性;当pH值高于10.0或者低于5.0后,酶稳定性明显下降.
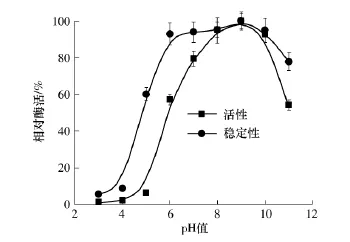
图5 pH值对重组碱性蛋白酶活性及稳定性的影响Fig.5 Effects of pH value on activity and stability of recombinant alkaline protease
图6所示为温度对重组碱性蛋白酶活性和稳定性的影响.由图6(a)可知,重组碱性蛋白酶的最适反应温度为50℃.由图6(b)可见,该酶在低于40℃的条件下具有良好的稳定性,当超过45℃时,该酶会缓慢失活,一旦温度超过55℃则极不稳定,放置20min后活性几乎完全丧失.
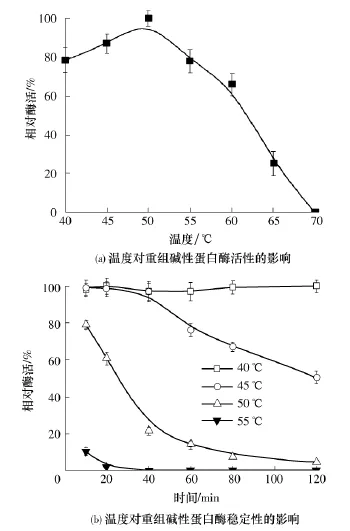
图6 温度对重组碱性蛋白酶活性和稳定性的影响Fig.6 Effects of temperature on activity and stability of recombinant alkaline protease
2.6 重组碱性蛋白酶对牛胰岛素氧化B链的水解作用
图7给出了重组碱性蛋白酶Alp在胰岛素B链上的切割位点.由图7可知,重组碱性蛋白酶对牛胰岛素氧化B链有8个酶切位点,且均比商业化的3种同家族酶(Subtilisin Novo[12],Subtilisin BPN'[12]和枯草杆菌蛋白酶[14])的酶切位点多.对酶切位点而言,除了在之间有共同的酶切位点,其余酶切位点均不相同.根据Tanford报道的氨基酸残基的疏水度值计算,发现不同酶切位点末端氨基酸残基的疏水度小于3种商品化酶的疏水度[15],而疏水度越大的氨基酸出现于肽端时,对该多肽的苦味贡献越大[16].这表明了重组碱性蛋白酶广泛的肽键选择和脱苦作用.
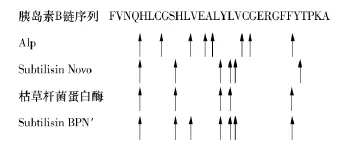
图7 重组碱性蛋白酶Alp在胰岛素B链上的切割位点Fig.7 Cleavage points of recombinant alkaline protease on oxidized insulin B-chain
2.7 重组碱性蛋白酶对大豆蛋白和花生蛋白的水解试验结果
不同蛋白酶对大豆蛋白和花生蛋白的水解结果如表1所示.由表1可知,重组碱性蛋白酶对大豆蛋白和花生蛋白的水解程度均高于木瓜蛋白酶,而对花生蛋白的水解程度均高于两种商业用酶,这表明重组碱性蛋白酶在实际工业生产中具有较大的开发利用价值.
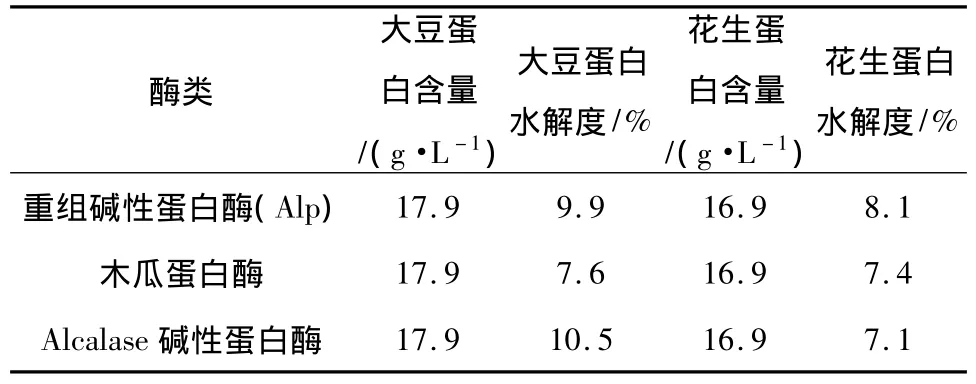
表1 不同蛋白酶对大豆蛋白和花生蛋白的水解结果Table 1 Hydrolysis results of different proteases to soy protein and peanut protein
3 结语
文中探讨了米曲霉碱性蛋白酶基因的克隆,并将其在毕赤酵母KM71中成功诱导表达,对表达的蛋白分离纯化,并对其酶学性质以及其对大豆和花生蛋白水解特性进行了初步研究.以往文献发现,对于霉菌产生蛋白酶而言,固体发酵产生的酶量高于液体发酵;对于米曲霉而言,固体发酵产酶量一般最高能达到1200U/g,在本试验中,重组碱性蛋白酶在10L发酵罐中的发酵液酶活达到4100 U/mL,这表明该重组碱性蛋白酶的表达量高于米曲霉中的表达量;并且该重组蛋白酶直接分泌至发酵液中,利于该酶的分离和纯化.该酶具有较宽泛的pH稳定性和较高的热稳定性,对大豆蛋白和花生蛋白的水解能力比商业化木瓜蛋白酶强,对花生蛋白的水解能力比Alcalase碱性蛋白酶强.以上结果显示该重组碱性蛋白酶在工业生产中具有较大的开发潜力.
[1]Sumantha Alagarsamy,Larroche Christian,Pandey Ashok.Microbiology and industrial biotechnology of food-grade proteases:a perspective[J].Food Technology and Biotechnology,2006,44(2):211-220.
[2]Tunga Rashbehari,Shrivastava Binita,Banerjee Rintu.Purification and characterization of a protease from solid state cultures of Aspergillus parasiticus[J].Process Biochemistry,2003,38(11):1553-1558.
[3]Yoon Jaewoo,Maruyama Jun-ichi,Kitamoto Katsuhiko.Disruption of ten protease genes in the filamentous fungus Aspergillus oryzae highly improves production of heterologous proteins[J].Applied Microbiology and Biotechnology,2011,89(3):747-759.
[4]Nakadai T,Nasuno S,Iguchi N.The action of peptidases from A.oryzae in digestion of soybean proteins[J].Agricultural and Biological Chemistry,1972,36(2):261-268.
[5]葛向阳,田焕章,梁运祥.酿造学[M].北京:高等教育出版社,2005:113-153.
[6]Chutmanop Jarun,Chuichulcherm Sinsupha,Chisti Yusuf,et al.Protease production by Aspergillus oryzae in solidstate fermentation using agroindustrial substrates[J].Journal of Chemical Technology and Biotechnology,2008,83(7):1012-1018.
[7]Wang Ruohang,Law Rocky Chau Sing,Webb Colin.Protease production and conidiation by Aspergillus oryzae in flour fermentation [J].Process Biochemistry,2005,40(1):217-227.
[8]Li A N,Li D C.Cloning,expression and characterization of the serine protease gen from Chaetomium thermophilum [J].Journal of Applied Microbiology,2009,106(2):369-380.
[9]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,译.3版.北京:科学出版社,2005:485-487.
[10]张树政.酶制剂工业[M].北京:科学出版社,1984:446-447.
[11]Till Olaf,Banmann Eckehard,Linss Werner.Zymography with caseogram prints:quantification of pepsinogen [J].Analytical Biochemistry,2001,292(1):22-25.
[12]Bakhtiar Shahrzad,Estiveira Rui Jose,Hatti-Kaul Rajni.Substrate specificity of alkaline protease from alkaliphilic feather-degrading Nesterenkonia sp.AL20 [J].Enzyme and Microbial Technology,2005,37(5):534-540.
[13]潘进权,罗晓春,谢明权.雅致放射毛霉AS3.2778碱性蛋白酶的纯化及水解特性[J].华南理工大学学报:自然科学版,2008,36(12):106-111.Pan Jin-quan,Luo Xiao-chun,Xie Ming-quan.Purification and hydrolysis characteristics of alkaline protease from Actinomucor elegans AS3.2778 [J].Journal of South China University of Technology:Natural Science Edition,2008,36(12):106-111.
[14]Robert Beynon,Judith S Bond.Proteolytoc enzymes:a practical approach[M].2nd ed.New York:Oxford University Press,2001:97-99.
[15]Tanford Charles.Contribution of hydrophobic interactions to the stability of the globular conformation of proteins[J].Journal of the American Chemical Society,1962,84(22):4240-4247.
[16]Ishibashi Norio,Ono Ichiro,Kato Kuniki,et al.Role of the hydrophobic amino acid residue in the bitterness of peptides[J].Agricultural and Biological Chemistry,1988,52(1):91-94.
