垃圾渗滤液的微波增效GAC载铁催化Fenton氧化处理*
2012-06-25丁湛关卫省
丁湛 关卫省
(长安大学环境科学与工程学院,陕西西安710054)
垃圾渗滤液是一种危害较大的高浓度有机废水,不仅污染物成分复杂,而且其污染强度和污染特征还随填埋时间而变化[1-4].随垃圾填埋场服役时间的延长,垃圾渗滤液趋于老龄化,其水质特征也在变化,处理难度加大[3-5].目前,对垃圾渗滤液的处理方法主要有生物处理技术[6-8]、土地处理技术[9]、高级氧化技术等[10-12].生物处理运行成本较低,是目前垃圾渗滤液处理中采用较多的方法,但对于污染物浓度较高、成分复杂且含有重金属离子、可生化性较差的渗滤液,其处理效果较差;土地处理法简便经济,缓冲容量大,适合于土地广阔的地区,但该法会导致重金属、盐类在土壤中积累及饱和,易对土壤和地下水造成污染,过量的盐类也会对植物的生长产生影响;高级氧化法对于垃圾渗滤液等难降解有机废水是一种有效的处理方式.Fenton氧化法属于高级氧化法的一种,它具有氧化剂与催化剂来源广且便宜无毒、均相传质、操作简便等优势[13],主要包括普通Fenton法、光Fenton法和电Fenton法.目前普通Fenton法在垃圾渗滤液处理中的应用较多,但其处理效果一般,且反应时间较长[14-15].
微波对极性分子产生的热效应和非热效应可以降低反应的活化能,增强化学反应效果[16].许多研究者[17-19]开展了微波条件下垃圾渗滤液的Fenton高级氧化处理技术研究,但对于处理条件和微波反应动力学特性仍需进一步研究.文中选择既可以吸附污染物又可以吸收微波的颗粒活性炭(GAC)作为Fe2+的载体,在微波作用下催化H2O2产生·OH,并构成非均相催化氧化体系,对垃圾渗滤液进行高级氧化处理,分析Fe2+负载量、GAC用量、微波处理时间、微波处理功率、H2O2用量以及处理液pH值对垃圾渗滤液Fenton氧化处理效果的影响,选择处理条件,并进行处理动力学探讨.
1 材料与方法
1.1 垃圾渗滤液
实验用垃圾渗滤液取自西安市江村沟垃圾填埋场渗滤液处理厂集液池原液,呈深黑色,有明显的恶臭味,其 COD为20000~40000 mg/L,NH3-N约为1000mg/L,pH 值为8 ~9,且 BOD5/COD≈0.15,可生化性差,不宜采用生物法进行处理.江村沟垃圾填埋场作为西安市唯一的生活垃圾处理场,承担着全市3300t/d的生活垃圾填埋任务,使用年限已超过10年,产生的渗滤液成分复杂、有机物浓度高、污染强度大且水质波动较大,属于老龄填埋场渗滤液,目前渗滤液产生量超过了500t/d.
1.2 负载Fe2+颗粒活性炭的制备
将颗粒活性炭过20目筛,依次用蒸馏水、0.10mol/L的硝酸清洗以去除表面的杂质,接着水洗至中性,然后在373K下烘干12 h.称取20 g GAC分别浸渍于 0.10、0.15、0.20、0.25、0.30、0.35、0.40mol/L的 FeSO4溶液(100 mL)中,置于振荡器上,在室温下密闭振荡24 h,取出于室温下风干,即得负载 Fe2+的 GAC.负载前 FeSO4.7H2O溶液的Fe2+含量减去进行24 h GAC负载后溶液中Fe2+的含量即为GAC上Fe2+的负载量.
1.3 实验方法
实验反应器皿选用250mL的锥形瓶,所用微波设备为MAS-III型微波处理器.每次取实验水样100mL于6组锥形瓶中,用稀硫酸调 pH值,加30%H2O2及负载Fe2+GAC.试剂添加完后以保鲜膜封住,由于反应产生气体较多,所以在膜上扎几个针孔以防微波处理时产生过多气体而造成危险.然后于微波处理器中进行不同时间的微波反应.反应完毕冷却后取上清液进行指标测定.COD、NH3-N指标的测定方法分别为重铬酸钾氧化法(GB 11914—89)和纳氏试剂比色法(GB 7479—87).
对于Fenton反应,Fe2+负载量、H2O2用量以及处理液pH值为Fenton氧化的主要影响因素;GAC用量、微波处理时间及功率主要影响微波作用效果,同时参考文献[17]中笔者开展的正交试验结果确定了各影响因素的工艺条件范围,文中基于此选取了工艺条件,如表1所示.

表1 实验条件Table 1 Test conditions
1.4 垃圾渗滤液COD和NH3-N去除率的计算
采用COD和NH3-N的去除率分析垃圾渗滤液在不同处理条件下的氧化效果,去除率计算如下:
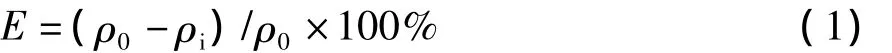
式中:E为COD或NH3-N的去除率,%;ρ0为处理前水样COD或NH3-N质量浓度,mg/L;ρi为处理后水样COD或NH3-N质量浓度,mg/L.
2 实验结果与讨论
2.1 Fe2+负载量的影响
Fe2+可以与H2O2反应生成具有强氧化性的·OH,氧化各种有毒和难降解的有机化合物,从而达到去除污染物的目的[13-16].根据表1中1#的处理条件,不同Fe2+负载量对各指标去除率的影响如图1所示.
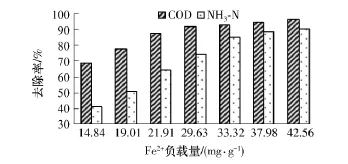
图1 COD和NH3-N去除率随Fe2+负载量的变化Fig.1 Variation of removals of COD and NH3-N with Fe2+loading amount
由图1可见,随着Fe2+负载量的增加,COD和NH3-N去除率均逐渐提高,这是因为当Fe2+负载量较低时,·OH的产率较低,氧化作用受到限制,有机污染物降解为酸,甚至未发生降解,而且溶液的pH值无法达到Fe2+发挥絮凝作用的要求,COD和NH3-N的去除率均较小;随着Fe2+负载量的增加,其催化作用与絮凝作用均逐渐增强.但当Fe2+的负载量达到29.63mg/g后,其对去除率增幅的影响逐渐减小;Fe2+负载量达到33.32 mg/g以后去除率增幅几乎不变,此时COD去除率高达93.01%,NH3-N去除率为85.76%,说明此负载量条件下Fe2+催化H2O2的能力已基本达到最佳,或H2O2基本消耗殆尽,Fe2+负载量再继续增加时对反应的影响较小.由于COD去除率主要受催化氧化作用影响,而NH3-N去除率主要受絮凝作用影响[17],NH3-N去除率总体小于COD去除率.
2.2 载Fe2+GAC用量的影响
GAC是Fe2+的载体,同时增加了渗滤液中污染物的氧化界面.在反应过程中,GAC上负载的Fe2+逐渐进入溶液催化H2O2产生·OH,氧化污染物.对于Fe2+负载量相同的GAC而言,GAC的用量决定Fe2+的用量,分别向 100 mL 水样中添加 0.5、1.0、2.0、3.0 g 的 GAC,即 Fe2+的用量分别为 7.42、14.84、29.68、44.52mg,同时对比相同 Fe2+用量、不加GAC的渗滤液水样的NH3-N及COD去除效果.根据表1中2#实验条件,GAC用量对两种污染物去除率的影响如图2所示.

图2 COD和NH3-N去除率随GAC及Fe2+用量的变化Fig.2 Variation of removals of COD and NH3-N with GAC and Fe2+dosage
对于相同的Fe2+用量,添加GAC可以显著提高COD及NH3-N的去除率.反应过程中负载于GAC上的Fe2+逐渐被释放,这样不会造成前期铁离子过量或铁离子无效作用等问题;释放了铁离子的GAC同时进一步吸附溶液中的污染物,被吸附在GAC表面的污染物继续被·OH氧化,由于GAC比表面积较大,所以可大大增加污染物被氧化的界面,同时由于GAC对微波能量的吸收,加快了污染物的氧化速度.可见GAC对微波能量的吸收以及对污染物的吸附作用可以增强垃圾渗滤液的处理效果.随着GAC用量的增加,COD及NH3-N的去除率都不断增大,可见Fe2+用量仍是最主要的影响因素,当GAC量较少时,Fe2+用量较低,催化与絮凝作用均较差,而且吸附作用对COD及NH3-N的去除率影响不显著.随着GAC用量的增加,GAC吸收微波及吸附污染物的能力都逐渐增强,COD去除率越来越高,但对NH3-N的去除率影响相对较小,说明NH3-N的去除率主要受Fe2+的影响.
不同GAC用量、相同Fe2+负载量与相同GAC用量、不同Fe2+负载量(达到相似Fe2+用量)时NH3-N、COD去除率的比较如表2所示.
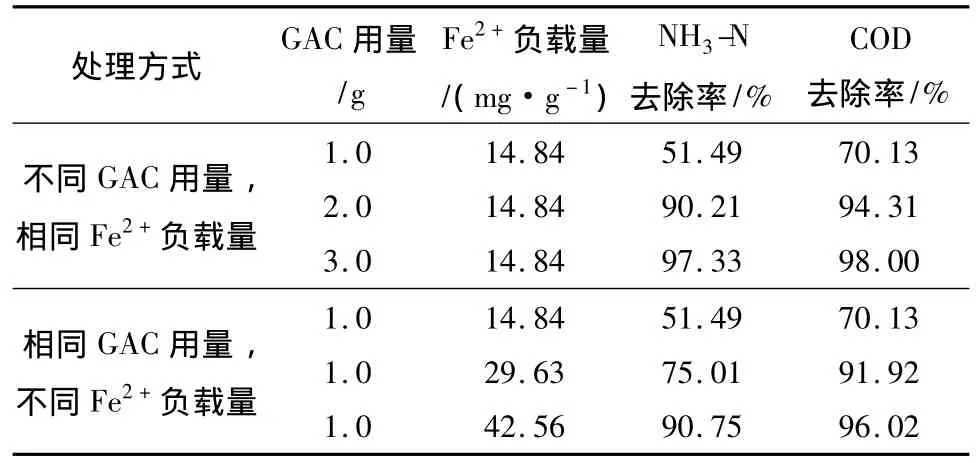
表2 不同GAC用量及Fe2+负载量处理效果的比较Table 2 Treatment effect comparison for different GAC dosages and Fe2+loading amounts
当Fe2+用量相同时,增加GAC用量,NH3-N和COD的去除率都有所增大,但两种污染物的增大幅度并不相同,其中COD的去除率差异较小,说明催化氧化作用是COD去除的主要机理,Fe2+用量对其起决定作用;而NH3-N去除率除氧化作用外,主要受絮凝作用影响,GAC用量增加后,Fe2+的总量随之增加,Fe2+进入溶液后首先与 H2O2反应产生·OH,·OH对污染物氧化反应的进行使得溶液中的H+不断被消耗,溶液pH值升高而生成Fe(OH)2、Fe(OH)3及 Fe(OH)2+、Fe(OH)+2等络离子,絮凝作用显著,且由于GAC用量增加后,吸附作用显著增强,所以NH3-N去除率大幅增加.
2.3 微波处理时间的影响
微波不仅具有加热作用,而且可以与Fe2+一起对H2O2产生协同催化作用,促进氧化反应进行[17-19].根据表1中3#实验条件,不同微波处理时间的COD和NH3-N去除率如图3所示.文中同时进行了不使用微波、其他实验条件相同的30min处理实验,此时COD与NH3-N的去除率均较低,分别为8.09%和10.15%.

图3 COD和NH3-N去除率随微波处理时间的变化Fig.3 Variation of removals of COD and NH3-N with microwave treatment time
由图3可知,随着微波处理时间的延长,COD去除率逐渐增大,30min时几乎达到最大,此后增幅较小.可见微波对·OH的产生具有催化作用,同时GAC对微波具有较强的吸收能力,使COD去除率逐渐增加.但当处理时间超过30min时,氧化剂及有机污染物浓度不断降低,氧化速度减缓,COD去除率的增幅减小.
NH3-N去除率的增加幅度开始较平缓,20min后增幅加大.这是因为在微波增效作用下,初始阶段所发生的氧化反应主要是将含N元素的污染物氧化或分解,转变了N元素的存在状态,随着反应的进行,溶液pH值升高,使得Fe2+絮凝作用增强,NH3-N的去除率大幅增加.但60min后溶液中的大部分反应已基本达到平衡,NH3-N的去除率变化不再显著.
2.4 微波处理功率的影响
微波功率决定着微波能量的释放,在很大程度上影响渗滤液的处理效果.根据表1中4#实验条件,不同微波处理功率的COD和NH3-N去除率如图4所示.

图4 微波处理功率对COD和NH3-N去除率的影响Fig.4 Effect of microwave power on removals of COD and NH3-N
反应的发生需要吸收足够能量以克服反应能峰,在该体系中诱发氧化反应发生的主要能量来源是微波的辐射能,而微波输出功率是辐射能大小的决定因素.由图4可知,COD去除率在180~360 W的区间内增幅较大,NH3-N去除率在180~540W的区间内增幅较大,但在540~1080 W区间去除率增幅均较小,即当输出功率达到360 W时即可激发反应,但从NH3-N去除率始终小于COD去除率可知,氧化反应对COD去除率影响较大.由于NH3-N去除率主要受絮凝作用影响,随着微波能量继续增大,渗滤液中稳定的胶体结构被破坏,有助于污染物的絮凝沉淀,因此在360~540 W区间内,相对于COD去除率,NH3-N去除率的增幅更大.
2.5 H2O2用量的影响
Fenton氧化法是由Fe2+催化H2O2产生·OH,进而由·OH进攻有机物分子达到氧化降解的目的.根据表1中5#实验条件,不同 H2O2用量下的COD和NH3-N去除率如图5所示.
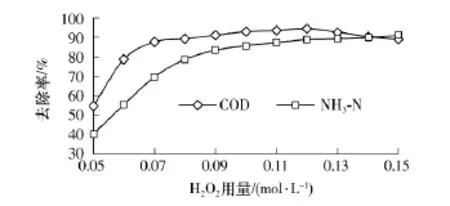
图5 H2O2用量对COD和NH3-N去除率的影响Fig.5 Effect of H2O2dosage on removals of COD and NH3-N
开始阶段,COD去除率随H2O2用量的增加而增大,当用量达0.07mol/L时增加幅度明显减小,当用量达到0.13mol/L后开始呈现下降趋势.而NH3-N去除率随H2O2用量的增加总体呈增大趋势,当用量达到0.08mol/L时增加幅度开始减小.这是因为H2O2用量较小时其主要作用是生成·OH氧化有机污染物,·OH的氧化能力较强,所以在 H2O2用量为0.05~0.08mol/L时,对指标因子去除率的影响作用较大,即去除率增幅明显;当H2O2用量继续增加到0.09mol/L以后,体系内的氧化作用来源于·OH及H2O2自身对某些有机物的氧化,但由于H2O2的氧化作用明显小于·OH,因此在该H2O2用量范围内(实验中表现为0.08~0.12 mol/L),对指标因子去除率的相对影响减小,即去除率增幅较小.
当H2O2用量达到0.13mol/L时,COD去除率出现了下降趋势,这主要是因为当H2O2过量时,产生·OH的速度较快,瞬间过量的·OH未来得及与渗滤液中有机物发生反应,就与H2O2发生了相互之间的副反应,且过多的H2O2在高温条件下易分解生成H2O和O2,成为无效的投加.可见该体系内氧化作用对COD去除率的影响要大于对NH3-N去除率的影响.
2.6 处理液pH值的影响
由于pH≥8时,Fe2+几乎全部以胶体或絮体沉淀形式存在,因此实验中pH值定为1~8.根据表1中6#实验条件,pH值对COD和NH3-N去除率的影响如图6所示.

图6 初始pH值对COD和NH3-N去除率的影响Fig.6 Effect of initial pH value on removals of COD and NH3-N
COD去除率随pH值的增加呈先增后降的趋势,而NH3-N去除率随pH值增加基本呈总体增加的趋势.在pH值为1~4时,COD和NH3-N去除率基本都呈增加趋势,可见此pH值范围是渗滤液处理的较好条件.当初始pH值继续增大时,Fe2+在氧化反应未发生时便已发生絮凝,这使其催化效果大大减弱,因此COD去除率降低,但对NH3-N去除率的影响较小;当pH值升到8时,COD去除率已降到43.56%,此时COD的去除主要是靠絮凝作用,而Fe2+无法发挥催化作用时,微波对氧化反应的催化效果很难得到发挥,可见H2O2被催化产生·OH依赖于Fe2+与微波的协同作用.
综合以上实验结果,最终选定实验的最佳处理条件为:初始pH=3、GAC用量10g/L、GAC的Fe2+负载量33.32mg/g、微波处理功率720W、微波处理时间30min、30%H2O2用量0.1mol/L.在此处理条件下,COD去除率为93.01%,NH3-N去除率为85.76%,处理后水样的pH值约为7.
3 处理前后垃圾渗滤液的微观分析
将处理后水样进行气相色谱分析,并与渗滤液原液的气相色谱进行对比.15 min左右处的色谱峰为丁酸或辛酸的特征峰、18、22、25 min左右处的色谱峰分别为苯酚、吲哚、多环芳烃特征峰.由图7可知,进行氧化处理后的垃圾渗滤液色谱图在15、18、22min附近的色谱峰基本消失,仅在25 min附近出现了一个相对较小的特征峰,可见经过微波条件下的氧化处理后垃圾渗滤液中大部分有机污染物已被降解去除,只存在少量的多环芳烃类有机物.垃圾渗滤液原液谱图在25min附近的峰是混合有机相的四重组合峰,而处理后溶液的谱图在此处只是一个单一的较弱特征峰,说明经过处理后溶液组分已较单一,各类多环芳烃都已被降解为结构相似的化合物,处理效果非常显著.
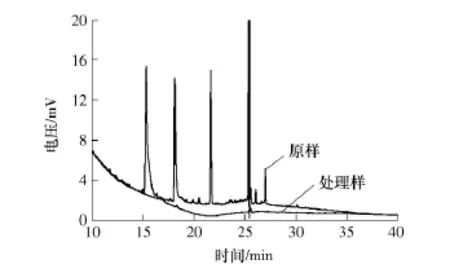
图7 渗滤液处理前后有机物特征峰对比Fig.7 Characteristic peaks contrast of organic pollutants in leachate before and after treatment
4 微波Fenton氧化反应的动力学探讨
以微波增效负载Fe2+的GAC协同催化H2O2产生·OH,对垃圾渗滤液中的污染物进行氧化降解,该反应是由羟基自由基·OH引发的链反应,而·OH又是由微波协同负载Fe2+的GAC催化产生的,整个反应过程属于复杂反应,包括链引发、链增长、链终止反应.由于·OH的寿命很短,仅有10 μs的平均寿命,即可以表达为

式中:C·OH为·OH的浓度;t为反应时间.
以与Fenton氧化反应关联度最大的影响因素——GAC上Fe2+的负载量为主要因子,建立微波条件下负载Fe2+GAC的高级氧化反应动力学模型:

式中:k为模型因子;C为溶液的COD浓度;C'为GAC上Fe2+的负载量;m、n均为反应级数.
采用垃圾渗滤液COD指标因子的变化来表征垃圾渗滤液Fenton氧化处理过程中的降解程度.分别将垃圾渗滤液水样稀释0~8倍,配制不同COD浓度的水样,并分别在选定的实验条件下进行微波Fenton氧化处理,ln(-ΔC/Δt)与 lnC'、ln(-ΔC/Δt)与lnC的回归关系如图8所示.
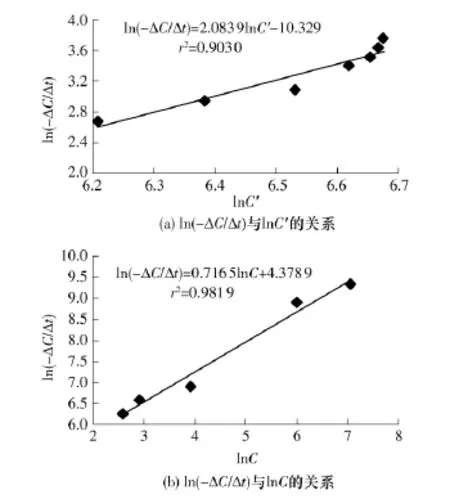
图8 动力学方程参数回归关系Fig.8 Regression relationship of kinetic parameters
由图8 的回归关系可得 m=2.08,n=0.72,代入式(3)可得微波条件下负载Fe2+GAC的高级氧化反应动力学模型为

建立的微波条件下的氧化降解动力学模型不仅有助于进一步寻找最佳反应条件,提高降解效率,而且有助于探明催化氧化反应的机理,同时该动力学方程和有关参数可以为模拟放大实验提供依据.
5 结语
垃圾渗滤液的微波增效GAC负载Fe2+Fenton氧化处理效果影响因素分析表明,最佳处理条件如下:Fe2+负载量为33.32 mg/g、GAC 用量为10 g/L、微波处理功率为720 W、微波处理时间为30 min、30%H2O2用量为 0.1 mol/L,溶液初始 pH=3,此时COD去除率为93.01%、NH3-N去除率为85.76%.处理后垃圾渗滤液中大部分有机污染物已被去除,处理效果较好.文中建立的微波条件下负载Fe2+GAC的高级氧化反应动力学模型可以为进一步寻找最佳反应条件及扩大试验提供参考.然而目前该法的处理费用相对较高,不宜大规模应用,建议与生物法联合或应用在垃圾渗滤液水质可生化性差及排放要求较高的区域.
[1]Inanc B,Call B,Saatci A.Characterization and anaerobic treatment of the sanitary landfill leachate in Istanbul[J].Water Sci Technol,2000,41(3):223-230.
[2]龙腾锐,易洁,林于廉,等.垃圾渗滤液处理难点及其对策研究[J].土木建筑与环境工程,2009,31(1):114-119.Long Teng-rui,Yi Jie,Lin Yu-lian,et al.Treatment difficulties and strategies for landfill leachate[J].Journal of Civil,Architectural & Environmental Engineering,2009,31(1):114-119.
[3]楼紫阳,柴晓利,赵由才,等.生活垃圾填埋场渗滤液性质随时间变化关系研究[J].环境科学学报,2007,27(6):987-992.Lou Zi-yang,Chai Xiao-li,Zhao You-cai,et al.Leachate composition changes over time:data from the Laogang landfill in Shanghai[J].Acta Scientiae Circumstantiae,2007,27(6):987-992.
[4]Kang K H,Shin H S,Parka H.Characterization of humic substances present in landfill leachates with different landfill ages and its implications[J].Water Research,2002,36(16):4023-4032.
[5]杨志泉,周少奇.垃圾渗滤液生物处理重金属的去除效果分析[J].华南理工大学学报:自然科学版,2005,33(6):63-67.Yang Zhi-quan,Zhou Shao-qi.Analysis of the removal of heavy metals in landfill leachate by biological treatment[J].Journal of South China University of Technology:Natural Science Edition,2005,33(6):63-67.
[6]Turan M,Gulsen H,Celik M S.Treatment of landfill leachate by a combined anaerobic fluidized bed and zeolite column system [J].Journal of Environmental Engineering,2005,131(5):815-819.
[7]谢文岳,魏迅.多级深度生化物化(MBP)工艺处理垃圾渗滤液[J].中国给水排水,2006,22(22):52-54.Xie Wen-yue,Wei Xun.Application of multi-stage process to landfill leachate treatment[J].China Water& Wastewater,2006,22(22):52-54.
[8]周少奇,张鸿郭.垃圾渗滤液厌氧氨氧化与反硝化的协同作用[J].华南理工大学学报:自然科学版,2008,36(3):73-76.Zhou Shao-qi,Zhang Hong-guo.Synergistic effect of anaerobic ammonium oxidation and denitrification of landfill leachate[J].Journal of South China University of Technology:Natural Science Edition,2008,36(3):73-76.
[9]Tyrrel S F,Leeds-Harrison P B,Harrison K S.Removal of ammoniac nitrogen from landfill leachate by irrigation onto vegetated treatment planes[J].Water Research,2002,36(1):291-299.
[10]沈小星,陈哲铭,方士.老龄垃圾渗滤液混凝-催化臭氧氧化工艺研究[J].浙江大学学报:农业与生命科学版,2006,32(4):449-454.Shen Xiao-xing,Chen Zhe-ming,Fang Shi.Treatment of stabilized landfill leachate by coagulation-catalytic ozonation processes[J].Journal of Zhejiang University:Agriculture & Life Sciences,2006,32(4):449-454.
[11]Vlyssides A G,Karlis P K,Mahnken G.Influence of various parameters on the electrochemical treatment of landfill leachates[J].Journal of Applied Electrochemistry,2003,33(2):155-159.
[12]Kang Y W,Hwag K Y.Effects of reaction conditions on the oxidation efficiency in the Fenton process[J].Water Research,2000,34(10):2786-2790.
[13]Neyens E,Baeyens J.A review of classic Fenton’s peroxidation as an advanced oxidation technique[J].Journal of Hazardous Materials,2003,98(1/2/3):33-50.
[14]Goi A,Veressinina Y,Trapido M.Fenton process for landfill leachate treatment:evaluation of biodegradability and toxicity[J].Journal of Environmental Engineering,2010,136(1):46-53.
[15]Batarseh E S,Reinhart D R,Daly L.Liquid sodium ferrate and Fenton’s reagent for treatment of mature landfill leachate [J].Journal of Environmental Engineering,2007,133(11):1042-1050.
[16]Gan Q A.Case study of microwave processing of metal hydroxide sediment sludge from printed circuit board manufacturing wash water [J].Waste Management,2000,20(8):695-701.
[17]丁湛,关卫省,刘建,等.微波强化Fenton氧化处理垃圾渗滤液的研究[J].中国给水排水,2010,26(3):90-92.Ding Zhan,Guan Wei-sheng,Liu Jian,et al.Treatment of landfill leachate by microwave enhanced Fenton oxidation[J].China Water & Wastewater,2010,26(3):90-92.
[18]曹俐,李小明,杨麒.微波强化氧化处理垃圾渗滤液工艺研究 [J].环境工程学报,2010,4(3):547-551.Cao Li,Li Xiao-ming,Yang Qi.Study on treatment of landfill leachate by microwave enhanced oxidant process[J].Chinese Journal of Environmental Engineering,2010,4(3):547-551.
[19]王杰,马溪平,唐凤德,等.微波催化氧化法预处理垃圾渗滤液的研究[J].中国环境科学,2011,31(7):1166-1170.Wang Jie,Ma Xi-ping,Tang Feng-de,et al.Study on pretreatment of landfill leachate by microwave-assisted catalytic oxidation process[J].China Environmental Science,2011,31(7):1166-1170.
