AtSDG8启动子区域功能元件的分析
2012-06-14虢婷婷
金 苏,虢婷婷,阮 颖*
(1作物种质资源创新与利用国家重点实验室培育基地,长沙410128;2湖南农业大学生物科学与技术学院,长沙410128)
生物的多样性,是通过基因表达来实现的。研究表明,基因表达的关键阶段之一是转录的起始时期,其中RNA聚合酶与启动子的相互作用至关重要。启动子作为RNA聚合酶特异性识别和结合的DNA序列,是基因的组成部分之一,它控制着基因表达的起始时间和表达程度,对于基因的活动起着“开关”作用。启动子的组成与结构影响它与RNA聚合酶的结合,从而影响基因表达的水平。因此,深入分析基因启动子的功能结构与特性可以全面了解基因的功能。
SDG8(SET DOMAIN GROUP 8)基因编码一种带SET结构域的组蛋白甲基转移酶[1],SDG8(At1g77300)包含有15个外显子,编码的蛋白质含有1 759个氨基酸,是组蛋白甲基化修饰的调节基因[2,3]。SDG8 能催化组蛋白H3 上第36 位赖氨酸发生二、三甲基化[4]。研究表明,拟南芥(Arabidapsis thanilia)SDG8基因的突变可以引起拟南芥特定的表型改变,包括早花[5,6]、植物器官变小、增加茎的分枝[7,8]、类胡萝卜素组成改变[9,10]、生殖能力降低[11]等。sdg8突变体的整体组蛋白二甲基化水平降低了[12,13],使 FLC 基因位点的组蛋白二、三甲基化水平下降,FLC的表达下降,从而导致了拟南芥早花现象[14]。Shen等研究发现,拟南芥SDG8基因可以通过调节茉莉酸和/或乙烯信号转导下游的基因来抵御真菌病原体,如突变体sdg8-1能够促进死体营养型真菌病原体黑斑病、灰葡萄孢菌对植物的侵害[15]。
目前对SDG8基因的表达调控,特别是其启动子功能区域结构如何还鲜有研究。为了进一步了解SDG8基因启动子的结构特征,笔者在拟南芥SDG8基因转录起始位点上游分别克隆了-2 706 bp和-873 bp两个片段,然后将两个片段分别插到GUS报告基因前端[14],并转入模式植物拟南芥基因组中。在拟南芥的遗传背景下剖析SDG8基因启动子的功能结构,以为下一步研究基因的作用与功能打下基础。
1 材料与方法
1.1 材料
拟南芥 Col-0,大肠杆菌,pBI121载体,抗生素,根癌农杆菌GV3101,GUS染色液,均由湖南农业大学植物表观遗传与代谢实验室提供;pMD19-T载体,购自TaKaRa公司;DNA凝胶回收kit,购自安比奥公司;LongAmp Taq DNA Polymerase,购自Bio-Labs公司;PCR Mix,购自康为试剂公司;Trans DNA MarkerⅢ,100 bp plus,购自 Transgene公司。
1.2 方法
1.2.1 SDG8启动子序列分析
利用PLACE数据库分析启动子基序。先通过PLACE数据库对网上公布的SDG8基因上游的启动子区域上的顺式作用元件(基序)进行同源比对分析,再确定启动子区域所包含基序的种类与数量。
1.2.2 表达载体的构建
从SDG8基因ATG往上游,到达另一个基因之间有2 860 bp,根据这段序列,设计引物:F-TCT GGGACAAGAATCAAAGGAGT,R - TCTAGACGTA ATGCTACCTGATTCAAA。PCR扩增产物经回收后,用HindⅢ酶切,得到4个不同长度的启动子片段,2 793 bp,2 706 bp,2 433 bp 和873 bp。取其中长短不同的两个片段(2 706 bp和873 bp)分别插入T载体,构建成SDG8启动子片段与GUS基因相连的中间载体。然后再从中间载体上酶切取目的片段,插入到农杆菌转化载体pBI121上,构建成双元表达载体(图1)。
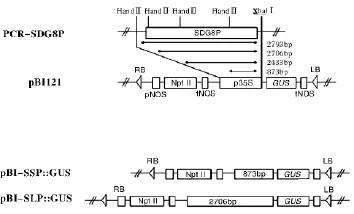
图1 表达载体构建图Fig.1 Construction diagram of expression vector
1.2.3 浸花法转化拟南芥及转化子的筛选
分别用含有长、短启动子片断的农杆菌GV3101菌液浸泡待转化的野生型拟南芥的花序,盖上塑料盖以保持湿度,移入20℃恒温室避光培养,24 h后正常光照培养。约25 d左右,收获种子。将浸花法转化获得的种子在黑暗条件下干燥10 d左右,表面消毒后,涂布在含有50 μg/mL卡那霉素的培养基平板上,每个直径150 mm的平板铺大约1 500颗种子。封口后置于4℃冷室春化2~3 d以打破休眠。移入20℃左右、光照强度为120~150 μmol/m2·t的拟南芥生长室培养,生长7 d后,观察并统计。将存活的抗性苗转移到蛭石中,通过分子检测,最终确定转基因植株。获得的纯合子转基因植株SLP和SSP用于GUS基因的检测。
1.2.4 GUS基因的表达检测
分别将含长(SLP)、短启动子(SSP)片段的转基因拟南芥种子种到蛭石上,20 d后将植株洗净,吸水纸吸干后放入装有GUS染色液的细胞培养板中。置于抽真空仪中,两次抽真空后,37℃染色4 h。70%乙醇脱色,直到绿色全部褪去。GUS染色液为100 mmol/L磷酸钠缓冲液(pH=7.0),内含0.5 mg/mL X -GluC,1%Triton X -100,1%DMSO 和10 mmol/L EDTA。脱色后,观察并分析转基因拟南芥SLP和SSP中GUS基因的表达情况。
2 结果和分析
2.1 SDG8启动子基序分析
将SDG8启动子序列在PLACE网站上比对分析,对SDG8启动子2 706 bp和873 bp的片段的基序(motif)进行统计,结果显示SDG8启动子上包括已知的顺式作用元件有98种。在整个启动子区域,与创伤有关的元件、与光调控有关的元件和组织特异性表达相关元件以及基本功能元件分布其中。各种顺式作用元件在-873 bp片段、-2 706 bp片段以及两个片段之间的具体分布情况如表1。
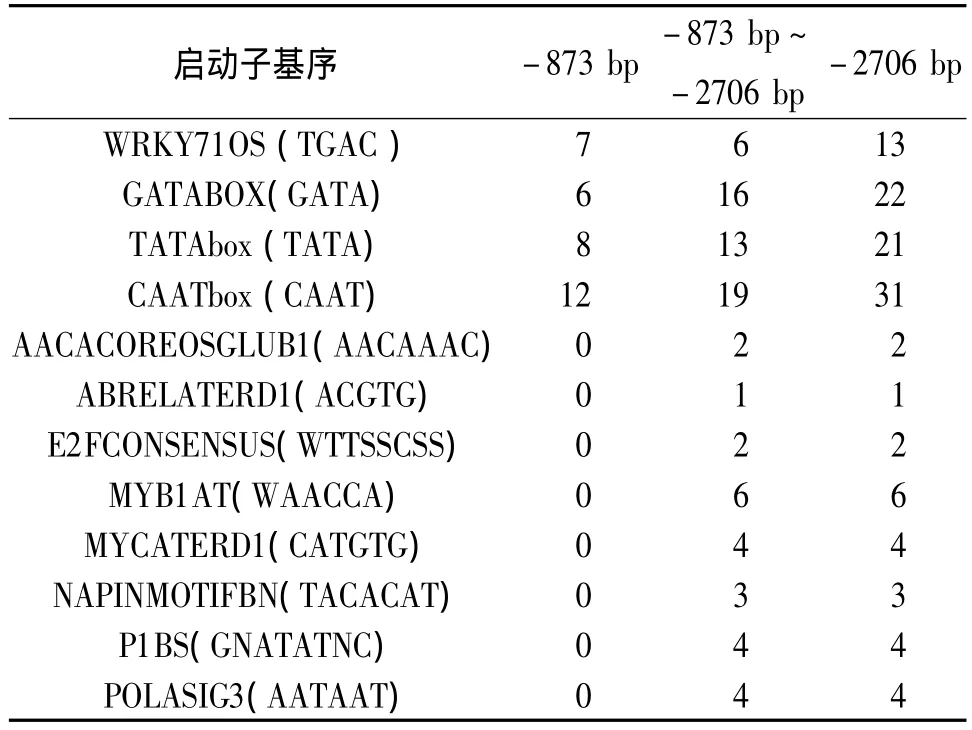
表1 启动子基序分布情况Table 1 The number of promoter motifs
由上表可知,与创伤有关元件WRKY71OS、与光调控有关元件、组织特异性表达相关元件GATABOX(GATA)以及基本功能元件 TATAbox(TATA)和CAATbox(CAAT)在长、短片段中均有分布。其中与创伤有关元件WRKY71OS在-873 bp片段中的分布密度高于-2 706 bp片段,其他元件分布相对均匀。通过进一步比较发现,有些基序仅存在于SDG8长启动子的-873~-2 706 bp片段之间的区域,而短的启动子-873 b p片段上则无分布, 如 AACACOREOSGLUB1,ABRELATERD1,MYB1AT等。
2.2 转基因苗的检测
收集野生型拟南芥浸花转化后的种子,铺在含有卡那霉素的培养基平板上。种子萌发后,观察发现有的幼苗呈绿色,它们能够正常生长,根系生长正常,子叶饱满,叶片伸展;而有些幼苗则矮小发黄,其根相对较短,很少有侧根,子叶发黄萎缩。随后黄化苗逐渐变白,出现水化迹象,最后慢慢死亡。将抗性苗转移到蛭石中,经PCR检测,得到SDG8长启动子转基因阳性株系8株和短启动子的转基因株系11株,并收种子(图2)。
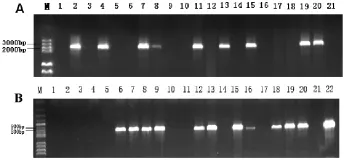
图2 抗性苗的筛选与检测Fig.2 Screening and detection of anti-kanamycin seedings
2.3 转基因植株的GUS表达检测
在不作任何处理的前提下,野生型拟南芥Col-0作为阴性对照没有检测到GUS表达,带有-873 bp启动子片段的SSP植株观察不到明显的蓝色,带有-2 706 bp的SLP植株染色检测有蓝色(图3),即GUS基因可以正常表达,说明 -2 706 bp的SDG8启动子片段能够正常启动SDG8基因的表达。而由于顺式作用元件的缺乏,在-873 bp的SDG8启动子作用下,检测不到GUS基因明显的表达,说明-873 bp不足以启动SDG8基因的表达。根据长、短启动子的基序比较分析,发现AACACOREOS GLUB1(AACAAAC),ABRELATERD1(ACGTG),MYB1AT(WAACCA)等基序仅分布于SDG8长启动子的-873~-2 706 bp之间,短的启动子-873 bp片段上则无分布。推测这些基序可能与SDG8启动子某些特定功能相关,它们的缺乏导致短的启动子的功能受到影响而不能正常启动基因的表达。
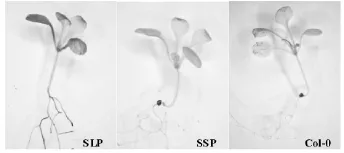
图3 带有长短启动子片段转基因植株SLP和SSP的组织化学GUS染色Fig.3 GUS histochemical staining of SSP and SLP plants
3 小结与讨论
启动子控制着基因表达的起始和表达程度,对于基因的活动起着“开关”作用。为了对SDG8基因的功能结构组成有进一步的认识,本研究首次以SDG8的启动子为研究对象,结合生物信息学的方法,运用启动子缺失分析法,来分析不同片段大小的启动子对于基因表达的启动情况,初步确定SDG8启动子的功能区域。基序分析统计结果表明,-2 706 bp的SDG8启动子片段含有已知的与创伤有关的WRKY71OS基序、与光调控有关和组织特异性表达相关的GATABOX(GATA)基序,以及基本功能基序TATA-box和CAAT-box。但是,到目前为止并不知道那种基序是SDG8基因启动所必须的。通过缺失分析发现,SDG8的-2 706 bp的长启动子片段能启动GUS基因的表达,而在短的-873 bp启动子片段不能启动GUS基因的表达。说明启动SDG8的正常表达需要-873~-2 706 bp间的启动子片段,即SDG8启动子的核心启动子(core promoter)部分存在于-873~-2 706 bp之间的区域。对长、短启动子的基序比较分析,发现有些基序仅分布于SDG8长启动子的-873~-2 706 bp之间的片段,如 AACACOREOSGLUB1(AACAAAC),ABRE LATERD1(ACGTG),MYB1AT(WAACCA)等。由于这些基序的缺乏,SDG8短的-873 bp启动子不能正常启动基因的表达。推测其中某些基序参与了启动子启动基因表达的功能,与核心启动子的组成有关,而核心启动子的长度、组成以及具体位置有待进一步分析。
[1]Ng DWK,Wang T,Chandrasekharan MB.Plant SET domain containing proteins:structure,function and regulation[J].Biochimicaet Biophysica Acta,2007,1769(5 -6):316-329.
[2]Chuang CF,Meyerowitz ME.Speeific and heritable genetic inter ferenee by dsRNA in Arabidopsis thaliana[J].Proe Natl Aead Sci USA,2000,97(9):4985 -4990.
[3]Miki D,Shimamoto K.Simple RNAi vectors for stable and transient suppression of gene function in rice[J].Plant and Cell Physiology,2004,45(4):490-495.
[4]Xu L,Zhao Z,Dong A,et al.Di- and tri- but not monomethylation on histone H3 lysine 36 marks active transcription of genes involved in flowering time regulation and other processesin Arabidopsis thaliana[J].Mol Cell Biol,2008,28:1348 -1360.
[5]Soppe WJ,Bentsink L,Koornneef M,et al.The earlyflowering mutant efs is involved in the autonomous promotion pathway of Arabidopsis thaliana [J].Development,1999,126:4763-4770.
[6]Kim SY,He Y,Jacob Y,et al.Establishment of the vernalization- responsive,winter- annualhabitin Arabidopsis requires a putative histone H3 methyl transferase[J].Plant Cell,2005,17:3301 – 3310.
[7]Dong G,Ma DP,Li J,et al.The histone methyltransferase SDG8 regulates shoot branching in Arabidopsis[J].Biochem Biophys Res Commun,2008,373:659–664
[8]Cazzonelli CI,Yin K,Pogson B.Potential implications for epigenetic regulation of carotenoid biosynthesis during root and shoot development[J].Plant Signalling and Behavior,2009c,4:339–341.
[9]Cazzonelli CI,Cuttriss AJ,Cossetto SB,et al.Regulation of carotenoid composition and shoot branching in Arabidopsis by a chromatin modifying histone methyltransferase,SDG8[J].Plant Cell,2009,21:39 – 53
[10]Cazzonelli CI,Roberts AC,Carmody ME,et al.Transcriptional control of SET DOMAIN GROUP8 and CAROTENOID ISOMERASE during Arabidopsis development[J].Mol Plant,2010,3:174 – 191
[11]Grini PE,Thorstensen T,Alm V,et al.The ASH1 HOMOLOG 2(ASHH2)histone H3 methyltransferase is required for ovule and anther development in Arabidopsis[J].PLo SONE,2009,4:e7817.
[12]Kim SY,He Y,Jacob Y,et al.Establishment of the vernalization- responsive,winter- annualhabitin Arabidopsis requires a putative histone H3 methyltransferase[J].Plant Cell,2005,17:3301 – 3310.
[13]Sims RJ,Nishioka K,Reinberg D.Histone lysine methylation:A signature for chromatin function[J].Trends in Genetics,2003,19(11):629 -639.
[14]Zhao Z,Yu Y,Meyer D,et al.Prevention of early flowering by expression of FLOWERINGLOCUS C requires methylation of histone H3 K36[J].Nat Cell Biol,2005,7(12):1156-60.
[15]Alexandre Berr,Emily J,McCallum,et al.Arabidopsis histone methyltransferase SET DOMAIN GROUP8 mediates induction of the jasmonate/ethylene pathway genes in plant defense response to necrotrophic fungi[J].Plant Physiol,2010,154:1403 –1414.
