噻吩类硫化物和吡啶在分子筛上竞争吸附的分子模拟
2012-06-12沈喜洲瞿东蕙杨文平石国芳
沈喜洲,黄 驰,瞿东蕙,杨文平,石国芳
(1.武汉工程大学化工与制药学院,湖北 武汉 430074;2.荆州职业技术学院,湖北 荆州 434020)
0 引 言
分子筛因具有明确的孔腔分布、极高的内表面积(600 m2/g)、良好的热稳定性(1 000 ℃)、完整的晶型结构以及可调变的酸位中心等特点[1],被作为吸附剂,广泛应用于炼油领域的脱硫研究.脱除焦化粗苯中的硫化物是实现焦化粗苯清洁化的有效途径和主要技术手段之一,工业上大多采用加氢的方法脱硫.但是碱性氮化物的存在会使催化剂中毒,降低催化剂的活性,给催化加氢过程带来不利影响[2-4].
分子模拟作为一种新兴的化学技术,已经广泛用于材料科学、生物技术及石油化工等领域[5].虽然前人已对于吡啶在八面沸石分子筛上的吸附已有大量的研究和报道[6-8].但对于噻吩在分子筛上的分子模拟研究多采用的是MCM-22分子筛或改性的Y型分子筛,其组成为噻吩和异辛烷或者噻吩、苯并噻吩和二苯并噻吩[9-10].有关吡啶和噻吩、甲基噻吩、二甲基噻吩在FAU分子筛上吸附竞争的分子模拟研究则尚未见报道.本研究采用分子模拟的方法,利用分子模拟技术和分子图形技术作为“分子显微镜”,从分子水平上研究噻吩、2-甲基噻吩、2,5-二甲基噻吩和吡啶在沸石催化剂中的微观构象和吸附行为.从原子-分子层面上深入探讨吡啶与噻吩类硫化物在沸石催化剂上的吸附竞争机理,为油品尤其是焦化粗苯加氢脱硫提供基础理论支持.
本研究采用分子模拟的方法,利用分子模拟技术和分子图形技术作为“分子显微镜”,从分子水平上研究噻吩类硫化物和吡啶在沸石催化剂中的微观构象和吸附行为.从原子-分子层面上深入探讨吡啶与噻吩类硫化物在沸石催化剂上的吸附竞争机理,为焦化粗苯加氢脱硫提供基础理论支持.
1 计算模型的建立
1.1 分子筛结构
本研究所选用的分子筛为Y型分子筛,其基本骨架为FAU型,其结构参数为:空间群为Fd-3 m,晶胞参数为a=b=c=2.435 nm,α=β=γ=90°,孔道直径约为0.74 nm,孔道由12个四面体组成,如图1所示.
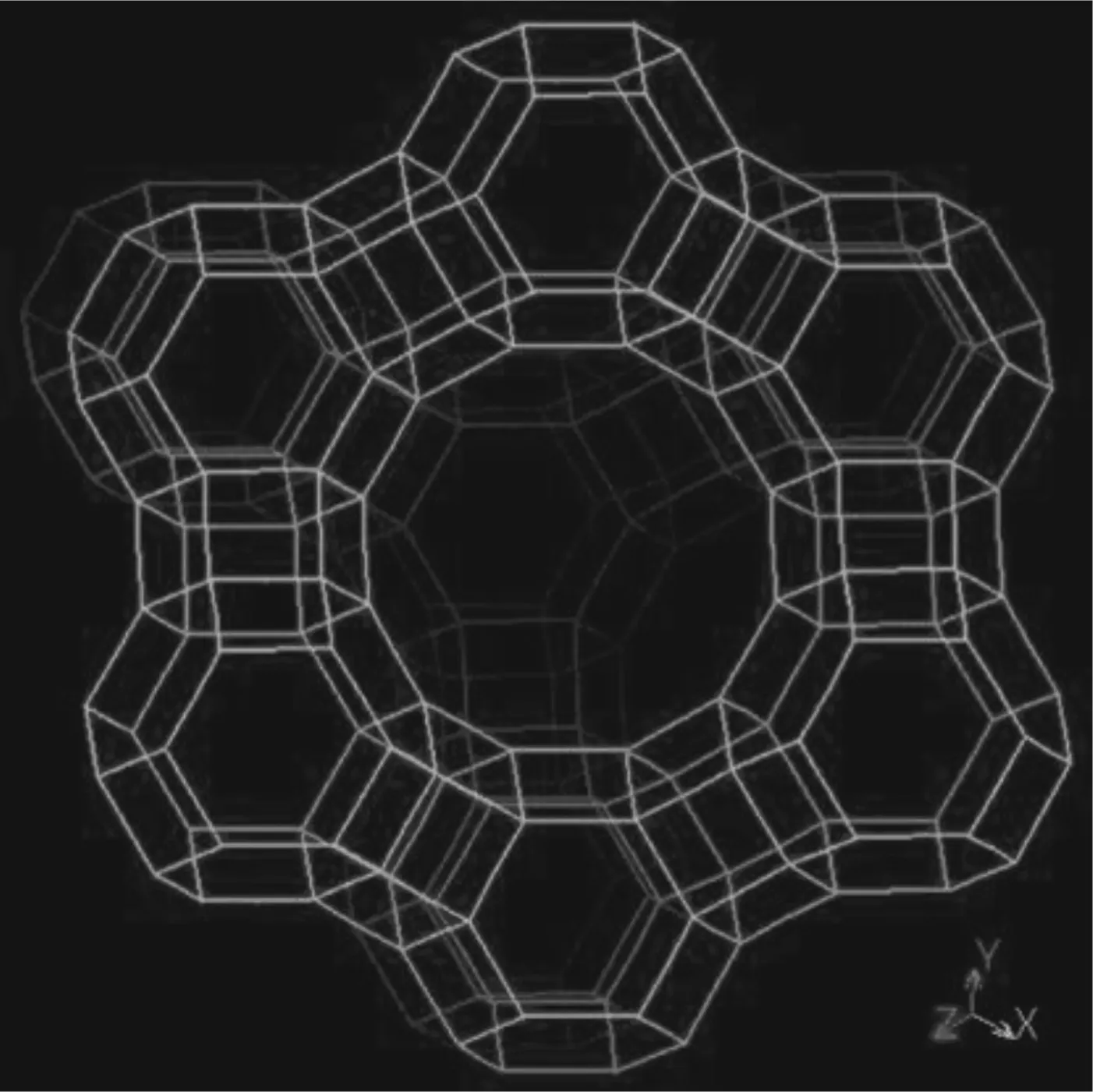
图1 FAU分子筛的结构Fig.1 The structure of FAU Zeolite
1.2 模拟细节
1.2.1 力场的选择 力场就是表示分子或原子间的相互作用,在很大程度上力场是决定体系的微观结构与物理、化学性质的主要因素.对于分子模拟来说,采用什么样的力场进行模拟极为重要.
吸附热可以通过下式求得:
Qst=RT2(∂Ink/∂T)0
(式1-1)
以噻吩和八面沸石分子筛为研究对象,选择文献[11]中的实验温度393.15~453.15 K,计算不同力场下的Henry系数,从而得到不同力场下的吸附热,如表1所示.

表1 不同力场下噻吩在八面沸石上的吸附热Table 1 Adsorption heat of thiophene on FAU zeolite in different force fields
从表1可知,在不同力场中所计算得到的吸附热相差很大,选用合适的力场是模拟计算的关键.Universal力场计算所得的吸附热105.50 kJ/mol与文献中实验值80.22 ~94.08 kJ/mol最为接近,所以Universal力场适合计算噻吩类硫化物在分子筛上的吸附.
以吡啶和八面沸石分子筛为研究对象,验证吡啶是否也适用于Universal力场.选择文献[12]中的实验温度623.15~773.15 K,在Universal力场下计算吡啶在FAU分子筛中的Henry系数,得到在Universal力场下吡啶在八面沸石上的吸附热为62.93 kJ/mol,在文献所报道的实验数值范围内(57.32 ~98.74 kJ/mol).所以,Universal力场也适合计算吡啶在分子筛上的吸附.
1.2.2 边界条件 在本研究中,为准确模拟一个无限大的宏观体系,将在三维方向上采用周期性边界条件来实现.
1.2.3 截断半径 在本文中模拟单元为2×2×2个晶胞,截断半径选取模拟所用的周期性盒子尺寸的一半,即2.52 nm,截断半径以外的相互作用力采用等密度近似来加以校正.
1.2.4 模拟设置 计算噻吩类硫化物和吡啶在沸石分子筛上的吸附行为,主要是采用MS软件中的Sorption模块中的Metropolis(蒙特卡洛)方法.在GCMC模拟的过程中,分子交换的概率为39%,分子平动的概率为20%,分子重生长的概率为1%,分子构象异构化的概率为20%,分子旋转的概率为20%.
2 结果与讨论
2.1 噻吩和吡啶二组分在分子筛中的竞争吸附
2.1.1 吸附等温线 选用Univeasal力场,在焦化粗苯加氢条件下,即压力为0.01~1.0 MPa和温度为573.15 K,计算摩尔比为1∶1的噻吩和吡啶在FAU分子筛中的吸附等温线,结果如图2、3所示.
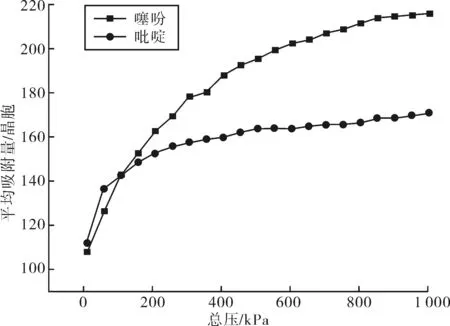
图2 噻吩-吡啶在FAU分子筛上的吸附等温线Fig.2 The adsorption isotherm of thiophene and pyridine on FAU zeolite
如图2所示,在焦化粗苯加氢条件下,FAU分子筛对噻吩和吡啶的竞争吸附的吸附量大小顺序为吡啶<噻吩.在吸附开始阶段,吡啶的吸附量大于噻吩,这可能是由于吡啶的碱性较强,最易接近并吸附在FAU分子筛的Lewis中心,使吡啶的吸附量增加;但随着压力的不断增大,噻吩的吸附量逐渐增加,当吸附达到平衡时,噻吩的吸附量大于吡啶,此过程受分子大小和吸附质碱性强弱的共同影响.
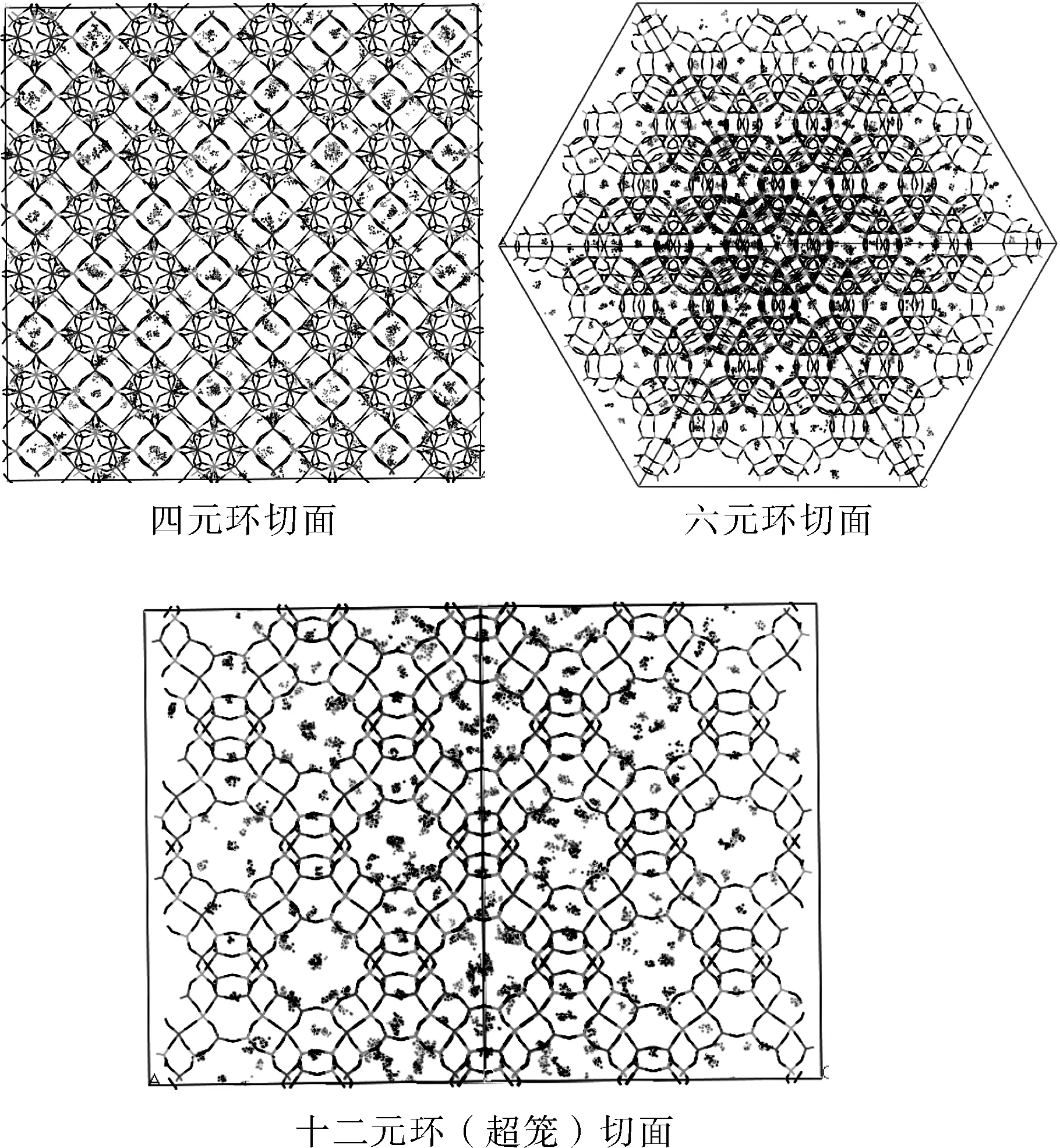
图3 噻吩-吡啶在FAU分子筛上的吸附位Fig.3 The adsorption sites of thiophene and pyridine on FAU zeolite
2.1.2 吸附位 如图3所示,在焦化粗苯加氢条件下,噻吩和吡啶在十二元环的主孔道中都有大量吸附.噻吩在分子筛的四元环和六元环的孔道中也有较多的吸附,而吡啶在四元环的中吸附较少.这可能是因为噻吩的分子直径(0.42 nm左右)小于吡啶的分子直径(0.50 nm左右),更易进入分子筛的各个笼中.当噻吩进入四元环后,由于空间位阻效应,使得吡啶难进入分子筛的四元环孔道中.
2.2 2-甲基噻吩和吡啶二组分在分子筛中的竞争吸附
2.2.1 吸附等温线 选用Univeasal力场,在焦化粗苯加氢条件下,即压力为0.01~1.0 MPa和温度为573.15 K,计算摩尔比为1∶1的2-甲基噻吩和吡啶在FAU分子筛中的吸附等温线,结果如图4、5所示.
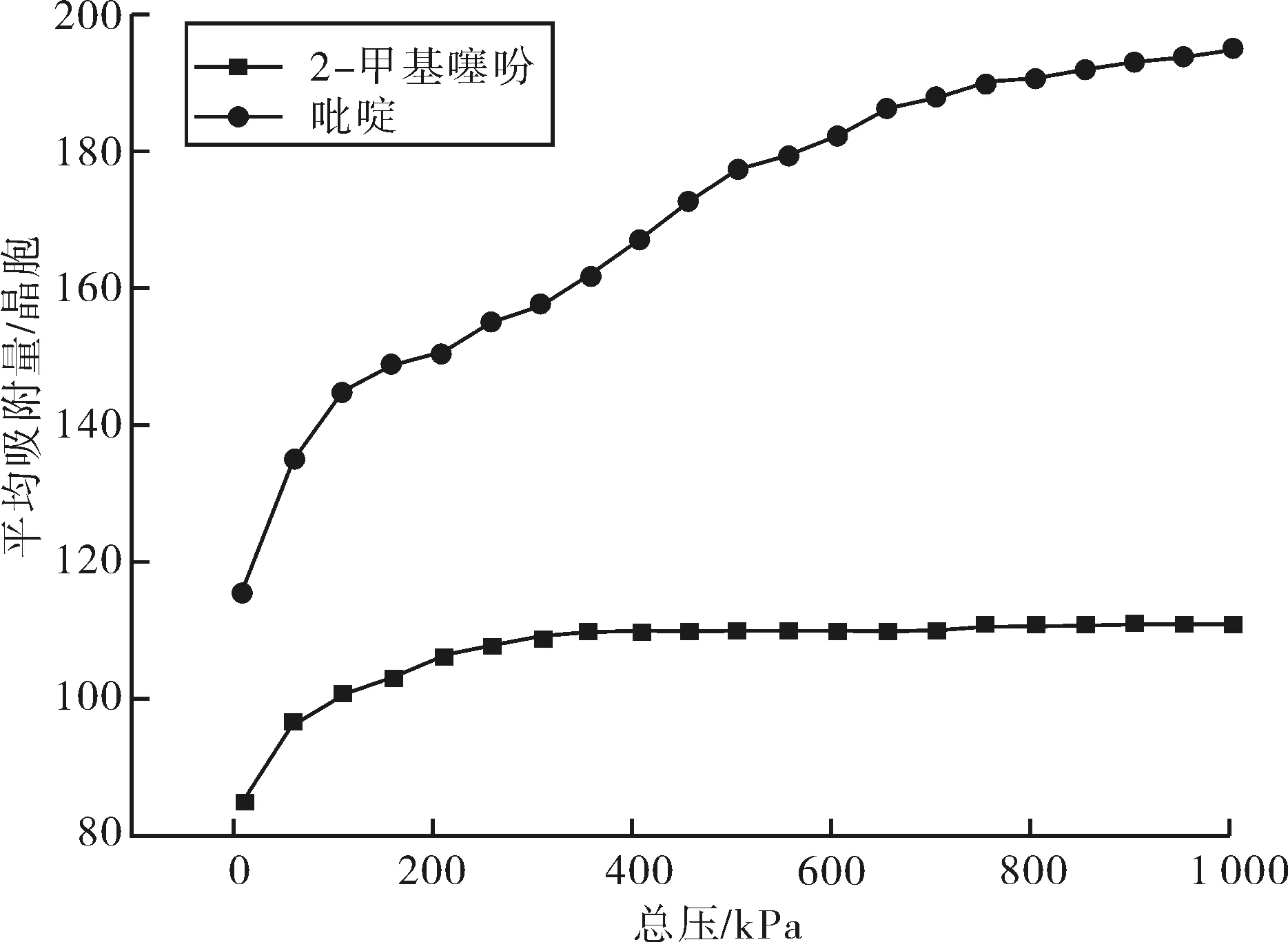
图4 2-甲基噻吩-吡啶在FAU分子筛上的吸附等温线Fig.4 The adsorption isotherm of 2-methylthiophene and pyridine on FAU zeolite
如图4所示,在焦化粗苯加氢条件下,FAU分子筛对吡啶和2-甲基噻吩的竞争吸附的吸附量大小顺序为2-甲基噻吩<吡啶.吡啶随着压力的增加,吸附量不断增加,2-甲基噻吩在压力达到300 kPa后,吸附量基本趋于平缓.
2.2.2 吸附位 如图5所示,在焦化粗苯加氢条件下,吡啶在十二元环的主孔道以及四元环和六元环的孔道中都有大量吸附,而2-甲基噻吩只在十二元环有大量吸附,在六元环中的吸附量极少.
由2-甲基噻吩和吡啶的吸附等温线和吸附位可知,在整个吸附过程中,由于吡啶分子直径较小,较易进入分子筛的孔道中并占据在超笼和β笼中,由于四元环的直径较小,当吡啶占据四元环后,使得分子直径较大的2-甲基噻吩无法进入,在六元环中也只有极少吸附,只能吸附在超笼中.
2.3 2,5-二甲基噻吩和吡啶二组分在分子筛中的竞争吸附
2.3.1 吸附等温线 选用Univeasal力场,在焦化粗苯加氢条件下,即压力为0.01~1.0 MPa和温度为573.15 K,计算摩尔比为1∶1的2,5-二甲基噻吩和吡啶在FAU分子筛中的吸附等温线,结果如图6、7所示.
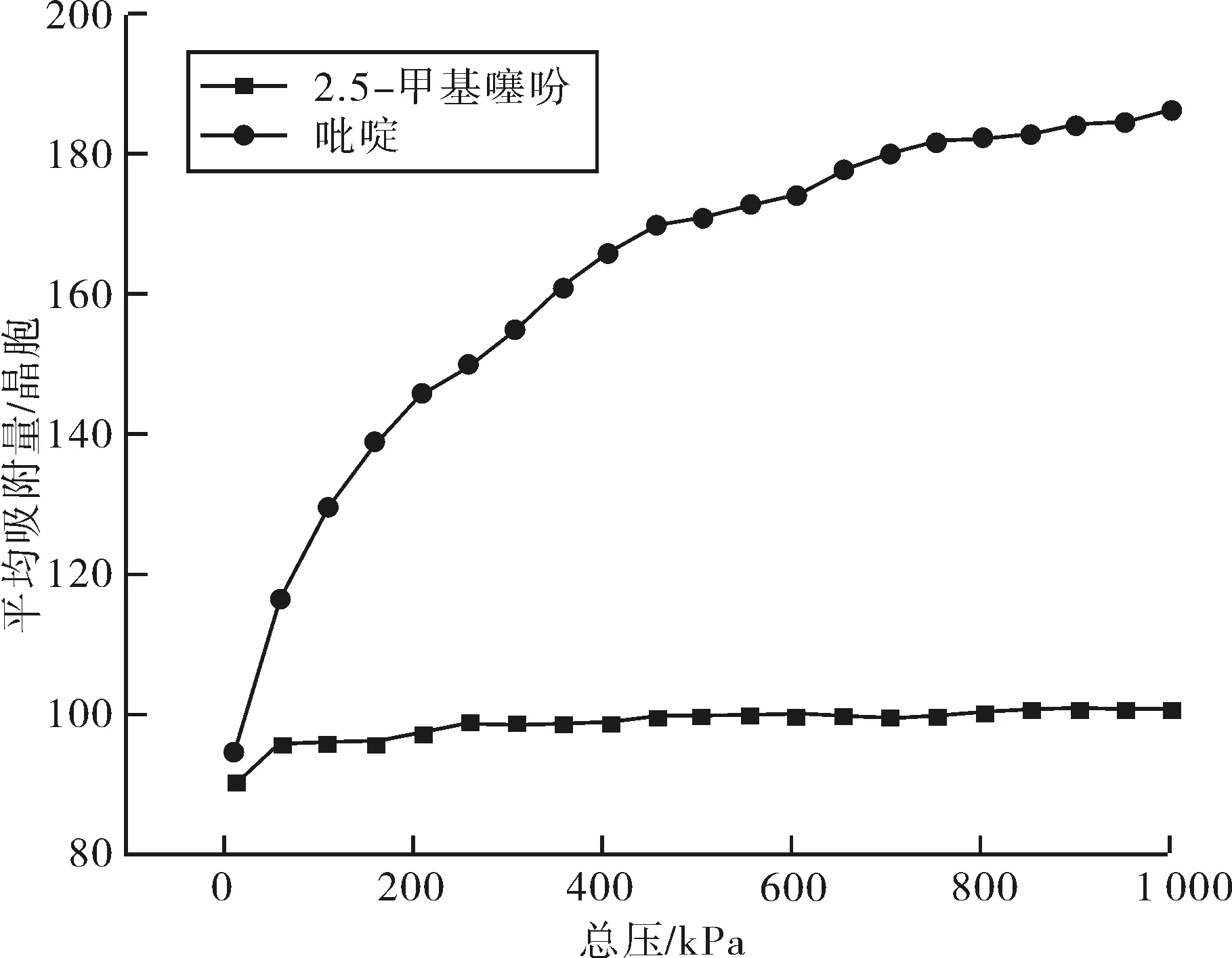
图6 2,5-二甲基噻吩-吡啶在FAU分子筛上的吸附等温线Fig.6 The adsorption isotherm of 2,5-dimethylthiophene and pyridine on FAU zeolite
如图6所示,在焦化粗苯加氢条件下,FAU分子筛对吡啶和2,5-二甲基噻吩的竞争吸附的吸附量大小顺序为2,5-二甲基噻吩<吡啶.吡啶随着压力的增加,吸附量不断增加,2,5-二甲基噻吩在压力达到100 kPa后,吸附量基本达到饱和.

图7 2,5-二甲基噻吩-吡啶在FAU分子筛上的吸附位Fig.7 The adsorption sites of 2,5-dimethylthiophene and pyridine on FAU zeolite注:红色代表2,5-二甲基噻吩,绿色代表吡啶.
2.3.2 吸附位 如图7所示,在焦化粗苯加氢条件下,吡啶在十二元环的主孔道以及四元环和六元环的孔道中都有大量吸附,而2,5-二甲基噻吩只在十二元环有大量吸附,在六元环中的吸附量极少.
由2,5-二甲基噻吩和吡啶的吸附等温线和吸附位可知,在整个吸附过程中,由于吡啶由于分子直径较小,较易进入分子筛的孔道中并占据在超笼和β笼中,当吡啶占据分子筛的四元环和六元环后,使得分子直径较大的2,5-二甲基噻吩较难进入进入FAU分子筛的六方柱笼和β笼中,只能进入超笼.
2.4 噻吩类硫化物和吡啶多组分的吸附竞争的分子模拟
2.4.1 吸附等温线 为了指导焦化粗苯催化加氢加工工艺的改进,在焦化粗苯加氢条件下,进一步模拟粗苯中的主要反应物(噻吩、2-甲基噻吩、2,5-二甲基噻吩和吡啶)在分子筛上的吸附竞争.考察焦化粗苯中的各硫化物和碱性氮化物吡啶在八面沸石上的吸附行为,探讨各物质在分子筛上的吸附竞争机理以及吡啶对加氢脱硫的影响,对于指导焦化粗苯和其他油品催化加氢脱硫的工业生产具有十分重要的意义.
表2为黄石泰华工业科技发展有限公司提供的焦化粗苯组分.对焦化粗苯进行低温加氢,主要是通过加氢精制除去粗苯中的硫化物,氮化物等杂质,得到纯的苯、甲苯和二甲苯.因此体系中的反应物主要为噻吩类硫化物和碱性氮化物等杂质.选用Univeasal力场,在焦化粗苯催化加氢条件下,即压力为0.01~1.0 MPa和温度为573.15 K,按照粗苯中各杂质的实际比例,即计算摩尔比为54∶10∶3∶33的噻吩、2-甲基噻吩、2,5-二甲基噻吩和吡啶在FAU分子筛中的吸附等温线,如图8所示.
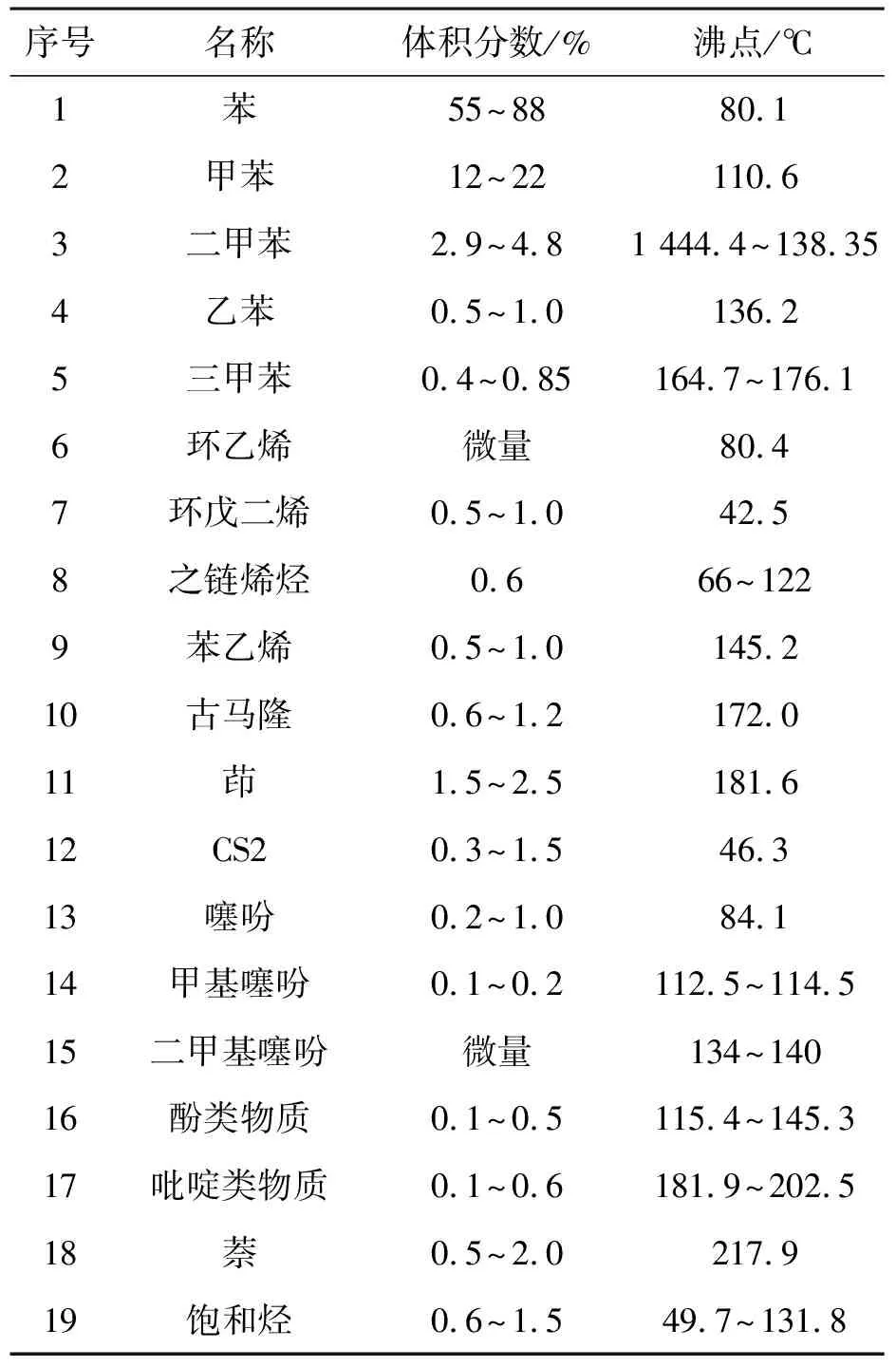
表2 焦化粗苯组分Table 2 The compositions of coking crude benzol
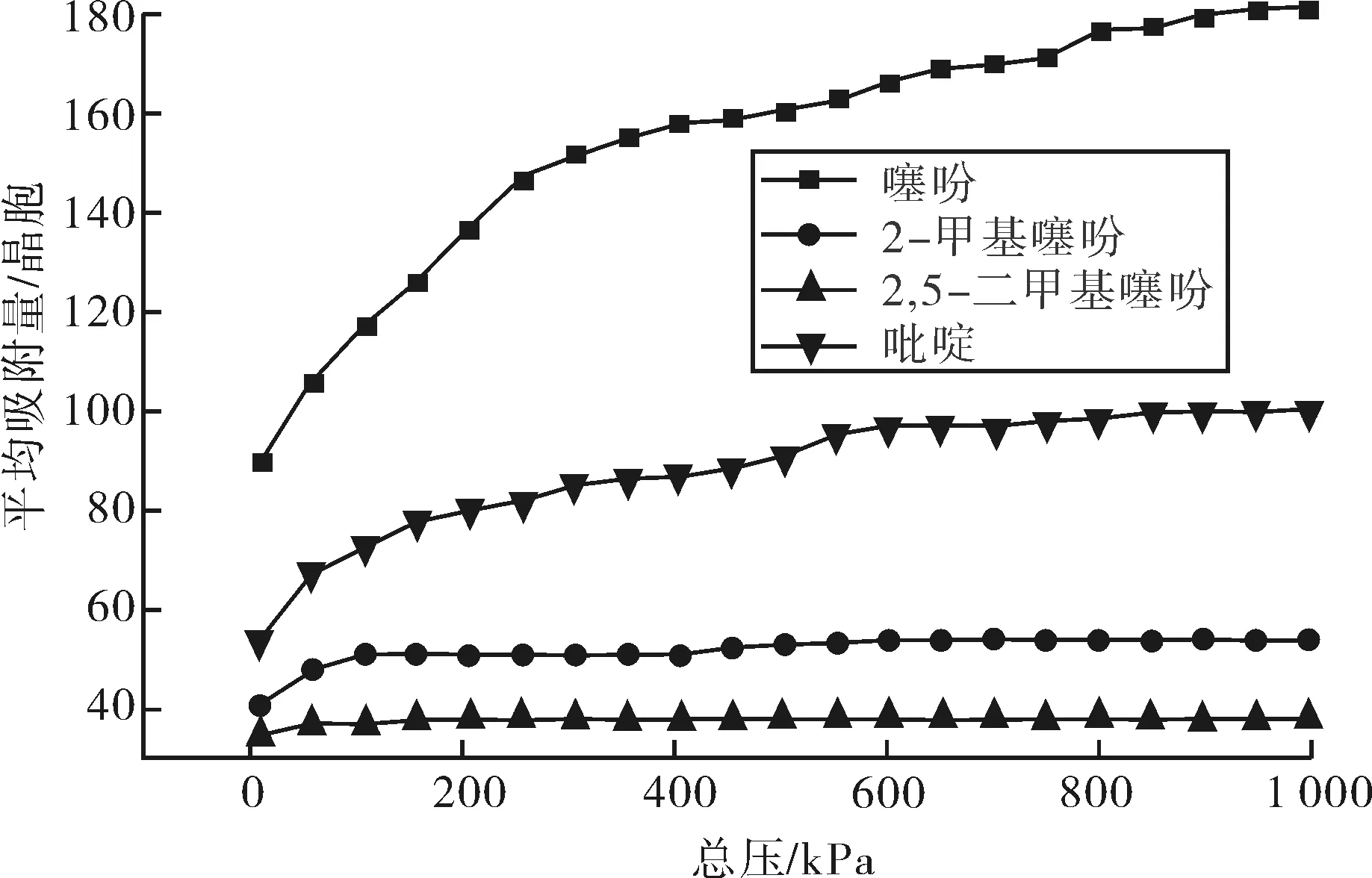
图8 焦化粗苯进料的吸附等温线Fig.8 The adsorption isotherm of coking crude benzol from feeding
由图8可知,在焦化粗苯催化加氢条件下,各类反应物在FAU分子上进行竞争吸附,2-甲基噻吩和2,5-二甲基噻吩在压力大于100 kPa后的吸附量则一直趋于以定值,这可能是因为这两种化合物在组分中所占的比例较小,同时分子直径相对较大,在进行混合吸附时,由于空间位阻效应,使得2-甲基噻吩和2,5-二甲基噻吩在分子筛上的吸附量较小;在吸附过程中,噻吩和吡啶随压力的增大不断增大,由于加氢脱硫氢解反应无需对芳烃饱和而直接脱硫,反应速率较大,而氮化物需先加氢饱和,然后C—N键断裂,同时C—N键的键能大于C—S键的键能,因此在工业催化加氢过程,吡啶吸附在分子筛的酸性中心后,较难通过加氢脱除,在工业生产过程中,随着反应的持续进行,吡啶会在分子筛上不断积累,使得加氢催化剂的酸性中心减少,从而影响加氢脱硫反应的速率.因此,在加氢脱硫工业生产中,吡啶在分子筛上的吸附量虽然小于噻吩,但是吡啶吸附在分子筛上停留的时间会大于噻吩等硫化物,随着加氢脱硫反应的进行,吡啶在分子筛上的吸附量会逐渐增大,使得催化剂的酸性中心减少,影响工业加氢脱硫反应的速率,同时吡啶的存在会增大催化加氢工业生产的氢耗.
2.4.2 吸附位 由图9可知,在焦化粗苯催化加氢条件下,各类反应物在FAU分子上进行竞争吸附,噻吩在超笼、β笼和六方柱笼中都有大量吸附;吡啶主要吸附在超笼和六方柱笼中;2-甲基噻吩主要分布在超笼中,在β笼中有少量吸附;2,5-二甲基噻吩主要分布在超笼中.

图9 焦化粗苯进料的吸附位Fig.9 The adsorption sites of coking crude benzol from feeding注:红色代表噻吩,蓝色代表2-甲基噻吩,绿色代表2,5-二甲基噻吩,淡红色代表吡啶.
3 结 语
本研究采用巨正则蒙特卡罗法(GCMC)研究焦化粗苯中典型的噻吩类硫化物和碱性氮化物吡啶在加氢催化中最具代表性的八面沸石分子筛上的吸附行为.得到如下结论:
a. 通过文献数据,比较在COMPASS,Universal和Dreiding立场下噻吩和吡啶在FAU分子筛上的吸附热,在Universal力场下,模拟计算得到的噻吩和吡啶的吸附热与实验数据吻合,该力场适合噻吩类硫化物和吡啶在分子筛上的吸附.
b. 在焦化粗苯催化加氢条件下,模拟噻吩类硫化物和吡啶的二组分的吸附竞争,分子大小在吸附过程中占主导地位;但对于噻吩和吡啶的二组分的吸附竞争,同时受分子大小和吸附质碱性强弱影响.
c. 在焦化粗苯催化加氢条件下,噻吩和吡啶均优先吸附在十二元的主孔道中,首先占据八面沸石的超笼和β笼;2-甲基噻吩和2,5-二甲基噻吩主要吸附在超笼中,2-甲基噻吩在分子筛的β笼中有少量吸附.
d. 在焦化粗苯催化加氢条件下,即压力为0.01~1.0 MPa和温度为573.15 K,按照粗苯中各杂质的实际比例,即计算摩尔比为54∶10∶3∶33的噻吩、2-甲基噻吩、2,5-二甲基噻吩和吡啶在FAU分子筛中的竞争吸附,2-甲基噻吩和2,5-二甲基噻吩在分子筛上的吸附量较小,噻吩和吡啶随着压力的增大不断增大,吡啶的饱和吸附量小于噻吩.
参考文献:
[1] 刘欣. Wolt 3 gt/HZSM-5催化剂上乙醇催化脱水制乙烯的研究[D].天津:天津大学,2008.
[2] 王记莲. 碱性氮化物含量对催化剂催化性能的影响[J]. 辽宁丝绸, 2009(3): 29-30.
[3] 邵志才, 高晓冬, 李皓光, 等. 氮化物对柴油深度和超深度加氢脱硫的影响Ⅰ. 氮化物含量的影响[J]. 石油学报:石油加工, 2006, 22(4): 12-17.
[4] Egorova M, Prins R. Mutual influence of the HDS of dibenzothiophene and HDN of 2-methylpyridine [J]. J Catal, 2004, 221 (1): 11-19.
[5] Zhou H, Ren Q.The application of molecular simulation in petrochemical field[J].Computers and Applied Chemistry,2006,23(1):15-19.
[6] Ferwerda R, Vander Maas J H, Hendra P J. Fourier transforms Raman spectroscopy of pyridine adsorbed on faujasites[J]. Vibrational Spectroscopy, 1994, 7(1): 37-47.
[7] Dominique A, Jacques J, Nelly K. Adsorption mechanism of substituted pyridines on silica suspensions: An NMR study[J]. Langmuir, 2004, 20: 10591-10598.
[8] 熊秀章, 沈喜洲, 周涵, 等. 几种吡啶衍生物在八面沸石中吸附的分子模拟[J]. 计算机与应用化学, 2008, 25(12): 1553-1556.
[9] 张国, 白福全, 周欣, 等. 噻吩分子及其与异辛烷二元混合物在MCM-22分子筛中吸附的蒙特卡罗模拟[J]. 物理化学学, 2009, 25(2): 218-222.
[10] 周丹红, 王玉清, 贺宁, 等. Cu(I), Ag(I)/分子筛化学吸附脱硫的π-络合机理[J]. 物理化学学报, 2006, 22(5): 542-547.
[11] Akira T, Yang H, Yang T. New sorbents for desucfurization by π-complexation: Thiophene/ benzene adsorption[J]. Ind Eng Chem Res, 2002,41(10):2487-2496.
[12] 李忠, 奚红霞, 郭建光, 等. 气固吸附等温线的研究进展[J]. 离子交换与吸附, 2004, 20(4): 376-384.
