碳酸乙烯酯与醋酸苯酯合成碳酸二苯酯的热力学分析
2012-06-12吴元欣杜治平
吴元欣,陈 成,文 庆,杜治平,袁 华
(武汉工程大学化工与制药学院绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430074)
0 引 言
CO2是引起全球温室效应的气体,主要来源于化石燃料的燃烧排放,其排放量正以每年4%的速度递增[1],造成了巨大的环保压力;但同时,CO2又可作为一种可循环利用的碳资源,最为廉价丰富,其储量比煤、石油、天然气的总和还多.因此,如何降低CO2的排放量,实现其分离回收与综合利用,变废为宝,将成为21世纪最为重要的能源与环境问题之一[2].
较为成熟的CO2工业化利用是CO2和环氧化合物直接环加成合成环状碳酸酯,特别是碳酸乙烯酯(EC)技术[3].EC在有机合成中可作为高沸点溶剂使用,也可用作无公害的土质稳定剂和合成广谱抗菌药呋喃唑酮的原料[4].特别是近年来,国内外开发出以EC和甲醇为原料,通过酯交换合成碳酸二甲酯(DMC)同时联产乙二醇的反应,其中DMC作为无毒、无污染的环保型绿色化工产品,其主要用途之一是与苯酚酯酯交换合成重要的工程塑料中间体—碳酸二苯酯(DPC)[5].因此,如将EC经酯交换合成DMC的反应与DMC经酯交换合成DPC的反应耦合,实现由EC一步合成DPC,不仅可缩短反应步骤,还能充分利用EC固定的CO2[6].因此,可以预见该工艺具有良好的发展前景.
清晰的过程热力学分析是系统进行的可能性的重要判断依据,更可为操作条件的确定、反应器的设计及催化剂的制备提供开发理论依据和指导.因此,本研究采用Benson基团贡献法等,对该反应体系中各步反应进行了详细的热力学计算分析,以期为今后碳酸二苯酯合成的实验研究和可能的工业化生产提供一定的理论依据和参考.
1 反应原理与热力学计算
1.1 反应方程式
EC与醋酸苯酯(PA)酯交换反应的计量方程式如下:


反应(2)是EC与PA酯交换反应的第一步,生成中间体2-乙酰氧乙基苯基碳酸酯(2-acetyloxyethyl phenyl carbonate,AOEPC).AOPEC有可能按反应(3)所示,与PA继续进行反应生成DPC和副产物乙二醇二乙酸酯(ethylene diacetate,EDA),也可能按反应(4)的反应路径进行,直接发生歧化反应生成DPC.反应(5)为EC与PA酯交换反应的主要副反应,EC断裂烷氧键开环生成乙二醇苯醚乙酸酯(2-phenoxyethyl acetate,POEA)并释放CO2[7].
1.2 热力学数据计算
1.2.1 298 K时理想气体标准摩尔生成焓、标准摩尔熵和等压摩尔热容估算 上述反应中的DPC、CO2的相关热力学数据参见文献[8-9].由于缺少其他组分的气态标准摩尔生成焓,标准摩尔熵和热容数据,采用Besnon基团贡献法计算.Benson基团贡献法因其考虑了临近基团的相互作用,具有较高的精度而被广泛采用[10-11].计算公式如下:
(1)
(2)
(3)
式中:i-基团;δ-对称数;η-光学异构体数;n-基团数;Cp,m-物质的摩尔恒压热容.
各基团的Hi、Si、Cp m的贡献值如表1所示.EC、PA、AOEPC、EDA和POEA的对称数分别是2、6、6、18、6,所涉及的组分均无光学异构体,故η=1.不同温度下各物质的等压摩尔热容值,通过多项式回归得到反应中各物质的等压摩尔热容与温度的关系,计算结果如表2所示.由Benson基团贡献法估算得到PA的 为-277.54 kJ/mol与文献值[12](-279.7±1.2)kJ/mol相差不大,说明Benson基团法估算化合物标准生成热是可靠的.
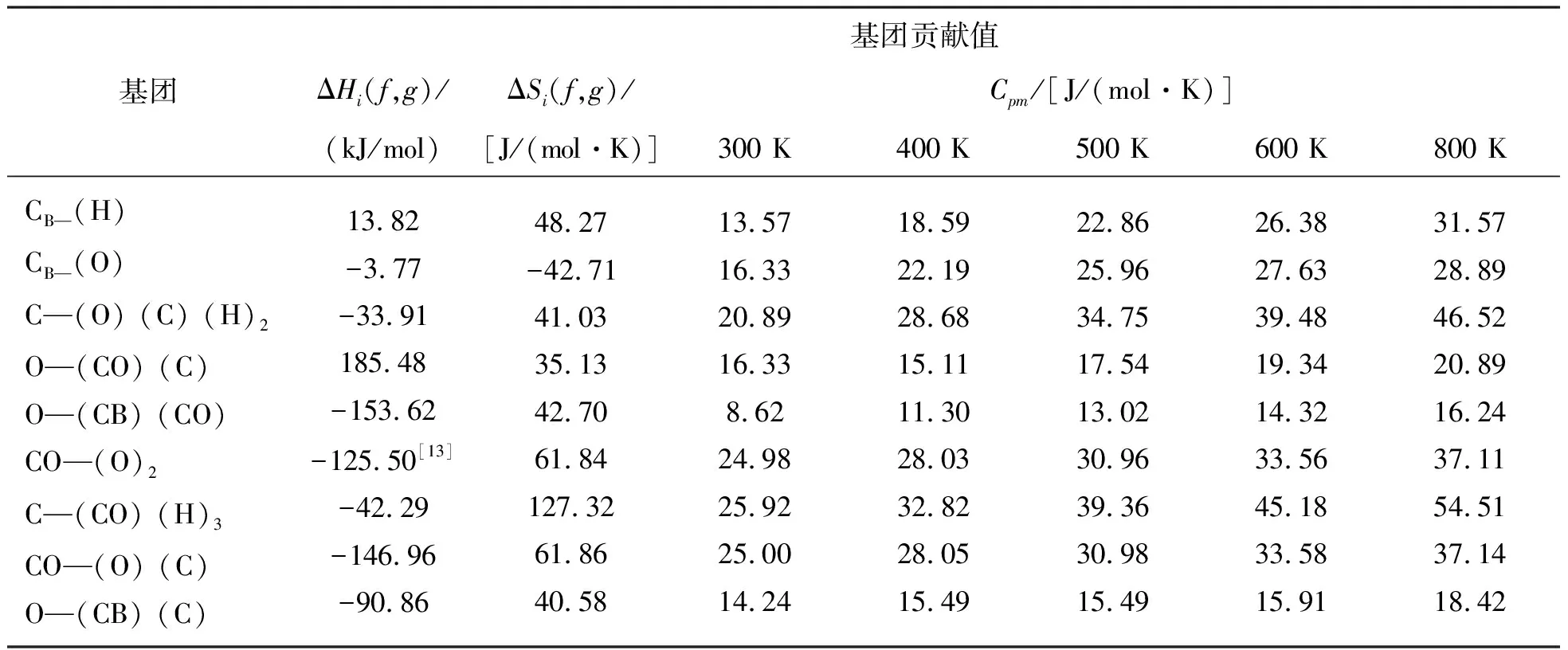
表1 298 K时Benson法基团贡献值Table 1 Benson group contributions at 298 K

表2 反应物和产物的热力学数据Table 2 Thermodynamic data of reactants and products
EC与PA的反应为液相反应, 要计算各组分液态生成热, 需要计算各组分在对应温度下的蒸发热.本研究基于Joback and Reid 基团贡献法[11]计算EC、PA、AOEPC、EDA、POEA在沸点下的蒸发热ΔVHb, 采用公式(4)进行计算,基团贡献值见表3.
ΔVHb=15.30+∑niΔi
(4)
式中:Δi表示基团贡献值,ni表示基团数目.

表3 Joback 和 Reid法估算ΔVHb的基团贡献值Table 3 The group contribution value for calculating ΔVHb base on Joback and Reid method
EC、PA、AOEPC、EDA和POEA沸点下的蒸发热计算值分别为36.105、44.834 、63.078 、47.262 和51.696 kJ/mol,文献[14]报道,PA的ΔvHb为46.3 kJ/mol,两者相差不大,因此按此方法估算的ΔvHb可靠.
根据各物质的ΔvHb,利用Watson公式(5)计算上述物质在不同温度下的蒸发热ΔvHT.其中,AOEPC的正常沸点Tb和临界温度Tc采用M-P法估算[15].使用M-P法估算EC的临界温度为806 K,可在文献[16]中查出EC的临界温度Tc=801.86 K,估计值与文献值的误差为0.52%,在误差允许的范围内.各组分在不同温度下的蒸发热的计算结果见表4.
(5)
式中,Tr为对比温度;Tbr为正常沸点的对比温度;n取0.38.
利用Cp随着温度变化的函数关系式(见表2),采用式(6)和式(7),计算各组分在不同温度下的气态和液态生成焓,计算结果见表5.
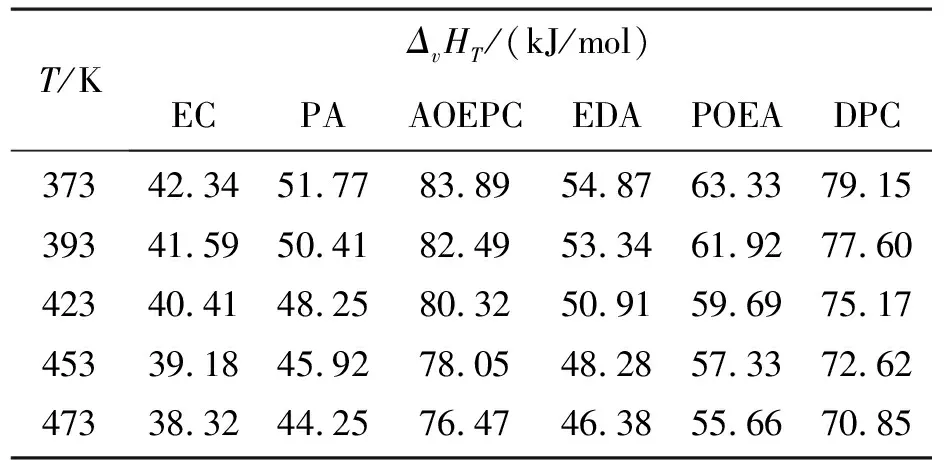
表4 各组分在不同温度下的蒸发热ΔvHTTable 4 The vaporization heat of different components at different temperatures
(6)
(7)
(8)
(9)
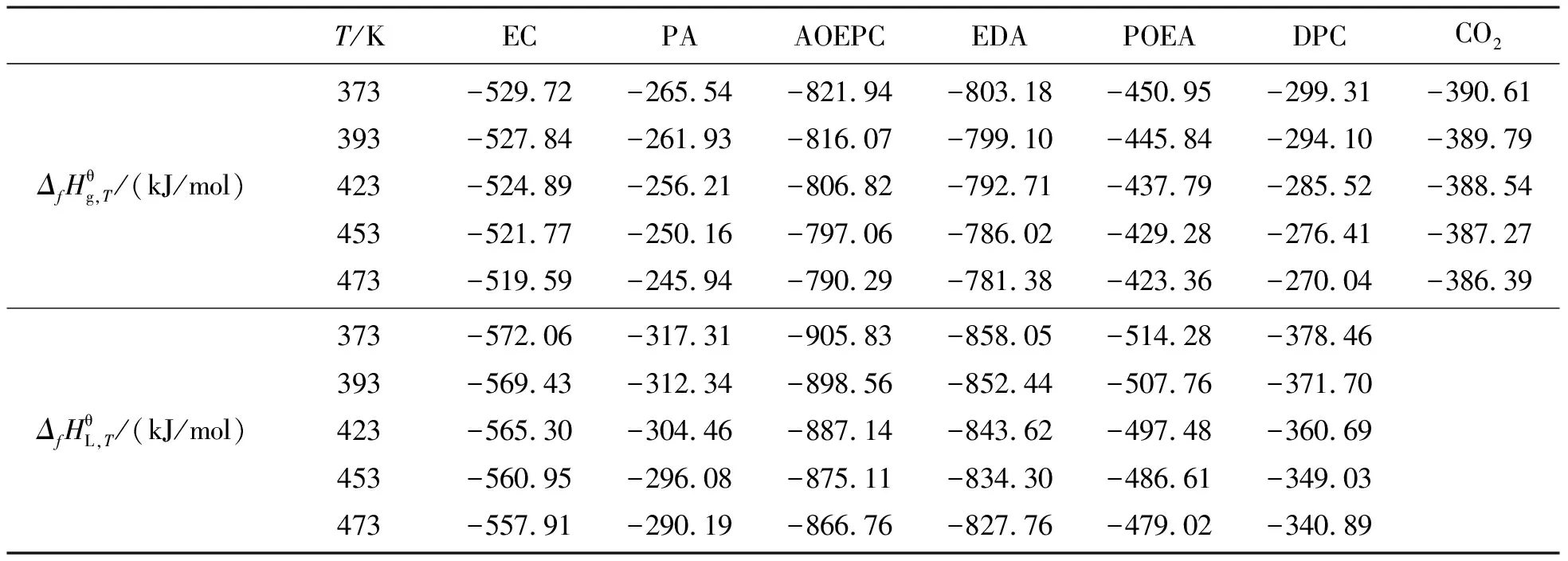
表5 各组分在不同温度下的气体和液体生成焓Table 5 The gas and liquid formation enthalpy of the components at different temperatures
2 结果与讨论
2.1 不同反应的ΔrHθ、ΔrSθ、ΔrGθ、Kp
本文所讨论的酯交换反应是在液相中进行的,所以在计算上述反应平衡常数时按各物质以液相参与反应来考虑.采用式(10)~(13)计算反应的焓变(ΔrHθ)、熵变(ΔrSθ)、吉布斯自由能变(ΔrGθ)和平衡常数(Kp).
ΔrHθ=Σ(njΔfHLθ)P-Σ(njΔfHLθ)R
(10)
ΔrSθ=Σ(njΔfSLθ)P-Σ(njΔfSLθ)R
(11)
ΔrGθ=ΔrHθ-TΔrSθ
(12)
Kp=exp[-ΔrGθ/(RT)]
(13)
式中,下角P表示反应物;下角R表示生成物;nj表示反应中各物质的化学量系数.
反应(1)~(5)在不同温度下的ΔrHθ、ΔrSθ、ΔrGθ、Kp如表7和表8所示:

表7 不同温度下反应(1)~(5)的ΔrHθ(kJ/mol)、ΔrSθ(kJ/mol/K)Table 7 The ΔrHθ、ΔrSθof reaction (1)~(5)at different temperatures

表8 不同温度下反应(1)~(5)的ΔrGθ(kJ/mol)、KpTable 8 The ΔrGθ、Kp of reaction (1)~(5)at different temperatures
由表7可知,反应(4)的焓变为正值,其余各反应焓变均为负值,说明反应(4)为吸热反应,其余各反应为放热反应.因此,从热力学角度分析,升高温度不利于DPC的生成.表8的结果表明,在计算的温度、压力范围内主反应(1)的ΔrGθ均为负值,说明该反应为自发过程,随着温度升高,ΔrGθ逐渐减小,Kp逐渐增加,但仅从热力学角度看,升高温度对反应的影响并不明显,需要从分离工程等方面来考虑提高DPC的时空收率.反应(2)的自由能变均为正值,平衡常数较小,可见要使平衡向右移动,必须对反应工艺进行深入探索.反应(4)的ΔrGθ均为负值且平衡常数Kp较大,说明DPC主要通过AOEPC的歧化生成.而副反应(5)的ΔrGθ为负值且平衡常数Kp很大,需要开发高选择性的催化剂来抑制POEA的生成.
3 结 语
a. 采用Besnon基团贡献法计算了EC与PA酯交换反应体系中各组分在373~473 K之间的ΔfHθT,SθT,Cp,通过与相关的热力学数据对比表明,计算的热力学数据是可靠的.应用热力学公式计算了各反应在不同温度下的ΔrHθ、ΔrSθ、ΔrGθ、Kp.为合成反应条件的控制提供了理论依据.
b. 热力学分析表明,EC与PA酯交换反应为放热反应,升高温度不利于DPC的生成,同时ΔrGθ为负值,为自发过程,但平衡常数Kp随着温度的变化有限.
c. 在生成DPC的两个竞争反应中,反应(4)占优势,DPC主要是通过AOEPC的歧化生成.反应(5)的ΔrGθ为负值且平衡常数Kp很大,为主要的副反应,需要开发高选择性的催化剂来抑制POEA的生成.
参考文献:
[1] 贾彦雷,许文,刘家祺,等. 二氧化碳的化学利用[J]. 天然气化工,2004,29(3):54-58.
[2] 夏明珠,严莲荷,雷武,等. 二氧化碳的分离回收技术与综合利用[J]. 现代化工,1999,19(5):46.
[3] 陈松丛,刘建华,汪妍,等. 二氧化碳的间接利用:碳酸乙烯酯应用研究进展[J]. 分子催化,2010,24(6):556-568.
[4] 高健,钟顺和. CO2和环氧乙烷直接制备碳酸乙烯酯的研究进展[J]. 化学进展,2002,14(2):107-112.
[5] 张海涛,李定或,吴广文,等. 冷却结晶法分离和精制碳酸二苯酯[J]. 武汉化工学院学报,2006,28(1):2-15.
[6] 杜治平,肖艳华,王公应,等. 碳酸乙烯酯酯交换合成碳酸二苯酯[J]. 化学工程,2010,38(2):87-90.
[7] 杜治平,姚洁,王公应. 碳酸乙烯酯合成碳酸二苯酯的MS-GC分析[J]. 合成化学,2006,14(3):303-305.
[8] David R L. CRC Handbook of Chemistry and Physics[M/OL]. Bola Raton:CRC Press, 2005 [2012-5-29]. http://www.hbcpnetbase.com.
[9] 天津大学物理化学教研室编. 物理化学[M]. 3版. 北京:高等教育出版社,1993:393-401.
[10] Cohen N,Benson S W. Estination of heat formation of organic compounds by additivity methods[J]. Chem Rev,1993,93(7):2419-2438.
[11] 马沛生. 化工数据[M]. 北京:中国石化出版社,2003:26.
[12] Lebedeva N D, Katin Y A. Heats of combustion of certain monosubstituted benzenes[J]. Russ J Phys Chem,1972,46:1088.
[13] Poling B E, Prausnitz J M. The properties of gas and liquids[M]. 5th Edition. New York: The McGraw-Hill Companied Inc:2001.
[14] National institute of standard and technology(NIST)[EB/OL].2012[2012-5-29] http://webbook.nist.gov/cgi cbook.cgi ID=C122792&mask=1#Thero-Gas.
[15] Marrero-Morejon J, Pardillo-Fontdevila E. Estimation of pure compound properties using group-interaction contributions [J]. AIChE J, 1999,145:615.
[16] 马沛生. 石油化工基础数据手册:续编[M]. 北京:化学工业出版社,1993:16.
