不同生态因子对曼氏皮海鞘耗氧率的影响
2012-06-06曹善茂张丛尧左骁
曹善茂,张丛尧,左骁
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
曼氏皮海鞘Molgula manhattensis亦称为乳突皮海鞘,是中国部分海域的主要污损生物之一。它可大量附着于船运设施和养殖设施上,给航运和养殖生产带来严重影响[1]。近年来,曼氏皮海鞘大量滋生于海参育苗池中。由于其繁殖速度和生长速度惊人,与海参苗争夺饵料和空间,甚至成为优势种,致使海参苗的产量大大降低[2]。同时由于其代谢十分旺盛,不仅可导致局部水体缺氧,引起周边水质恶化,而且还能产生有毒物质,对海参育苗产生不良影响[3]。如何有效地对其进行防除,已成为海参育苗生产中的一个亟待解决的问题。关于曼氏皮海鞘的基础研究,仅见于对其分类、生态学及摄食生理方面[4-7],而关于其代谢生理方面的研究目前尚未见报道。本试验中,作者研究了不同生态因子对曼氏皮海鞘呼吸生理的影响,以期为开展其防除工作提供参考资料。
1 材料与方法
1.1 材料
从海参育苗池中的网衣上剥离曼氏皮海鞘,取规格基本一致,个体直径为10~20 mm的曼氏皮海鞘带回实验室,放入塑料水箱中进行充气暂养(室温)。暂养期间,海水盐度为31~32,每天早晚各全量换水一次;每日投饵3次,饵料为螺旋藻粉和海洋鲜酵母,投饵量以前一天的摄食情况而定。暂养一周后开始升温,每日升温0.5~1.0℃,正式试验前2 d将暂养的环境因子逐步调至试验条件,试验前1 d停止投饵。选择活动性好的健康个体作为试验材料。
1.2 方法
1.2.1 耗氧率的测定与计算 试验采取静水法。试验用海水为提前一天用0.45 μm滤膜抽滤过的新鲜海水。试验容器为自制的简易呼吸瓶,用500 mL的三角锥瓶装满海水并充氧后,放入试验用海鞘个体,随后立刻用塑料保鲜膜将瓶口封牢,以隔断与外界空气的接触。具体测定方法依据GB 17378.4-1998《海洋监测规范》,采用碘量法测定溶解氧含量。各项试验均设3个平行,并设一个空白对照。试验结束后测定海鞘的体径 (D)、体质量(湿质量WW及干质量WD),并计算个体耗氧量(RI,mg/(个·h))和耗氧率 (RW,mg/(g·h)):
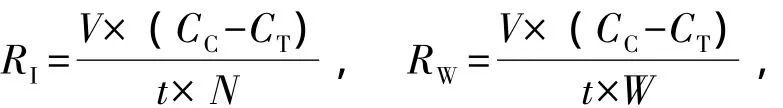
其中:CC为空白组水样的溶解氧 (mg/L);CT为处理组水样的溶解氧 (mg/L);V为试验水体的体积 (L);t试验持续时间 (h);N为试验海鞘的数量;W为试验海鞘的湿质量 (g)。
1.2.2 温度对耗氧率的影响试验 取饥饿24 h的曼氏皮海鞘于试验容器中,试验海水盐度为31.6,pH为8.2,设置5个温度梯度:12、16、20、24、28℃。每个温度组设3个重复,并设一个空白对照。每天升温0.5~1.0℃,每达到一个试验温度让海鞘适应1 d后进行试验,试验时间为6 h。
温度系数Q10值也可以反映水温对代谢的影响,其计算公式为

其中:R1、R2分别为温度为T1、T2时的耗氧率。
1.2.3 盐度对耗氧率的影响试验 温度设置5个水平:12、16、20、24、28℃,升温驯化结束后调节各温度水平下的盐度。每个温度水平下设置6个盐度梯度:20、25、30、32、35、40,各盐度组均设3个重复,并将盐度为31.6的正常海水作为空白对照。高盐度海水用海水晶与普通海水调配而成;低盐度海水用纯净水与普通海水调配而成。调至试验设定盐度后让海鞘适应2 d后进行试验。试验期间调控盐度梯度的变化幅度为±1。
1.2.4 pH对耗氧率的影响试验 温度设置5个水平:12、16、20、24、28℃,升温驯化结束后调节各温度水平下的pH值。每个温度水平下设置7个pH梯度:4、5、6、7、8、9、10,各 pH组均设3个重复,并将pH为8.2的正常海水作为空白对照。试验pH梯度用1 mol/L的HCl和1 mol/L的NaOH调制。调至试验设定pH后让海鞘适应2 d后进行试验。试验期间调控pH梯度的变化幅度为±0.5。
1.2.5 耗氧率的昼夜节律 试验温度为 (22±0.2)℃,pH为8.2,盐度为31.6,试验持续24 h,从9:00开始,每隔3 h测定一次耗氧率。具体操作以9:00—12:00为例:将抽滤好的海水注入500 mL的三角锥瓶中,冲气搅拌3~5 min后,取水样测定溶解氧的初始值,随后将曼氏皮海鞘个体放入三角锥瓶开始计时,3 h结束前3~5 min取水样测定溶氧值;同时注水于另一相同体积的三角锥瓶,也充气3~5 min后取样测定。3 h结束时,直接将海鞘放入新的三角锥瓶中继续下一时段的试验。其他各时间段的操作同上。
1.2.6 不同规格 (湿质量)对耗氧率的影响试验
取不同平均体质量的海鞘15组,每组个体大小规格基本一致,设空白对照一组。试验前饥饿24 h,试验温度16℃,pH为8.2,盐度为31.6。
1.3 数据处理
将耗氧率作为因变量,不同环境因子作为自变量,利用SPASS 10.0软件进行单因子方差分析,用Duncan法进行组间多重比较。
2 结果
2.1 温度对曼氏皮海鞘耗氧率的影响
从图1可见:温度与曼氏皮海鞘个体耗氧量和耗氧率的关系呈一“倒钟”型曲线。在12~20℃时,随着温度的升高,曼氏皮海鞘的个体耗氧量和耗氧率明显增大;在20℃时达到高峰,个体耗氧量和耗氧率分别为0.303 mg/(个·h)和0.964 mg/(g·h);高于20℃时则出现明显的下降趋势(P<0.01)。曼氏皮海鞘在低温下个体耗氧量和耗氧率的变化较小,而在较高温度下变化趋势较大。
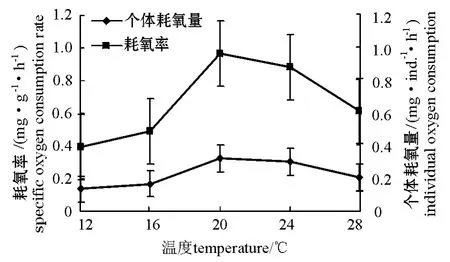
图1 曼氏皮海鞘的个体耗氧量和耗氧率与温度的关系Fig.1 The relationship between individual oxygen consumption,specific oxygen consumption rate and temperature in ascidian Molgula manhattensis
2.2 不同温度下盐度对曼氏皮海鞘耗氧率的影响
从图2可见:盐度为20~32时,曼氏皮海鞘的个体耗氧量和耗氧率随盐度的升高而增大,盐度高于32时则出现明显的下降趋势 (P<0.01)。经方差分析结果表明,盐度对曼氏皮海鞘个体耗氧量和耗氧率的影响差异极显著 (P<0.01),盐度与温度的交互作用对曼氏皮海鞘的个体耗氧量和耗氧率的影响也极显著 (P<0.01)。对不同盐度下曼氏皮海鞘的个体耗氧量和耗氧率进行多重比较,结果发现组间差异均显著 (P<0.05),在盐度为32时个体耗氧量和耗氧率最高,盐度为40时个体耗氧量和耗氧率最低。
2.3 不同温度下pH对曼氏皮海鞘耗氧率的影响
从图2可见:pH为6~8时,曼氏皮海鞘表现出较高的个体耗氧量和耗氧率,pH为8时个体耗氧量和耗氧率最高;而pH低于6和高于8时则明显下降 (P<0.01),pH为10时个体耗氧量和耗氧率最低。经方差分析结果表明,pH对曼氏皮海鞘的个体耗氧量和耗氧率的影响差异显著 (P<0.05),pH与温度的交互作用对曼氏皮海鞘个体耗氧量和耗氧率的影响也显著 (P<0.05)。对不同pH下曼氏皮海鞘的个体耗氧量和耗氧率进行多重比较,结果发现组间差异均显著 (P<0.05)。
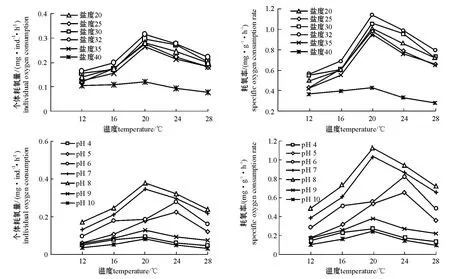
图2 不同温度下曼氏皮海鞘的个体耗氧量和耗氧率与盐度、pH的关系Fig.2 The relationship between individual oxygen consumption,specific oxygen consumption rate and salinity,and pH in ascidian Molgula manhattensis
2.4 体质量(湿质量)对曼氏皮海鞘耗氧率的影响
从图3可见;曼氏皮海鞘的个体耗氧量随体质量的增大而增大,而耗氧率随体质量的增大而减小。个体耗氧量和耗氧率与体质量之间均呈幂函数关系,回归方程分别为
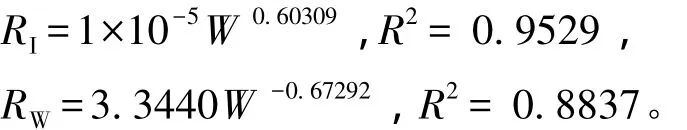
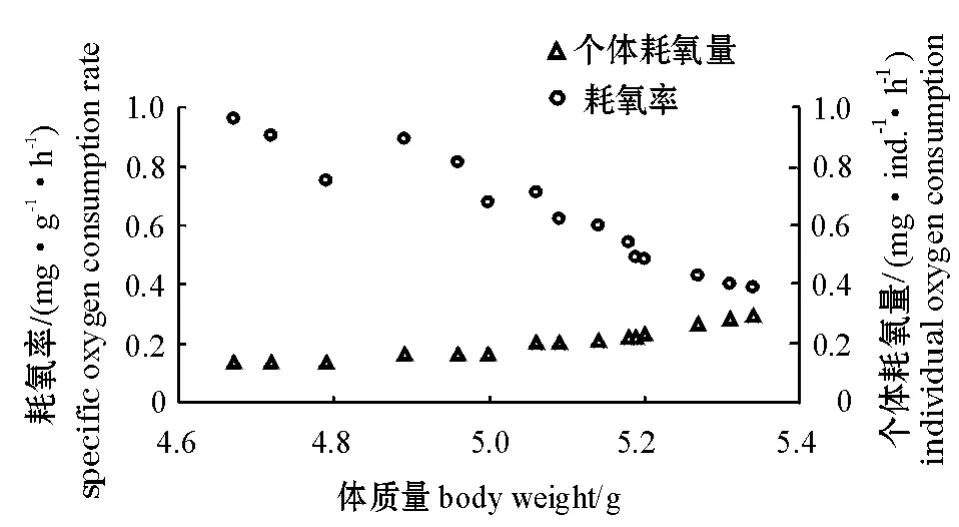
图3 曼氏皮海鞘的个体耗氧量和耗氧率与体质量的关系Fig.3 The relationship between individual oxygen consumption,specific oxygen consumption rate and body weight in ascidian Molgula manhattensis
2.5 曼氏皮海鞘耗氧率的昼夜节律
从图4可见:曼氏皮海鞘的个体耗氧量和耗氧率在24 h中基本呈现“高—低—高—低”的昼夜变化规律;个体耗氧量和耗氧率有两个生理高峰,分别为9:00—12:00及3:00—6:00,这两个时段的个体耗氧量和耗氧率分别为 0.457 mg/(个·h)、 1.346 mg/(g·h) 及 0.336 mg/(个·h)、0.992 mg/(g·h)。
3 讨论
3.1 温度
温度对水生生物呼吸的影响可以从水温得出。水温变化对生物代谢的影响可以直接从Q10值上反映出来。Q10为温度系数,即每升高10℃时代谢反应变化的程度。Q10值越高,表明动物对温度变化的反应越敏感[8];Q10值越低,表明动物对温度变化越迟钝。据报道,双壳类的Q10值一般为1.0~2.5,平均为2.0[9]。本试验中计算得出:水温为12~16、16~20、20~24、24~28℃时,曼氏皮海鞘耗氧率的 Q10值分别为1.684、5.313、0.843、0.388,其中水温为16~20℃时Q10值最高。这与张继红等[2]测定的柄海鞘Styela clava和玻璃海鞘Ciona intestinalis各相近温度组的Q10值有一定差异,可能是因种类和生态习性不同,导致其对温度的敏感性也不同。
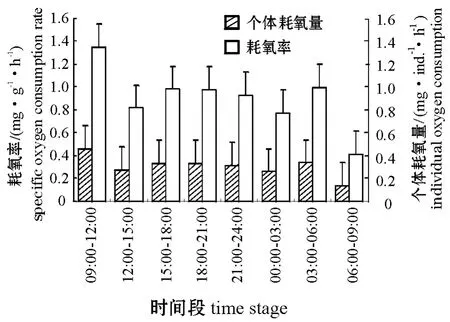
图4 曼氏皮海鞘个体耗氧量和耗氧率的昼夜节律Fig.4 The diurnal rhythm of individual oxygen consumption,specific oxygen consumption in ascidian Molgula manhattensis
温度是影响动物呼吸代谢最重要的环境因素。在适当的温度范围内,温度越高,动物的生理代谢水平就越高,其耗氧率必然随着温度的升高而升高。在自然海域或是海参的繁育池中,夏季水温较高,水生动物的生理活动增加,耗氧量也增加,再加上海鞘的生物量在夏季较大,局部水体必然会产生缺氧的现象,从而影响水产动物的生长,甚至会造成动物因缺氧而死亡。
3.2 盐度
盐度也是海水养殖中重要的环境因子之一,它的变动对海洋生物的生理代谢具有明显的影响。对许多海洋生物的研究表明,其耗氧率都会随盐度的变化而呈现出有规律的变化。低盐度的海水会使生物体内的渗透压发生改变,进而会影响一系列的生理活动。如贝类在低盐度的海水中会将贝壳关闭,从而将组织与低盐度环境相隔离开,而另一些海洋生物则会出现关闭入水管口的现象。同样,在高盐度的环境中也会出现类似的现象。本试验中发现,不同盐度下曼氏皮海鞘的表观生理活动也不同。在低盐度 (20)和高盐度 (40)的环境中,曼氏皮海鞘的水管明显呈闭合状,其运动频率降低。张晓凌[10]在研究柄海鞘耗氧率与盐度的关系时,发现柄海鞘在低盐度 (16)和高盐度 (36)的海水中同样表现出生理活动减弱、水管闭合频率变慢的现象。海鞘是一种广盐性的海洋生物,对盐度的适应性较好,所以在本试验中设置的6个盐度梯度下,曼氏皮海鞘都有一定的呼吸运动。
3.3 pH值
水生生物对水环境的pH均有一定的适应范围。研究表明,pH为6.08~6.72时,鲍鱼Haliotis rubra的耗氧率明显低于pH为8.45时的耗氧率[11]。吴常文等[12]在研究杂交鲟 Hybrid stureno时也发现,在一定的pH范围内,杂交鲟的耗氧率随外界pH的变化而变化。张晓凌[10]在研究柄海鞘耗氧率与pH的关系时发现,pH为7时,柄海鞘的耗氧率最大,也是其呼吸代谢最旺盛的时候;pH为5~7时,柄海鞘的耗氧率随pH的升高而增大;pH大于7时,其耗氧率随pH的升高而降低。本试验中也得出相同的结论,只是最适pH为8,这可能与海鞘的种类不同有关。与此同时,根据水化学原理,水中pH的变化还与二氧化碳的浓度有关。本试验中,作者发现在低pH(4)和高pH(10)的海水中,海鞘都会出现死亡现象。总之,关于pH对水生生物呼吸的影响机理十分复杂,可能是多种原因导致的。
3.4 规格 (湿质量)
一般来说,同种生物的个体越大,其个体耗氧量就越高,耗氧率反而降低。其主要原因是,个体小的生物 (体质量轻)正处于生长发育过程中,代谢活动要比个体大的生物 (体质量重)旺盛。本试验中曼氏皮海鞘的呼吸代谢也遵循这一规律,耗氧率 (RW)与体质量 (W)的关系也符合RW=aWb模型。最初这个模型由Winberg提出,主要应用于鱼类代谢率与体质量的相关关系,b值的大小反映了体质量对代谢影响的程度和方式。随后该模型被广泛应用于多种水生动物中。
3.5 昼夜变化
昼夜变化又叫昼夜节律,也叫日节律。地球上的光、温度、湿度等生态因子都具有明显的周期性,其中最重要的是日周期,月周期或潮汐周期,季周期或年周期。日周期是由地球的自转引起的,它形成白昼与黑夜的交替,生物在具有这种周期性的地球上进化和发展,因而,生物在其生命活动中形成各种节律——生物节律是必然的。动物的昼夜活动节律是一种复杂的生物学现象,它是生物对各种环境条件及昼夜变化的一种综合性的适应,即包括对各种光、温度、湿度和食物等非生物因素,以及种内社群关系和天敌等种间关系这些生物因素的适应。因此,各种生物的昼夜活动节律都有其自身的特点,也是生物对外界环境条件的综合适应能力。
关于双壳贝类呼吸代谢的研究结果表明,贝类白天的呼吸强度高于晚上[13],与某些蟹类相似[14],而与其它一些低等生物恰好相反。许多学者认为,这种生物的节律是由盐度、温度、摄食和光周期等日变化所控制。在海洋环境中,很多环境条件较为稳定,动物代谢的昼夜变化主要是与水体中溶解氧的日变化以及动物为消除竞争溶解氧而采取的生存策略有关。本试验中,作者发现,曼氏皮海鞘的昼夜呼吸节律是夜晚略大于白昼,夜晚的平均个体耗氧量和耗氧率分别为0.311 mg/(个·h)和0.916 mg/(g·h),白昼平均个体耗氧量和耗氧率分别为 0.301 mg/(个·h)和 0.887 mg/(g·h)。作者认为,海鞘作为固着生长的动物,缺乏主动运动能力,对光刺激并不敏感,因此,在适宜的环境条件下,海鞘在夜晚和白昼的耗氧率差异并不大。同时与昼夜的摄食情况比较,摄食率较大的时间段,也恰好是耗氧率较高的时间段[7]。
[1]张继红,方建光.4种海鞘排泄的初步研究[J].海洋水产研究,2000,21(1):31-36.
[2]张继红,方建光,董双林.温度对柄海鞘和玻璃海鞘食物颗粒选择性的影响[J].海洋水产研究,2001,22(2):47 -51.
[3]崔毅,陈碧娟,陈聚法.黄渤海海水养殖自身污染的评估[J].应用生态学报,2005,16(1):181-182.
[4]黄宗国.中国海洋生物种类与分布[M].北京:高等教育出版社,1954:27.
[5]黄宗国,蔡如星.海洋污损动物及其防除[M].上册.北京:海洋出版社,1984:352.
[6]郑兴成.中国沿海海鞘的物种多样性[J].生物多样性,1995,3(4):201-205.
[7]左骁,曹善茂,刘鹏亮.饵料种类、盐度、pH和规格对曼氏皮海鞘摄食率的影响[J].大连水产学院学报,2009(增刊):113-117.
[8]Griffiths C L,Griffiths R J.Bivalvia[M]//Pandian T L,Vernberg E J.Animal Energetics.New York:Academic Press,1987:1-88.
[9]Wilbur A E,Hilbish T J.Physiological energetics of the ribbed mussel Geukensia demissa(Dillwyn)in response to increased temperature[J].J Exp Biol Ecol,1989,131(2):161-170.
[10]张晓凌.柄海鞘摄食、呼吸和排泄的研究[D].青岛:中国海洋大学,2005.
[11]Frost B W.Effect of size and concentration on the feeding behavior of the marine planktonic copepod Calanus pacificus[J].Limnol Oceanogr,1972,17:805-815.
[12]吴常文,朱爱意,赵向炯.海水养殖杂交鲟对环境变化耐受性的实验研究[J].水产科学,2005,24(9):1-4.
[13]林小涛,张秋明,许忠能,等.虾蟹类呼吸代谢研究进展[J].水产学报,2000,24(6):575-580.
[14]刘勇,施坤涛,张少华,等.双壳贝类呼吸代谢研究进展[J].南方水产,2007,3(4):65-68.
