孔石莼和赤潮异弯藻相互作用的初步研究
2012-06-06蔡恒江唐学玺
蔡恒江,唐学玺
(1.大连海洋大学海洋科技与环境学院,辽宁大连116023;2.辽宁省高校近岸海洋环境科学与技术重点实验室,辽宁大连116023;3.中国海洋大学海洋生态学研究室,山东青岛266003)
赤潮是全球性的海洋生态灾害。近年来,中国近岸海域赤潮发生的频率、波及范围和危害程度呈上升趋势。赤潮不仅会破坏海洋渔业资源和生产,恶化海洋环境,影响海滨旅游业,而且有一些藻类在生长过程中会排放出毒素,对人类生活直接造成危害,即形成有害赤潮HAB。因此,赤潮已成为当前污染生态学的研究热点之一[1]。由于在赤潮的发生和消亡过程中各种理化因子和生态因子相互作用的复杂性,目前还没有找到非常理想的治理方法。利用海洋环境中的生物因子进行赤潮的防控已经越来越引起人们的重视[2-3],其中利用大型海藻与微藻间的相互作用来预防或控制赤潮是一个新的研究方向[4]。大量研究表明,孔石莼与微藻种群之间会发生克生作用[5-6],这为利用生物学方法控制赤潮的发生提供了可能。
用孔石莼进行赤潮防控的同时,其自身生长也会受到赤潮微藻的影响。但现今研究多集中于孔石莼对赤潮微藻的克生作用,而赤潮微藻对孔石莼生长的影响报道较少。研究表明,孔石莼可能会分泌某种克生物质抑制赤潮微藻的生长[7],但赤潮微藻对孔石莼作用途径的研究尚未见报道。本研究中,作者选用大型海藻——孔石莼和赤潮微藻——赤潮异弯藻为试验材料,研究了藻体、培养液滤液和胞内物质对生长相互作用的影响,以期找出孔石莼与赤潮异弯藻间的相互作用途径,为赤潮防治的生物操纵法的研究提供有价值的资料。
1 材料与方法
1.1 材料
孔石莼Ulva pertusa采自青岛太平角,采回后立即用天然海水洗净,用打孔器打成直径为1.3 cm的圆片。
赤潮异弯藻Heterosigma akashiwo取自中国海洋大学微藻培养中心,属赤潮藻种。
1.2 方法
试验前将孔石莼在室温下预培养7 d(光照强度为3000 lx)。试验在室内光照培养箱中进行,培养温度为 (20±1)℃,光照强度为3000 lx,光周期为12L∶12D。每个试验均设4个平行。
1.2.1 孔石莼与赤潮异弯藻间的克生作用试验
1)孔石莼对赤潮异弯藻生长的影响试验。分别取0、0.05、0.10、0.20、0.40 g孔石莼接种于150 mL f/2培养液中,使其初始接种量分别达到0(对照)、0.33、0.67、1.33、2.67 g/L。赤潮异弯藻在指数生长期接种 (以下同),接种的初始密度为1万个/mL,分别接种到含不同初始质量孔石莼的培养液中进行试验[8]。
2)赤潮异弯藻对孔石莼生长的影响试验。取0.05 g孔石莼接种于150 mL f/2培养液中,使其初始接种量达到0.33 g/L。赤潮异弯藻接种的初始密度分 别 为 0(对 照)、0.5、1.0、2.0、4.0万个/mL,分别接种到孔石莼培养液中进行试验。
1.2.2 孔石莼与赤潮异弯藻间的滤液交叉培养试验
1)孔石莼滤液对赤潮异弯藻生长的影响试验。分别取0、0.05、0.10、0.20、0.40 g孔石莼接种于150 mL f/2培养液中,使其初始接种量分别达到0、0.33、0.67、1.33、2.67 g/L。培养12 d后,取出孔石莼,培养液经孔径为0.45 μm的玻璃纤维素滤膜过滤得到孔石莼滤液,然后经f/2营养盐加富后作为赤潮异弯藻的培养液。赤潮异弯藻接种的初始密度为1.0万个/mL,分别接种到150 mL含不同质量的孔石莼滤液中。
2)赤潮异弯藻滤液对孔石莼生长的影响试验。赤潮异弯藻初始接种密度分别为 0、0.5、1.0、2.0、4.0万个/mL。培养12 d后,以6000 r/min离心10 min,取上清液,经孔径为0.45 μm的玻璃纤维素滤膜过滤得到赤潮异弯藻滤液,然后经f/2营养盐加富后作为孔石莼的培养液。取0.05 g孔石莼接种于150 mL f/2培养液中,使其初始接种量达到0.33 g/L后进行试验。
1.2.3 孔石莼与赤潮异弯藻间胞内物质的交叉培养试验
1)孔石莼胞内物质对赤潮异弯藻生长的影响试验。取孔石莼30 g,加少许消毒海水研磨成浆,以6000 r/min离心10 min后,取上清液0、1、2、4、8 mL分别加入150 mL f/2培养液中,相当于培养液中分别含有0(对照)、3.33、6.67、13.33、26.67 g/L的孔石莼胞内物质。赤潮异弯藻初始接种密度为1.0万个/mL,分别接种于含不同接种量的孔石莼胞内物质的培养液中进行试验。
2)赤潮异弯藻胞内物质对孔石莼生长的影响试验。把培养12 d的赤潮异弯藻溶液以6000 r/min离心10 min,弃上清液,取沉淀的赤潮异弯藻加入消毒海水中,使藻细胞重悬浮于溶液中。用消毒海水来调解藻细胞的密度,分别为0(对照)、5.0、10.0、20.0、40.0万个/mL,然后再使用超声波使藻细胞完全破碎。分别取150 mL含不同密度的赤潮异弯藻的破碎液进行f/2营养盐加富,各接入0.05 g孔石莼,使其初始接种量达到0.33 g/L后进行试验。
1.2.4 孔石莼的称重与赤潮异弯藻细胞密度的测定 每3 d取样进行测定,取样后每个培养瓶中补充f/2培养液,以消除可能产生的营养盐限制[9]。
用吸水纸把孔石莼表面的水吸干后称重。微藻用Lugol碘液固定,采用平板计数法,在Olympus双筒显微镜下进行细胞计数。
1.3 数据处理
数据处理采用SPSS 11.0进行统计分析。孔石莼生长的抑制率 (IU)按下式计算:
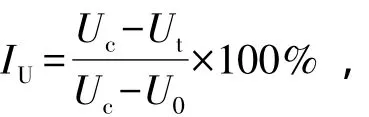
其中:Uc为t时间对照组孔石莼质量 (g);Ut为t时间处理组的孔石莼质量 (g);U0为试验初始孔石莼的质量 (g)。
赤潮异弯藻生长的抑制率 (IH)按下式计算:
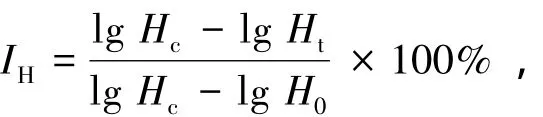
其中:Hc为 t时间对照组赤潮异弯藻的密度 (万个/mL);Ht为t时间处理组赤潮异弯藻的密度 (万个/mL);H0为试验初始赤潮异弯藻的密度 (万个/mL)。
2 结果
2.1 孔石莼与赤潮异弯藻间的克生作用
2.1.1 孔石莼对赤潮异弯藻生长的影响 孔石莼对赤潮异弯藻的生长有明显的影响。从图1可见:试验第6~12天时,接种孔石莼的4个处理组赤潮异弯藻的生长都受到了极显著的抑制 (P<0.01);随着孔石莼初始接种量的增加,抑制作用愈加明显,第 12天时,接种量为 0.33、0.67、1.33、2.67 g/L的4组孔石莼对赤潮异弯藻生长的抑制率分别为38.9%、70.6%、81.6%、84.%。
2.1.2 赤潮异弯藻对孔石莼生长的影响 赤潮异弯藻对孔石莼的生长有明显的影响。从图2可见:试验第9天时,接种赤潮异弯藻的4个处理组孔石莼的生长都受到了极显著的抑制 (P<0.01);随着赤潮异弯藻初始接种密度的增加,抑制作用愈加明显,第12天时,接种密度为0.5、1.0万个/mL的两组孔石莼的生长要明显好于接种密度为4.0万个/mL的组 (P<0.01),接种密度为0.5、1.0、2.0、4.0万个/mL的4组赤潮异弯藻对孔石莼生长的抑制率分别为30.25%、39.64%、49.82%、57.49%。
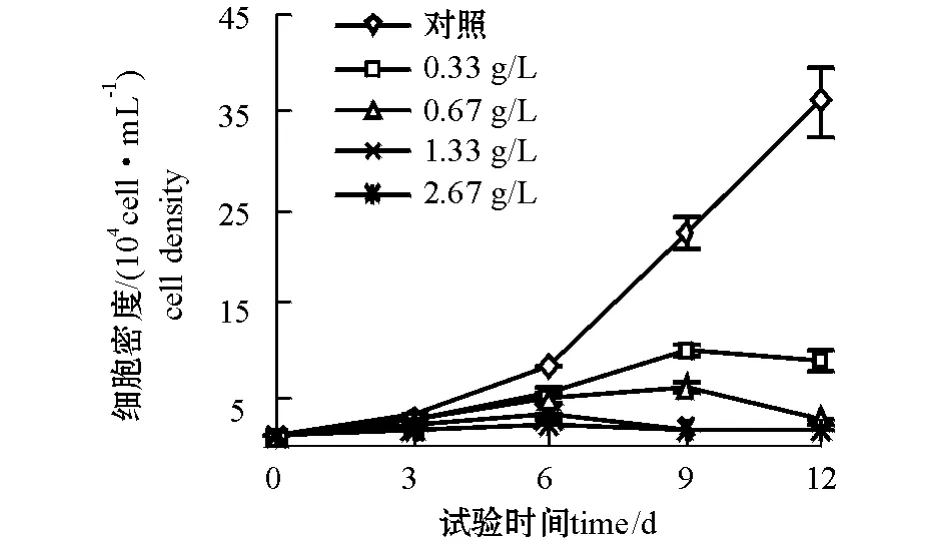
图1 不同初始接种量的孔石莼对赤潮异弯藻生长的影响Fig.1 Effects of U.pertusa with diffierent inoculated initial weights on the growth of H.akashiwo
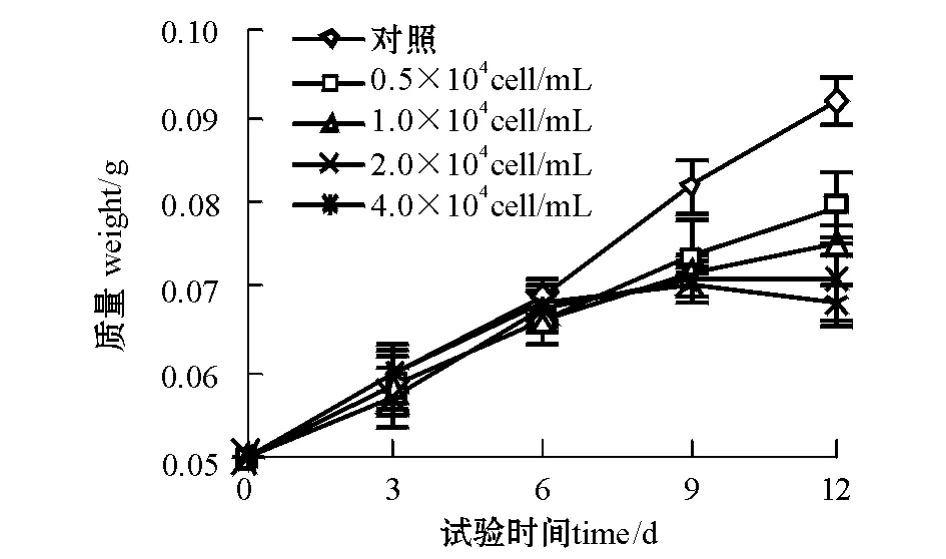
图2 不同初始接种密度的赤潮异弯藻对孔石莼生长的影响Fig.2 Effects of H.akashiwo in diffierent inoculated initial cell density on the growth of U.pertusa
2.2 孔石莼与赤潮异弯藻间的滤液交叉培养试验
2.2.1 孔石莼培养液滤液对赤潮异弯藻生长的影响 孔石莼培养液滤液对赤潮异弯藻生长有明显的影响。从图3可见:试验第12天时,除孔石莼初始接种量为0.33 g/L组外,其它3个处理组赤潮异弯藻的生长都受到了极显著的抑制 (P<0.01);随着孔石莼初始接种量的增加,其培养液滤液对赤潮异弯藻生长的抑制作用愈加明显,第12天时,接种量为0.67、1.33、2.67 g/L的3组孔石莼滤液对赤潮异弯藻生长的抑制率分别为8.05%、19.69%、39.73%。
2.2.2 赤潮异弯藻培养液滤液对孔石莼生长的影响 不同初始接种密度的赤潮异弯藻培养液滤液对孔石莼生长有明显的影响。从图4可见:随着赤潮异弯藻初始接种密度的增加,孔石莼生长受到其培养液滤液的影响增大;第12天时,接种赤潮异弯藻密度为2.0、4.0万个/mL的两组孔石莼的生长受到了极显著的抑制 (P<0.01),接种密度为0.5、1.0、2.0、4.0万个/mL的4组赤潮异弯藻滤液对孔石莼生长的抑制率分别为1.64%、10.24%、15.97%、19.45%。

图3 不同初始接种量的孔石莼培养液滤液对赤潮异弯藻生长的影响Fig.3 Effectsofculture medium filtratesfrom U.pertusa with diffierent inoculated initial weights on the growth of H.akashiwo
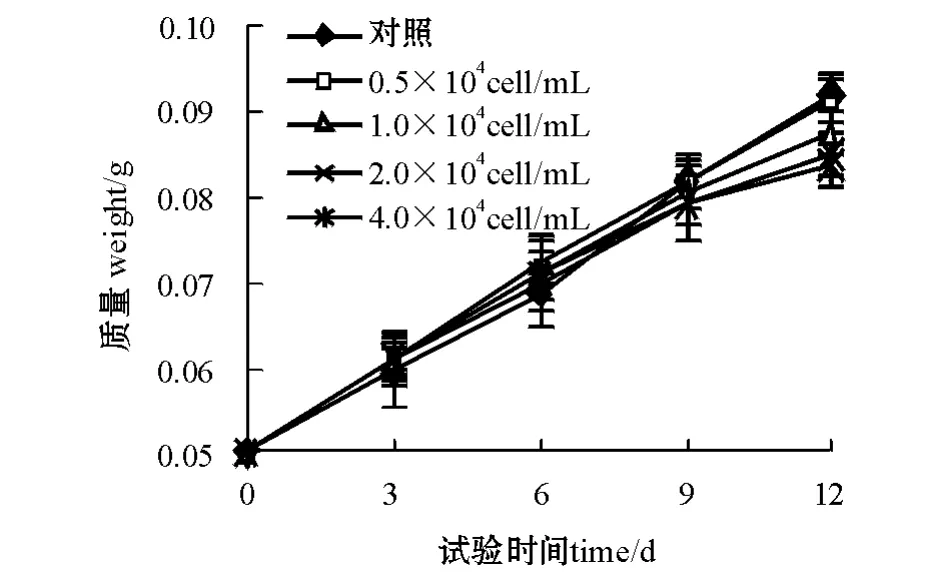
图4 不同初始接种密度的赤潮异弯藻培养液滤液对孔石莼生长的影响Fig.4 Effectsofculture medium filtratesfrom H.akashiwo in diffierent inoculated initial cell density on the growth of U.pertusa
2.3 孔石莼与赤潮异弯藻间的胞内物质交叉培养试验
2.3.1 孔石莼胞内物质对赤潮异弯藻生长的影响不同浓度的孔石莼胞内物质对赤潮异弯藻生长有明显的影响。从图5可见:第12天时,接种孔石莼胞内物质的4个处理组中,除3.33 g/L组赤潮异弯藻的生长受到的抑制不显著外 (P>0.05),其它3组均受到了极显著的抑制 (P<0.01);随着孔石莼胞内物质浓度的增加,胞内物质对赤潮异弯藻生长的抑制作用愈加明显,第12天时,浓度为3.33、6.67、13.33、26.67 g/L的4组孔石莼胞内物质对赤潮异弯藻生长的抑制率分别为4.87%、6.35%、44.80%、69.16%。

图5 不同浓度的孔石莼胞内物质对赤潮异弯藻生长的影响Fig.5 Effects of intracellular products from U.pertusa at diffierent concentrations on the growth of H.akashiwo
2.3.2 赤潮异弯藻胞内物质对孔石莼生长的影响赤潮异弯藻胞内物质对孔石莼生长的影响亦明显。从图6可见:赤潮异弯藻初始接种密度越大,其胞内物质对孔石莼生长的影响就越大;第9天时,赤潮异弯藻胞内物质浓度为 20.0、40.0万个/mL的两组孔石莼的生长受到了极显著的抑制 (P<0.01);第12天时,赤潮异弯藻胞内物质浓度为10.0万个/mL的组孔石莼的生长也受到了极显著的抑制 (P<0.01),浓度为 5.0、10.0、20.0、40.0万个/mL的4组赤潮异弯藻胞内物质对孔石莼生长的抑制率分别为8.57%、20.74%、46.76%、56.09%。
3 讨论
3.1 孔石莼与赤潮异弯藻间的克生关系
克生是指一种植物通过向环境中释放某些化学物质,在其周围形成一个微环境区域,从而抑制或促进该区域内其它植物生长的现象[10]。Nan等[11]研究了孔石莼对8种海洋微藻的克生作用,结果表明,孔石莼对海洋微藻的克生效应是普遍存在的。已有研究表明,孔石莼对赤潮异弯藻的生长存在明显的抑制作用[1,12],但海洋微藻对孔石莼生长的克生作用却少见报道[6],而赤潮异弯藻对孔石莼生长的影响未见报道。本试验结果表明,孔石莼不仅对赤潮异弯藻的生长有明显的抑制作用,赤潮异弯藻对孔石莼的生长亦有明显的抑制作用,随着赤潮异弯藻初始接种密度的增加,抑制作用愈加明显,说明孔石莼与赤潮异弯藻间存在克生效应。

图6 不同浓度的赤潮异弯藻胞内物质对孔石莼生长的影响Fig.6 Effects of intracellular products from H.akashiwo at various concentrations on the growth of U.pertusa
3.2 孔石莼与赤潮异弯藻间的相互作用途径
种群之间的相互作用和相互竞争一般通过两种方式和途径进行,一种是细胞的直接接触抑制,另一种是通过分泌次生物质来完成对其它种群的抑制作用[12]。本试验中,孔石莼培养液滤液和胞内物质对赤潮异弯藻生长均有明显的抑制作用,且随着孔石莼初始接种量和胞内物质浓度的增加,对赤潮异弯藻生长的抑制作用愈加明显。这与前人的报道相似[7,13]。可以推测,孔石莼可以通过分泌次生物质来完成对赤潮异弯藻生长的抑制,而抑制物质存在于藻体和培养液中。微藻培养液滤液和胞内物质对孔石莼生长的影响目前尚未见报道。本试验中发现,赤潮异弯藻培养液滤液和胞内物质对孔石莼的生长亦有明显的抑制作用,且随着赤潮异弯藻初始接种密度和胞内物质浓度的增加,对孔石莼生长的抑制作用愈加明显。可以推测,赤潮异弯藻也可以通过分泌次生物质来抑制孔石莼的生长,而这些抑制物质存在于藻体和培养液中。本试验中观察发现,赤潮异弯藻全部附着在孔石莼上 (图7)。颜天等[14]的研究也证明,赤潮异弯藻是通过细胞的直接接触来抑制其它种群的生长,所以推测,赤潮异弯藻对孔石莼的抑制作用也可能是通过细胞的直接接触完成的。

图7 附着赤潮异弯藻的孔石莼Fig.7 The U.pertusa attached by H.akashiwo
[1]Jin Q,Dong S L.Comparative studies on the allelopathic effects of two different strains of Ulva pertusa on Heterosigma akashiwo and Alexandrium tamarense[J].Journal of Experimental Marine Biology and Ecology,2003,293:41-55.
[2]Nakai S,Inoue Y,Hosomi M,et al.Growth inhibition of blue-green algae by allelopathic effects of macrophytes[J].Water Sci Technol,1999,39:47-53.
[3]蔡恒江,李博,孙禾琳.孔石莼克生作用对赤潮异弯藻生长和抗氧化系统活性的影响[J].海洋环境科学,2010,29(6):859-862.
[4]Gross E M,Meyer H,Schilling G.Release and ecological impact of algicidal hydrolysable polyphenols in Myriophyllum spicatum[J].Phytochemistry,1996,41:133-138.
[5]Fong P,Zedler J B,Donohoe R M.Nitrogen versus phosphorous limitation of algal biomass in shallow coastal lagoons[J].Liminology and Oceanography,1993,38:906-923.
[6]南春容,董双林,金秋.不同磷浓度及脉冲方式下孔石莼与亚新形扁藻间竞争的实验研究[J].青岛海洋大学学报,2003,33(1):29-35.
[7]南春容,张智海,董双林.孔石莼水溶性抽提液抑制3种海洋赤潮微藻的生长[J].环境科学学报,2004,24(4):702-706.
[8]Guillard R R L.Culture of phytoplankton for feeding marine invertebrates[M]//Cultures of Marine Invertebrate Animals.New York:Plenum Press,1975:29-60.
[9]王仁君,唐学玺,冯蕾,等.鼠尾藻对赤潮异弯藻和中肋骨条藻的抑制作用[J].应用生态学报,2006,17(12):2421-2425.
[10]贺锋,陈辉蓉,吴振斌.植物间的相生相克效应[J].植物学通报,1999,16(1):19-27.
[11]Nan C R,Zhang H Z,Zhao G Q.Allelopathic interactions between the macroalga Ulva pertusa and eight microalgal species[J].Journal of Sea Research,2004,52:259-268.
[12]Uchida T,Satorutoda Y,Matsuyama M,et al.Interactions between the red tide dinoflagellates Heterocapsa circularisquama and Gymnodinium mikimotoi in laboratory[J].J Exp Mar Biol Ecol,1999,241:285-299.
[13]王悠,俞志明,宋秀贤,等.共培养体系中石莼和江蓠对赤潮异弯藻生长的影响[J].环境科学,2006,27(2):246-252.
[14]颜天,周名江,傅萌,等.赤潮异弯藻毒性及毒性来源的初步研究[J].海洋与湖沼,2003,34(1):50-55.
