pH和氮素形态对紫花苜蓿根瘤特性的影响
2012-06-04刘晓静齐敏兴张晓磊王巧玲张晓玲李鸿燕
俞 艳,刘晓静,齐敏兴,张晓磊,付 萍,王巧玲,张晓玲,李鸿燕
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
紫花苜蓿(Medicago sativa)素有“牧草之王”的美称,是一种蛋白质含量高的优质豆科牧草。在其生长过程中受到多种因素的影响,土壤pH是主要的因素之一。苜蓿在我国主要分布于北方中性和微酸性土壤中,但其适宜的土壤pH为6.5~7.5。紫花苜蓿接种根瘤菌可以提高其产量和品质[1],但苜蓿根瘤菌一般不耐酸,酸性土壤降低了根瘤菌与宿主植物之间的亲和性,抑制了根瘤菌的存活,致使豆科牧草生物固氮受阻[2,3],同时土壤pH 影响紫花苜蓿根系铁离子的吸收[4]。氮是植物生长发育不可缺少的营养元素,是植物体内许多重要有机化合物的组成成分[5],对植物的生命活动以及产量的形成与品质的优劣均有着极为重要的作用[6]。施氮对紫花苜蓿的早期生长具有积极意义[7]。硝态氮与铵态氮均能被植物吸收,但不同形态的氮素对植物生理特性和生长发育的影响不同[8]。为进一步探讨pH和不同氮素形态对紫花苜蓿根瘤特性的影响,采用砂培方法,通过营养液控制pH梯度和氮素形态,排除其他外部环境的影响,更加客观直接的反应试验结果,以期为紫花苜蓿最适的pH范围和氮素供应提供理论依据。
1 材料和方法
1.1 供试品种
供试苜蓿品种为甘农3号紫花苜蓿(Medicago sativavar.Gannong No.3),由甘肃农业大学草业学院提供。选取大小均匀,颗粒饱满种子,先用95%乙醇浸泡5min,再用0.1%HgCl2溶液灭菌6~10min,然后无菌水冲洗5~6次。
1.2 供试根瘤菌菌株
中华根瘤菌(12531),由甘肃农业大学草业学院提供。将菌株进行平板划线培养,挑起单菌落接种于YMA培养基上,在28℃培养箱中培养72h,用无菌水洗下根瘤菌体,装入无菌三角瓶中。
1.3 营养液配制
Fahraeus无氮植物营养液配制方法:Na2HPO4·12H2O 0.15g,MgSO4·7H2O 0.12g,柠檬酸铁0.005g,CaCl2·2H2O 0.1g,KH2PO40.1g,Gibson微量元素1mLH2O 1 000mLGibson微量元素液:H3BO32.86g,ZnSO4·7H2O 0.22g,CuSO4·5H2O 0.08g,MnSO4·4H2O 2.03g,Na2MoO4·2H2O 1.26g,H2O 1 000mL。
1.4 实验设计
采用砂培方法,选用直径7.0cm、高8.5cm的塑料杯,装入高温灭菌的粗砂230g。每杯播种10粒已消毒的种子,覆盖干沙50g。pH设5、6、7、8、9共5个梯度;设氮素形态为硝态氮和铵态氮2种,以Fahraeus无氮植物营养液为基本营养液,分别以Ca(NO3)2和(NH4)2SO4为氮源配制所需营养液,用HCl和NaOH溶液把营养液pH分别调成5、6、7、8、9,一次性施入。待种子发芽时,每个塑料杯接种新培养的苜蓿根瘤菌液2mL。每6个塑料杯为1个重复,放入水培盒中,每个处理设3次重复,随机排列。营养液每水培盒500mL,使液面保持一致,并标出液面线。实验均在实验室条件下进行,期间每隔4d补充1次蒸馏水,处理60d后测定各项生理指标。
1.5 测定指标与方法
根瘤数 数每个植株的根瘤总数;根瘤重 将摘下的根瘤在电子天平上称鲜重;固氮酶活性 采用乙炔还原法测定[9,10]。称取0.2g的新鲜根瘤置于7mL玻璃瓶中,加盖橡皮塞后,从中吸出0.7mL空气,注入0.7mL乙炔,室温下反应30min,待机器稳定,用微量注射器抽取混合气体25μL注入气相色谱仪(GC)进样柱中,测定C2H2、C2H4峰值。然后,在同样条件下用标准乙烯测定并绘制乙烯的标准曲线,由此计算根瘤样品的固氮酶活性。每个处理3次重复。测定仪器为GC-7890F气相色谱仪,柱温180℃,进样器150℃,FID检测器170℃。气体压力N2为0.3mPa,H2为0.08mPa,空气为0.15mPa。
C2H4水平[μmol/(g·h)]=hx(样品峰面积)×C(标准 C2H4水平,μmol/mL)×V(培养容器体积,mL)/hs(标准 C2H4峰面积)×24.9×t(C2H2反应时间,h)×m(瘤重,g)。
植株根系全氮含量 植株的全氮含量采用浓H2SO4-H2O2法测定[11]。
地上、地下生物量 采用105~110℃杀青30min,70~80℃烘至恒重,称重。
1.6 数据处理
采用Excel 2003进行数据处理和图表绘制,并采用SPSS 16.0进行单因素方差分析(one-way ANOVA)和新复极差法(Duncan法)进行多重比较。
2 结果与分析
2.1 pH和氮素形态对紫花苜蓿根瘤数的影响
根瘤数的多少可以直接反映根瘤菌固氮效率的强弱,结果表明(图1),在其他营养供应充分的条件下,pH和不同氮素形态均对紫花苜蓿根瘤数目有显著影响。在给定的pH范围,对于不同氮素形态处理的紫花苜蓿,均以pH为7时根瘤数最多,过高或过低的pH对结瘤的形成均存在抑制作用。同时,氮素形态的不同也直接影响紫花苜蓿根瘤的形成,铵态氮培养下的根瘤数显著大于硝态氮培养。表明中性pH和铵态氮更有利于紫花苜蓿根瘤的生长与形成。此结果与严君[12]在大豆上的施氮效果一致。
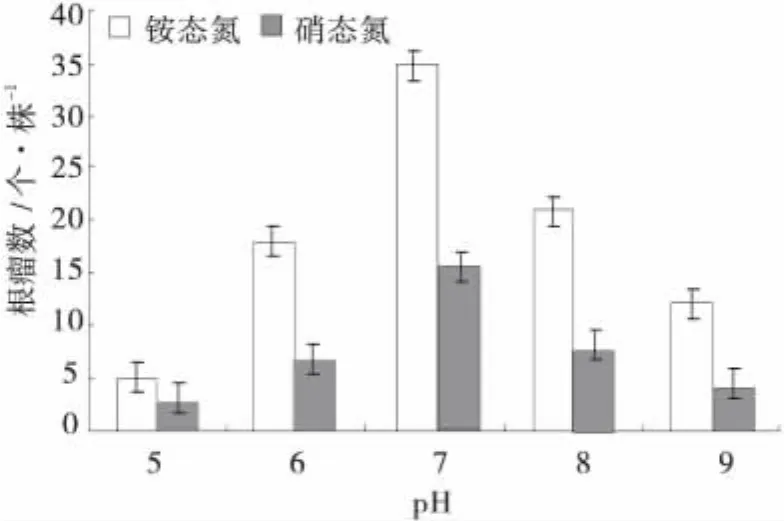
图1 pH和氮素形态下的紫花苜蓿根瘤数Fig.1 Effect of pH value and nitrogen forms on root nodule number of alfalfa
2.2 pH和氮素形态对紫花苜蓿根瘤重的影响
pH和氮素形态对紫花苜蓿根瘤重具有显著影响(图2)。在给定的pH梯度下,不同氮素形态处理的紫花苜蓿,pH均为7时根瘤重达到最大值,低pH和高pH对根瘤重的增大均具有抑制作用。同时,铵态氮培养下的根瘤重显著大于硝态氮。

图2 pH和氮素形态下的紫花苜蓿根瘤重Fig.2 Effect of pH value and nitrogen forms on nodulation of alfalfa
2.3 pH和氮素形态对紫花苜蓿固氮酶活性的影响
铵态氮培养下紫花苜蓿的固氮酶活性要显著高于硝态氮培养(图3),说明铵态氮更有利于紫花苜蓿固氮酶活性的提高。同时,在给定的pH范围内,在pH为7时,2种不同氮素形态培养下紫花苜蓿的固氮酶活性都最高。pH=5和pH=9时,固氮酶活性最低,说明偏酸和偏碱的环境对固氮酶活性均有抑制作用。而处理在pH=6时的固氮酶活性强于pH=8时的固氮酶活性,说明偏酸的环境下固氮酶活性比偏碱环境下更高,表明甘农3号紫花苜蓿对偏酸环境具有一定的耐受性。
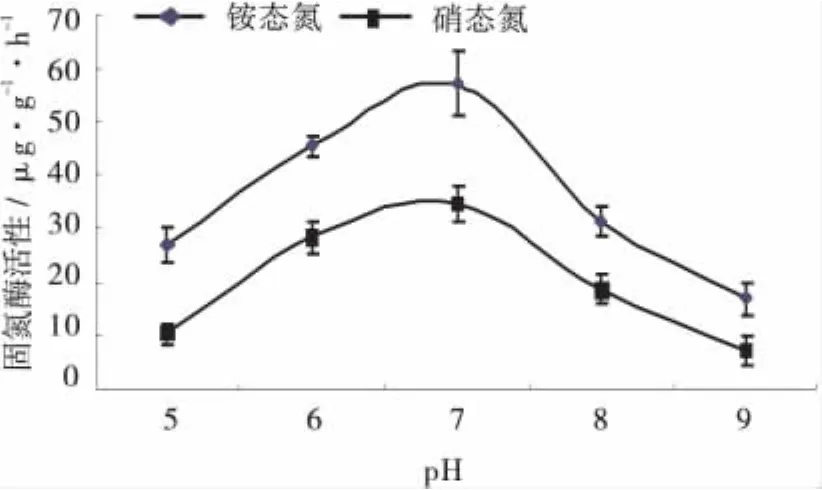
图3 pH和氮素形态下的紫花苜蓿固氮酶活性Fig.3 Effect of pH value and nitrogen forms on nitrogenaseactivity of alfalfa
2.4 pH和氮素形态对紫花苜蓿根系全氮含量的影响
pH和氮素形态对紫花苜蓿根系全氮含量具有显著影响。在5个pH处理中,pH为7时根系全氮含量最高,pH为5时最低(图4)。同时,碱性处理下的根系全氮含量要显著高于酸性处理,说明这个处理对偏碱性环境有一定的耐受性,这可能与根瘤菌产酸的生理特性有关,由于根瘤菌在共生固氮过程中分解营养物质产生酸,降低了根际周围的pH。从氮素形态对其影响来看,铵态氮培养下紫花苜蓿根系全氮含量要显著高于硝态氮培养,说明铵态氮更有利于紫花苜蓿固氮酶活性的提高。
2.5 pH和氮素形态对紫花苜蓿地上、地下生物量的影响
对不同pH和氮素形态处理下的植株生物量进行方差分析,各个处理间差异显著(表1)。pH为7时,紫花苜蓿地上和地下生物量均为最高。pH小于7时,生物量随pH的增加而增加,pH大于7时,生物量随pH的增加而减少。pH大于7时的地上和地下生物量均高于pH值小于7时,这可能是由于在根瘤菌与植株的共生过程中,分离了其他营养物质产生酸,降低了根际周围的pH值,从而减弱了pH对根瘤菌侵染的抑制作用。同时,铵态氮处理下的植株地上和地下生物量都高于硝态氮处理,表明铵态氮更有利于紫花苜蓿植株生物量的积累。司江英等[8]的研究也表明,以NH4+-N为氮源的白羽扇豆生物量积累和根冠比也高于NO3--N。
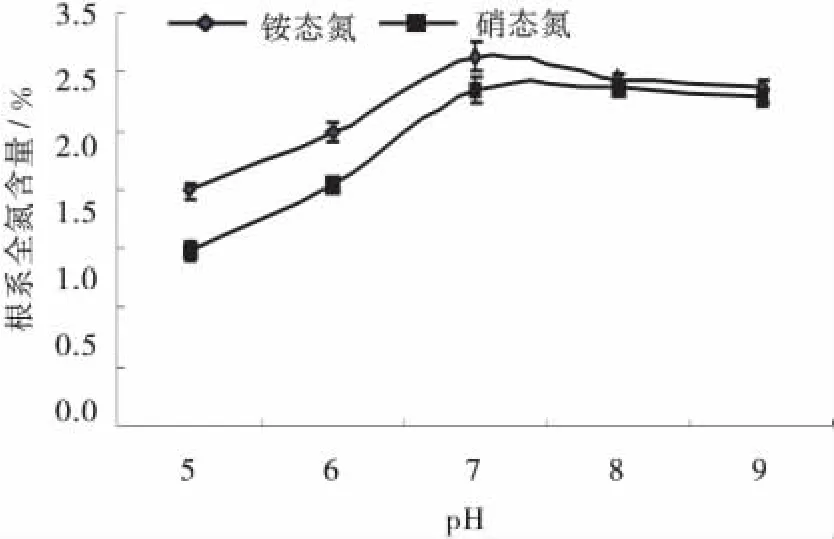
图4 pH值和氮素形态下的紫花苜蓿根系全氮含量Fig.4 Effect of pH value and nitrogen forms on root total nitrogen content of alfalfa

表1 pH值和氮素形态对紫花苜蓿地上、地下生物量的影响Table 1 Effects of pH value and nitrogen forms on aboveground and underground biomass of alfalfa
3 讨论
研究结果表明,紫花苜蓿是对pH胁迫敏感的植物,过低或过高的pH对苜蓿与根瘤菌的共生固氮效果具有抑制作用。氮素是植物体内蛋白质、核酸、叶绿素和一些激素等的重要组成部分,是限制植物生长和产量形成的重要因素[12,13]。紫花苜蓿与根瘤菌的有效共生作用除了受品种、菌系影响外,往往受到生态环境与肥力的影响[14]。总之pH为7或略微偏碱性条件较适宜紫花苜蓿的生长,苜蓿对碱性条件的耐受性更强于酸性条件。根瘤菌的生长有一个最适的pH范围,pH过高或过低时,根瘤菌生长速率较低,导致总根瘤数相对较少。关于低pH抑制根瘤菌和苜蓿根生长的机理,可能是由于低pH导致信号分子(NF)量减少,降低了信号分子的活性并使根瘤菌对植物的信号分子的修饰、分解作用受到影响,甚至抑制nod基因的表达,降低了根瘤菌对苜蓿根毛的侵染能力;在强酸条件下,苜蓿根系质膜H+-ATPase酶的活性会发生变化,以减轻苜蓿根系受到伤害[15]。同时,低pH胁迫下,苜蓿对水分和养分的吸收能力下降,致使苜蓿的光合作用降低,影响结瘤过程中根瘤菌糖类和ATP的供应,从而导致苜蓿根系结瘤减少和生长受阻。而在高pH下紫花苜蓿的结瘤固氮强于低pH下,可能与苜蓿根瘤菌产酸的生理特性有关,降低了根际周围的pH,使紫花苜蓿的生长状况比实际pH梯度时生长的好,相关机理还有待进一步研究。
同时在本研究中,铵态氮下培养的紫花苜蓿根瘤数、根瘤重、固氮酶活性、根系全氮含量和生物量均高于硝态氮下培养。分析原因,一方面是硝态氮使宿主根毛形成受阻遏或弯曲,硝态氮在呼吸消耗过程中减少了光合产物向根瘤的运输,延迟了根瘤的形成和增大,从而进一步抑制固氮酶活性和根瘤固氮[16-19],另一方面由于同化硝态氮的关键酶-NR与固氮酶对钼具有竞争性,减少了钼铁蛋白的形成,从而降低了共生固氮的固氮酶活性[17]。同时严君[12],宋海星[17]研究也表明,NO3--N与NH4+-N均不同程度地抑制根瘤固氮酶活性,但NH4+-N对根瘤固氮的抑制作用明显低于NO3--N。而具体机理还有待进一步研究。
[1]宁国赞,李元芳,刘惠琴,等.紫花苜蓿接种根瘤菌的效果[J].草业学报,1992,9(1):50-51.
[2]Buerkert A,Cassman K G,Piedra R,et al.Soil acidity and liming effects on stand,nodulation,and yield of common bean[J].Agronomy Journal,1990,(4):749-754.
[3]Hebb D M,Richardson A E,Reid R.PCR as an ecological tool to determine the establishment and persistence of Rhizobium strains introduced into the field as a seed inoculant[J].Aust J Agric Res,1998,49:923-934.
[4]李剑锋,孙吉雄,安渊,等.不同pH值和Fe2+胁迫对紫花苜蓿幼苗根系Fe3+还原力的影响[J].草原与草坪,2009(1):7-10.
[5]陈晓远,高志红,李玉华.供氮形态和水分胁迫对苗期水稻吸收氮素营养的影响[J].华北农学报,2008,23(1):163-167.
[6]曾庆飞,贾志宽,韩清芳,等.施肥对苜蓿生产性能及品质影响的研究综述[J].草业学报,2007,22(7):8.
[7]蒯佳林,刘晓静,李文卿.不同氮素水平对接种根瘤菌紫花苜蓿生长特性的影响[J].草原与草坪,2011,31(3):56-59.
[8]司江英,汪晓丽,陈冬梅.不同pH和氮素形态对作物幼苗生长的影响[J].扬州大学学报(农业与生命科学版),2007,28(3):68-71.
[9]姚拓,张德罡,胡自治.高寒地区燕麦根际联合固氮菌研究Ⅰ:固氮菌分离及鉴定[J].草业学报,2004,13:106-111.
[10]Tang C,Hinsinger P J,Drevon J,et al.Phosphorus deficiency impairs early nodule functioning and enhances proton release in Roots of Medicago truncatula-l[J].Annals of Botany,2001,88:131-138.
[11]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:147-170.
[12]严君,韩晓增,王守宇,等.不同形态氮对大豆根瘤生长及固氮的影响[J].大豆科学,2009,28(4):675.
[13]孙曦.植物营养原理[M].北京:中国农业出版社,1997.
[14]范富,张庆国,张永亮,等.施肥对紫花苜蓿根瘤的影响[J].农业科技通报,2006(7):96-98.
[15]郭奇梅,孙吉雄,安渊,等.酸和铁胁迫对紫花苜蓿根系质膜 H+-ATPase活性的影响[J].草原与草坪,2009,134(3):12-15.
[16]王树起,韩晓增,乔云发,等.施氮对大豆根瘤生长和结瘤固氮的影响[J].华北农学报,2009,24(2):176-179.
[17]宋海星,申斯乐,马淑英,等.硝态氮和氨态氮对大豆根瘤固氮的影响[J].大豆科学,1997,16(4):283-286.
[18]邹春琴,王晓凤,张福锁.铵态氮抑制向日葵生长的作用机制初步探讨[J].植物营养与肥料学报,2004,10(1):82-85.
[19]甘银波,陈静.大豆不同生长阶段施用氮肥对生长、结瘤及产量的影响[J].大豆科学,1998,17(4):45-49.
