三叶草根际溶磷菌溶磷及分泌IAA能力测定
2012-06-04张英,朱颖,姚拓
张 英,朱 颖,姚 拓
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.青海大学农牧学院 草业科学系,青海 西宁 810016)
植物根际中存在着大量的能够溶解磷矿粉的微生物[1-4]。长期以来,国内外的学者对溶磷微生物的种类和能力开展了广泛的研究[5-11],取得了一些开拓性成果,但多年的实践结果也表明,溶磷微生物的实际应用效果并不理想,很多菌株在实验室条件下表现出明显溶磷能力,但应用到田间溶磷效果却不明显,难以适应不同的生长环境[12,13]。所以,从特定地区和植物根际筛选溶磷、适应能力强,兼有其他优良特性的菌株有着重要的意义。
白三叶(Trifolium repens)和红三叶(Trifolium pratense)为豆科车轴草属[14]多年生牧草。红三叶是优质的多年生牧草,同时又是良好的蜜源植物及绿肥植物,是优良的园林绿化及水土保持植物资源,植株中富含异黄酮类化合物,具有抗肿瘤(胃癌、乳腺癌),防治骨质疏松、改善更年期综合症等作用[15],是一种极有开发前景的天然药材,是园林绿化、水土保持和水源涵养地建设的优良草本植物。
目前,有关车轴草属植物根际溶磷菌的研究报道较少。对分离自白三叶和红三叶草根际的10株溶磷细菌的溶磷能力和分泌IAA能力进行测定,筛选优良菌株,为溶磷菌菌株特性的研究和菌肥的开发利用提供优良用菌株资源。
1 材料和方法
1.1 菌株来源
供试菌株为前期[16-18]在兰州、定西、酒泉地区白三叶和红三叶根际分离、筛选获得的10株溶磷细菌(菌株编号为:ls1-3、ls1-5、ls2-11、ls2-12、ls2-16、ls3-1、ls3-2、ls3-5、lhs11、lhs4)。
1.2 培养基及试剂
LB培养基[19],PKO 无机磷培养基[20],蒙金娜有机磷培养基[17],King培养基[21],Spot比色液和 S2比色液[22]。
1.3 溶磷能力测定
1.3.1 定性测定 将LB斜面培养基中保存的菌株,活化后点接种于PKO无机磷和蒙金娜有机磷平板上,28℃恒温培养,第10d后观察、测量各菌株形成的溶磷圈大小。根据溶磷圈直径(D)和菌落直径(d)比值(D/d)初步确定菌株溶磷能力。
1.3.2 定量测定 将50mL液体PKO无机磷(或蒙金娜有机磷)培养基装入150mL三角瓶,121℃灭菌20min,冷却后,分别将500μL各待测菌株的菌悬液(108cfu/mL)接种至三角瓶中。每菌株设3个重复,以基础培养基(不接种菌株)为对照。将上述三角瓶置于28℃、160r/min摇床培养10d后,用酸度计测定培养液pH值。将培养液10 000r/min、4℃离心15 min,取上清液,用钼锑抗比色法测定有效磷增量(扣除对照后的值(mg/L))[23]。
1.4 分泌IAA能力测定
1.4.1 定性测定 将50mL液体King培养基装于150mL三角瓶,121℃灭菌20min,冷却后分别将500 μL各待测菌株菌悬液(108cfu/mL)接种至三角瓶中。每菌株设3个重复,以基础培养基(不接种菌株)为对照。将三角瓶置于28℃,129r/min摇床培养12d,取菌株悬浮液50μL滴置于白色陶瓷板上,同时加50 μL Spot比色液,对照只在比色液中加50μL 10mg/L的植物生长激素(3-吲哚乙酸);将白色瓷板置室温下,在15min内观察其颜色变化,颜色变粉红者表示能分泌IAA,颜色越深表示分泌IAA能力越强;不变色为阴性,即不分泌IAA[22]。
1.4.2 定量测定 取上述培养12d的培养液10 000 r/min、4℃离心10min,取上清液1mL加1mL S2比色液在黑暗下静置30min,迅速用分光光度计比色(波长530nm)[22],标准曲线用纯3-吲哚乙酸制作。
1.5 数据分析
数据处理采用SPSS 16.0软件,多重比较采用LSD法。
2 结果与分析
2.1 溶磷能力的测定
溶磷圈直径(D)、菌落生长直径(d)及比值(D/d)是表征溶磷菌相对溶磷能力的一个指标,可初步确定溶磷菌株的溶磷效果。对各菌株在PKO无机磷和蒙金娜有机磷固体培养基培养10d,用溶磷圈法分别测定了各菌株的D/d值(图1、2),结果表明,各菌株的D/d值大小差异显著(P<0.05)。在PKO无机磷培养基上,各菌株的D/d值在1.07~1.52,其中,菌株ls1-3的 D/d 值 (1.52)最大,菌 株ls3-2 的 D/d 值(1.07)最小,菌株ls2-11,ls2-16和ls3-2的溶磷透明圈不明显。在蒙金娜有机磷培养基上,各菌株的D/d值在1.00~1.45,其中,菌株lhs1的D/d值(1.45)最大,菌株ls1-3、ls1-5、ls2-11、ls2-13的 D/d值为1,并发现各菌株无明显的溶磷透明圈。

图1 菌株在PKO培养基上的D/dFig.1 D/d vallue in PKO culture medium by phosphate-solub ilizing bacteria
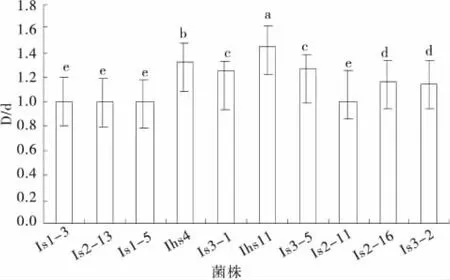
图1 菌株在蒙金娜培养基上的D/dFig.2 D/d vallue in Mongoli culture medium by phosphate-solub ilizing bacteria
溶磷圈法只能定性测定各菌株溶磷能力。为进一步测定各菌株溶磷性强弱,将各菌株单独接种于PKO无机磷和蒙金娜有机磷液体培养基中10d后测定各上清液有效磷增量,结果各菌株都具有溶解磷酸三钙能力(表1),并且差异显著(P<0.01)。各菌株在PKO无机磷培养液中有效磷增量在106.63~666.01 mg/L,其中,菌株ls1-3有效磷增量最大,有效磷增量大于 500mg/L 的菌株有 4 株(ls1-3、1s1-5、ls2-13、lhs4),占溶磷细菌总数40%。各菌株在蒙金娜有机磷培养液中的有效磷增量在0.32~58.42mg/L,其中,菌株lhs11有效磷增量(58.42mg/L)最大,菌株lhs4有效磷增量(35.08mg/L)次之,有效磷增量小于3mg/L的菌株有4株(ls2-11、1s2-13、ls2-16、ls3-2),并有2株菌株(ls1-3、1s1-5)不表现溶磷有机磷的能力。各菌株对不同磷源的分解能力均不同,菌株lhs11既能溶解无机磷(PKO培养液的有效磷增量为179.11 mg/L),又能溶解有机磷(蒙金娜培养液的有效磷增量为58.42mg/L),但溶磷的能力差异较大;菌株ls2-13溶解无机磷(PKO培养液的有效磷增量为593.52 mg/L)的能力较强,但溶解有机磷(蒙金娜培养液的有效磷增量为0.46mg/L)的能力较弱;菌株ls1-3溶解无机磷(PKO培养液的有效磷增量为666.01mg/L)的能力很强,但无溶解有机磷的能力。
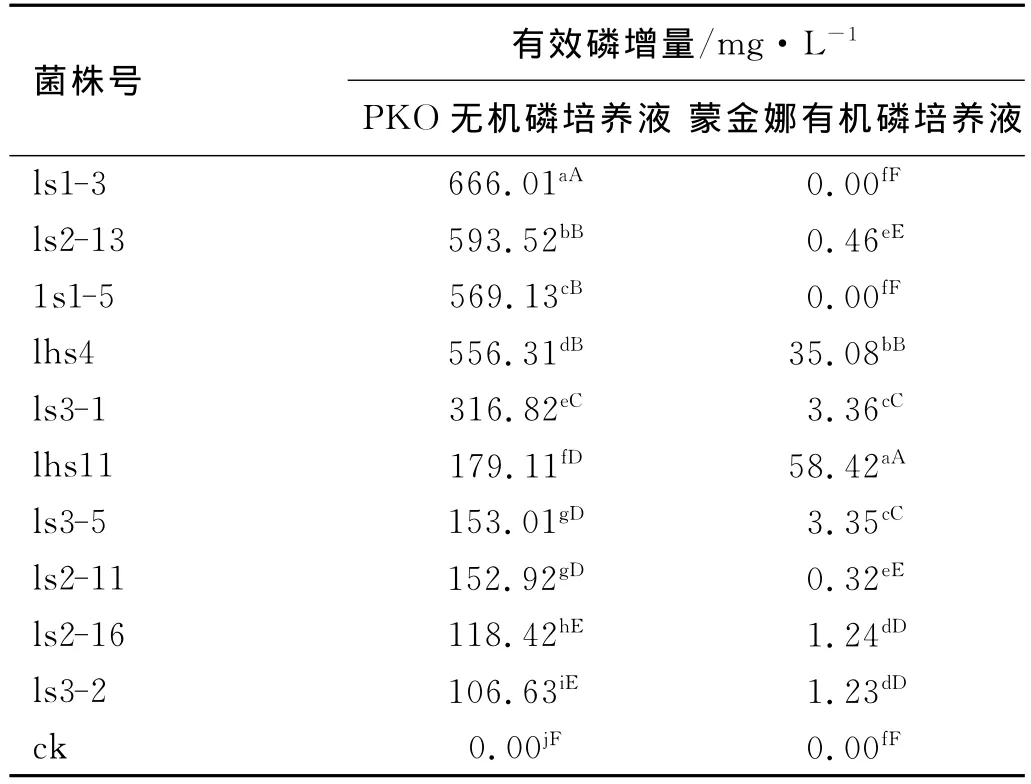
表1 各菌株在PKO无机磷和蒙金娜有机磷培养液中的有效磷增量Table 1 Available phosphorus increased on PKO and MENG Jin-na culture medium
2.2 分泌IAA能力测定
各菌株用King培养基摇床培养12d,定性和定量测定各菌株IAA的能力,结果表明,各菌株IAA的能力和数量差异显著(P<0.01)(表2)。测试菌株中7个菌株具有IAA的能力,占供试菌株数的70%,分泌量在0.36~20.39mg/L,其中ls3-5分泌能力最强,分泌量(20.39μg/mL)也最大。而菌株ls2-16,ls3-2和ls2-11均无分泌IAA的能力。定性测定中,若显色反应颜色越深,说明菌株分泌IAA能力越强,反之越弱;若无颜色反应,说明这些菌株没有分泌IAA能力。为进一步确定各菌株分泌IAA的能力,又进行了S2法比色定量测定,测定的结果与定性测定结果一致。
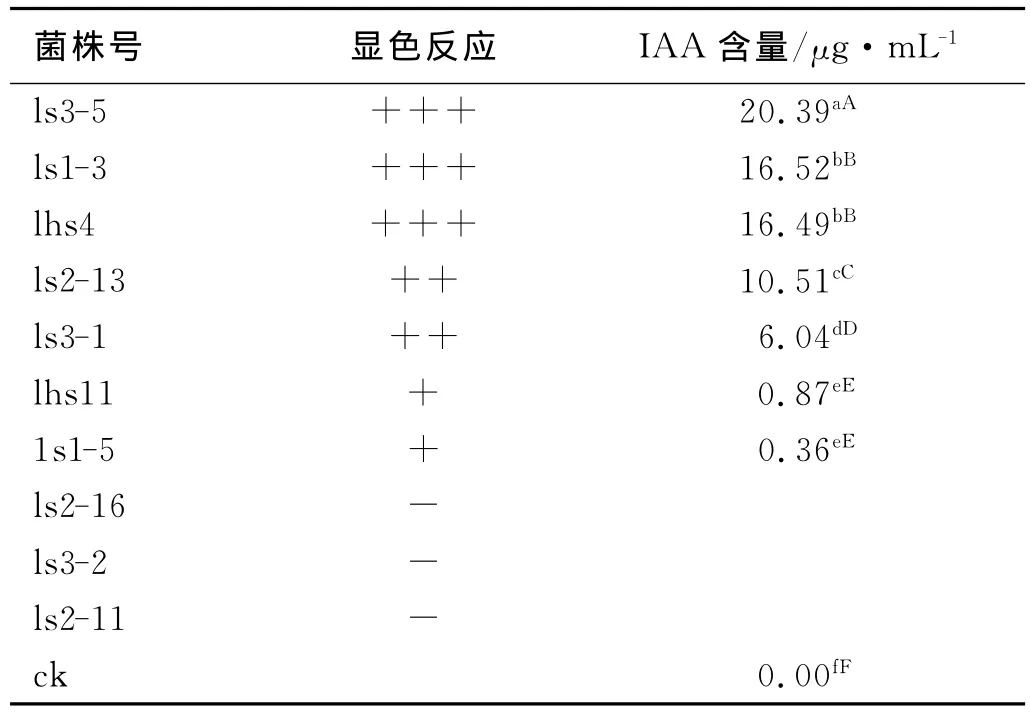
表2 溶磷菌King培养基中分泌IAA量Table 2 Concentration of IAA secreted by phosphatesolubilizing bacteria in King culture medium
3 讨论
植物根际存在很多种溶磷菌,但各菌株的溶磷能力有较大的差异。尹瑞林[24]从土壤中分离出的265株细菌的溶磷能力平均为每克土壤溶磷2~30mg,其中,巨大芽孢杆菌、节细菌、黄杆菌、欧文氏菌及假单胞菌的溶磷能力较强,其次为产碱菌、多黏芽孢杆菌和枯草芽孢杆菌。Sundara等[25]利用磷酸三钙为磷源,经过14d的培养后发现芽孢杆菌和埃希氏菌的溶磷能力较强。随后,Paul和Sundara[26]进一步测定从豆科植物根际分离出来的12种芽孢杆菌溶解磷酸三钙的能力,发现虽然是相同属的细菌,但是Bacillus meaateriu的溶磷能力明显高于Bacillus brevise。林启美等[27]测定假单胞菌属培养7d时溶磷圈D/d值1.00~3.50;芽孢杆菌属培养7d溶磷圈的D/d值1.14~1.43;另外,发现以磷矿粉为唯一磷源培养解磷细菌,5d后培养液中可溶性磷的含量最高为117.3mg/L。冯瑞章等[28]测定定西苜蓿根际溶磷细菌菌株Dm84培养8d后,有效磷增量为227.1mg/L。Kobus[29]研究认为菌株D/d值的变化不仅与时间有关系,还与菌株代谢物种类、释放快慢及代谢产物在培养基上的蔓延程度等有关。此次研究测定供试菌株的溶磷能力差异较大,在PKO无机磷培养基上,各菌株的D/d值在1.07~1.52;在蒙金娜有机磷培养基上,各菌株的D/d值在1.00~1.45。各菌株在PKO无机磷培养液中的有效磷增量在106.63~666.01mg/L,菌株ls1-3有效磷增量最大;各菌株在蒙金娜有机磷培养液中的有效磷增量在0.32~58.42mg/L,其中,菌株lhs11有效磷增量最大。各菌株对不同磷源的分解能力均不同,菌株lhs11既能溶解无机磷,又能溶解有机磷,但溶磷的能力差异较大;菌株ls2-13溶解无机磷的能力较强,但溶解有机磷的能力较弱;菌株ls1-3溶解无机磷的能力很强,但无溶解有机磷的能力。溶磷能力首先取决于菌株本身的特性,另外,菌株的溶磷机理也非常复杂[30-32],如分泌质子、有机酸和其他物质的数量和种类,其次,与难溶性磷酸盐的结构和组成成分有关系,本研究各菌株的溶磷机理有待进一步研究。
植物根际的很多菌株都具有分泌植物生长激素(IAA)能力[33,34],分泌量差异较大。Malik等[35]用比色法测定了巴基斯坦盐碱地小麦等植物根际固氮菌株分泌IAA能力,其在5.11~35.70mg/L。本研究各菌株IAA能力进行定性和定量测定结果一致,各菌株分泌IAA量在0.36~20.39mg/L,略低于 Malik的测定结果。出现这种现象的原因可能与菌株种类、生理和生态特性及培养条件等因素有关。比色法只是初步定量研究菌株分泌IAA范围,若要准确反映各菌株分泌IAA含量,需进一步测定。
[1]林启美,赵小蓉,孙焱鑫,等.四种不同生态环境中解磷细菌的数量及种群分布[J].土壤与环境,2000,9(1):34-37.
[2]赵小蓉,林启美,孙焱鑫,等.小麦根际与非根际解磷细菌的分布[J].华北农学报,2001,16(1):111-115.
[3]李振东,陈秀蓉,李鹏.紫花针茅内生细菌的分离与鉴定[J].草原与草坪,2011(1):8-12.
[4]张晓波,赵艳.结缕草根际联合固氮菌的分离及初步鉴定[J].草原与草坪,2011(1):37-41.
[5]陈哲,吴敏娜,秦红灵,等.土壤微生物溶磷分子机理研究进展[J].土壤学报,2009,46(5):925-931.
[6]陈春.植物根围促生菌的研究进展及在林业上的应用[J].山西林业科技,2010,39(6):33-37.
[7]康贻军,程洁,梅丽娟,等.植物根际促生菌的筛选及鉴定[J].微生物学报,2010,50(7):853-861.
[8]Ahmad F,Ahmad I,Khan M S.Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J].Microbiological Research,2008,163(2):173-181.
[9]Karlidag H,Esitken A,Turan M,et al.Effects of root in-oculation of plant growth promoting rhizobacteria (PGPR)on yield,growth and nutrient element contents of leaves of apple[J].Scientia Horticulturae,2007,114:16-20.
[10]Orhan E,Esitken A,Ercisli S,et al.Effects of plant growth promoting rhizobacteria (PGPR)on yield,growth and nutrient contents in organically growing raspberry[J].Scientia Horticulturae,2006,110:38-43.
[11]刘青海,姚拓,马从,等.6株溶磷菌和4株固氮菌混合培养条件的研究[J].草原与草坪,2011(6):1-6.
[12]Goldstein A H,Rogers R D,Mesd G.Mining by microbe[J].Bio-Technol,1993,11:1250-1254.
[13]Gyaneshwar P,Naresh K G,Parekh L I,et al.Role of soil microorganisms in improving P nutrition of plants[J].Plant and Soil,2002,245:83-93.
[14]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1975:1012-1013.
[15]Peter H M,Ronald B.Isoflavones from red clover(Promensil)significantly reduce menopausal hot flush symptoms compared with placebo[J].Maturitas,2002,42:187-193.
[16]李玉娥,姚拓,朱颖,等.兰州地区苜蓿和红豆草根际溶磷菌筛选及菌株部分特性研究[J].中国草地学报,2009,31(1):45-50.
[17]朱颖,姚拓,李玉娥,等.红三叶根际溶磷菌分离及其溶磷机制初探[J].草地学报,2009,17(2):259-263.
[18]朱颖.三叶草根际溶磷特性及其促生效果研究[D].兰州:甘肃农业大学,2009:5.
[19]李凤霞,张德罡,姚拓.高寒地区燕麦根际高效PGPR菌培养条件研究[J].甘肃农业大学学报,2004,39(3):316-320.
[20]Hafeez F Y,Malik K A.Manual on Biofertilizer Technology[M].Pakistan:National Institute for Biotechnology and Genetic Engineering,2000.
[21]姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004,13(3):85-90.
[22]姚拓.饲用燕麦和小麦根际促生菌特性研究及其生物菌肥初步研制[D].兰州:甘肃农业大学,2002.
[23]Smith K P,Goodman R M.Host variation for interactions with beneficial plant associated microbes[J].Annal Review of Phytopathology,1999,96:4786-4790.
[24]尹瑞林.我国旱地土壤溶磷微生物[M].土壤,1988,20(5):243-246..
[25]Sundara Rao W V B,Sinha M K.Phosphate dissolving microorganisms in the rhizosphere and soil India[J].Agric Sci,1963,33(4):272-278.
[26]Paul N B,Sundara Rao W V B.Phosphate-dissolving bacteria in the rhizosphere of some cultivated legumes[J].Plant and Soil,1971,35:127-132.
[27]林启美,饶正华,孙焱鑫,等.一株胶质芽孢杆菌RGBc13的解磷解钾作用[J].华北农学报,2000,15(4):116-119.
[28]冯瑞章,姚拓,周万海,等.溶磷菌和固氮菌溶解磷矿粉时的互作效应[J].生态学报,2006,26(8):2764-2769.
[29]Kobus J.The distribution of microorganisms mobilizing phosphorus in different soil[J].Acta Microbiology of Polish,1962,11:255-264.
[30]赵小蓉,林启美,李保国.微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J].微生物学杂志,2003,23(3):5-7.
[31]王光华,周可琴,金剑.不同碳源对三种溶磷真菌溶解磷矿粉能力的影响[J].生态学杂志,2004,23(2):32-36.
[32]叶震,陈秀蓉,杨淑君.东祁连山高寒植被土壤解磷菌筛选及其解磷能力的初步研究[J].草原与草坪,2010(5):6-10.
[33]Esitken A,Yildiz H E,Ercisli S,et al.Effects of plant growth promoting bacteria(PGPB)on yield,growth and nutrient contents of organically grown strawberry[J].Sci Hortic-Amsterdam,2010,124:62-66.
[34]Banchio E,Bogino P C,Zygadlo J,et al.Plant growth promoting rhizobacteria improve growth and essential oil yield inOriganum majoranaL[J].Biochem Syst Ecol,2008,36:766-771.
[35]Malik K A,Rasul G,Hassan U,et al.Role of N2Fixation and Growth Hormones Producing Bacteria in Improving Growth of Wheat and Rice.In:Proceedings 6th int.Symp.On“Nitrogen Fixation with Nonlegumes”[C].Ismailia:Egypt,1994:409-422.
