青稞酒发酵过程中生物胺动态变化
2012-06-01杜木英陈宗道阚建全JuditBECZNERAgnesBARATHAnnaHALASZ
杜木英,陈宗道,阚建全,Judit BECZNER,Agnes BARATH,Anna HALASZ
(1.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,西南大学食品科学学院,重庆 400715;2. Central Food Research Institute, Budapest H-1022, Hungary)
青稞酒发酵过程中生物胺动态变化
杜木英1,陈宗道1,阚建全1,Judit BECZNER2,Agnes BARATH2,Anna HALASZ2
(1.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,西南大学食品科学学院,重庆 400715;2. Central Food Research Institute, Budapest H-1022, Hungary)
对青稞酒发酵过程中生物胺的动态变化规律进行研究。利用氨基酸自动分析液相色谱法测定青稞酒不同发酵阶段中7种生物胺的含量,来评价发酵环境以及控制合理发酵过程和发酵终产物的质量。结果表明:青稞原料中不含组胺,但是青稞酒醅及成品青稞酒中都含有组胺。传统发酵和多菌种发酵两种发酵方式青稞酒的生物胺含量变化规律是:腐胺及胍丁胺的含量变化随着发酵的进行呈下降趋势;组胺及酪胺的含量随发酵进程逐渐上升,尤其是酪胺,上升趋势明显,多菌种发酵由2.98μg/g上升至5.36μg/g,传统发酵由5.97μg/g 上升至11.67μg/g。其余各种生物胺含量变化不明显,发酵过程的生物胺总量变化也不显著。本实验检测的青稞酒醅中的生物胺总量范围在53.44~72.56μg/g,不存在生物胺安全问题。
青稞酒;发酵;生物胺变化
以青稞为主要原料酿造的青稞酒是青藏高原的特色饮品,酒味酸甜,酒香浓郁,类似内地的米酒或醪糟酒,初饮有点甘苦、辛辣,但咽下后顿觉有余香、回味,不伤胃,口不干,醒酒快,有营养,口感好的特点,深受广大藏族人民的喜爱。
生物胺是一类碱性含氮化合物,广泛地存在于葡萄酒、啤酒等发酵酒中[1-4]。当机体摄入高浓度的生物胺后,将产生一系列应激反应,可能引起头痛、呼吸紊乱、心悸等不良症状,严重情况下,可以引起大脑出血,甚至死亡。哺乳动物的肠道和消化道具有一定的解毒功能,可以消除饮食中摄入的微量生物胺的毒性,在酶的作用下单胺或多胺的氨基被氧化,从而达到解毒目的。但酒类发酵食品中的酒精和乙醛能抑制这些酶的活性,从而降低脱毒效率。因此,生物胺从食品安全及毒性毒理角度来说,都是比较重要的成分[5-10]。生物胺在中外传统发酵食品中含量也越来越受到关注[11-16],但是有关青稞酒中生物胺种类和含量的报道目前还缺乏。生物胺分析方法包括比色法、氨基酸分析法、色谱法、毛细管区带电泳法[17-23]。本实验利用氨基酸自动分析液相色谱法测定青稞酒不同发酵阶段中7种生物胺的含量,从生物胺的角度考察青稞酒的安全性,以期对青稞酒的安全发酵起到一定指导作用。
1 材料与方法
1.1 材料与试剂
青稞:藏青320,由西藏龙湖工贸有限公司提供。青稞酒传统优良酒曲,采购于西藏拉萨附近的藏民家及附近作坊,酒曲采集后,立即用无菌的塑料袋包装后置于冰袋中运输,置于实验室4℃冰箱中保藏备用。多菌种曲:实验室自制的米根霉纯种曲和酵母固体曲复配而成。
腐胺(putrescine,Put)、组胺(histamine,Hist)、尸胺(cadaverine,Cad)、亚精胺(spermidine,Spd)、胍丁胺(agmatine,Agm)、精胺(spermine,Sper)、酪胺(tyramine,Tyrm) 美国Sigma公司;高氯酸、盐酸、柠檬酸钾(色谱纯) 成都市科龙化工试剂厂;实验用水均为超纯水。
1.2 仪器与设备
LC 2000氨基酸自动分析仪(包括色谱系统、自动进样系统、检测系统、控制系统、Shimadzu CR-2AX记录和数据处理系统) 德国Biotronik公司;Dowex W50x8阳离子交换树脂柱 美国Dow化学公司。
1.3 青稞酒酿造工艺流程
1.3.1 传统青稞酒的酿造工艺流程
青稞→浸泡→蒸煮→摊凉→拌入青稞酒传统酒曲(原料青稞质量的0.4%~0.5%)→28~30℃糖化发酵72h→青稞酒醅→加凉开水浸泡4h以上→过滤→青稞酒
1.3.2 多菌种发酵青稞酒
酒曲用多菌种曲接种,用量为原料青稞质量的5%,其余步骤同传统发酵。
1.4 两种发酵方式发酵青稞酒
采用传统酒曲发酵与接种多菌种曲发酵,在发酵期间,每隔12h均匀取样,用组织粉碎机粉碎,作为实验的样品,3次重复。
1.4.1 样品处理
固态样品:取10g粉碎后的样品,用0.6mol/L的高氯酸提取两次,每次25mL,合并提取液,上已处理好的阳离子交换树脂柱,除去游离氨基酸并浓缩样品。洗出液旋转蒸发至近干,残渣溶解于0.1mL 0.01mol/L HCl中,过0.45μm微孔滤膜,供上机分析测定。
液态样品:液体样品不经过萃取处理,直接上柱除杂和浓缩,其他步骤同固体样品处理后,供上机分析测定。
1.4.2 色谱条件
色谱柱:BTC3118阳离子交换树脂柱(K+型,0.4cm× 10cm),流动相:柠檬酸钾缓冲溶液,柱温:67℃,流速40mL/h,检测波长570nm。
洗脱程序:采用3种不同pH值和离子浓度的缓冲溶液洗脱,共6个步骤:注入样品(上样),用pH5.8的柠檬酸钾缓冲液(0.4mol/L)洗脱3min;用pH5.65的柠檬酸钾缓冲液(1.3mol/L)洗脱12min;继续用pH5.65的柠檬酸钾缓冲液(1.3mol/L)洗脱8min后,淋出液开始与茚三酮溶液产生颜色反应;用pH5.43柠檬酸钾缓冲液(2.5mol/L)洗脱40min;0.6mol/L KOH活化再生柱子;用pH5.8柠檬酸钾缓冲液(0.4mol/L)洗脱平衡20min。
1.4.3 微生物检测方法
菌落总数测定参照GB 4789.2—2010《食品卫生微生物学检验 菌落总数测定》[24];霉菌和酵母测定参照GB 4789.15—2010《食品微生物学检验 霉菌和酵母计数》[25];大肠菌群测定参照GB 4789.3—2010《食品微生物学检验 大肠菌群计数》[26]。致病菌:沙门氏菌测定参照GB 4789.4—2010《食品微生物学检验 沙门氏菌检验》[27];志贺氏菌测定参照GB 4789.5—2010《食品卫生微生物学检验 志贺氏菌检验》[28];金黄色葡萄球菌测定参照GB 4789.10—2010《食品微生物学检验 金黄色葡萄球菌检验》[29];乳酸菌测定参照GB/T 4789.35—2010《食品微生物学检验 乳酸菌检验》[30];肠杆菌测定:在紫红胆汁葡萄糖琼脂(VRBG-Violet Red Bile Glucose Agar, CM485,Oxoid, England)上,37℃条件下培养2d后计数。
1.4.4 数据处理与分析
所有的实验数据都是3次发酵实验的平均值,并用Origin8.5作图。
2 结果与分析
2.1 青稞酒发酵过程中生物胺总量的变化
发酵酒醅按照1.4.1节预处理后,选用不同pH值和离子浓度的缓冲溶液洗脱程序,结果较为理想,7种生物胺色谱图较为理想,分离效果好,基本能达到基线分离,且理论塔板数能达到1500左右。
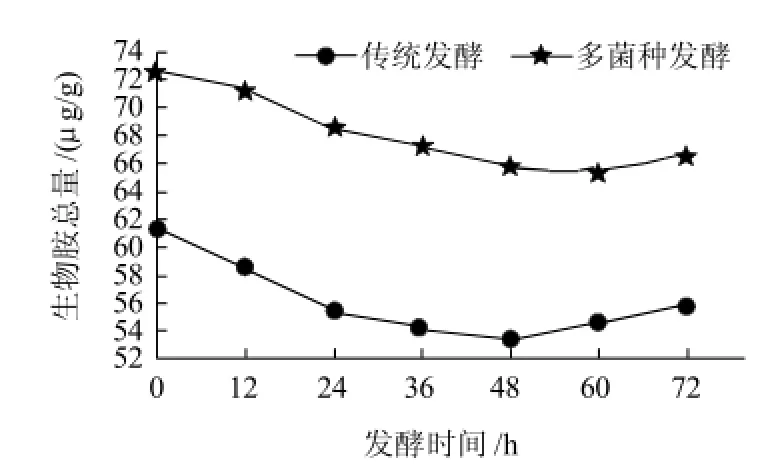
图1 发酵酒醅中生物胺总含量的变化Fig.1 Changes of total biogenic amine content during fermentation
对不同发酵时间的青稞酒醅进行检测,7种生物胺均能检出,如图1所示,发酵过程中生物胺总量变化不显著,在53.44~72.56μg/g范围之间,但都在发酵开始至48h内递减,然后再递增,到72h发酵终了时多菌种曲发酵生物胺总量为66.63μg/g,传统发酵为55.85μg/g。
生物胺的产生和聚积取决于多种因素,如特殊细菌(肠球菌、乳杆菌、发酵剂或非发酵剂)、酶和底物(游离氨基酸)的存在,适当的辅助因子(磷酸吡哆醛),适宜的环境条件等,可通过这些因素来控制生物胺含量,使其保持在安全线以下,达到食品质量与安全标准[31]。
2.2 青稞酒发酵过程中酪胺和组胺含量的变化
生物胺引起的食品安全问题,也就是生物胺的毒性作用。其中组胺对人类的健康影响最大[32],其次是酪胺。口服8~40mg组胺产生轻微中毒症状,超过40mg产生中等中毒症状,超过100mg产生严重中毒症状。口服酪胺超过100mg引起偏头痛,超过1080mg引起中毒性肿胀。

图2 发酵酒醅中酪胺和组胺的含量变化Fig.2 Changes of tyramine and histamine content during fermentation
由图2可见,多菌种曲与传统曲两种发酵方式发酵过程中,酪胺和组胺的含量都随发酵进程逐渐上升,尤其是酪胺,上升趋势明显,多菌种发酵由2.98μg/g上升至5.36μg/g,传统发酵由5.97μg/g上升至11.67μg/g。但是酪胺和组胺的含量都很低,发酵72h的青稞酒醅中,多菌种曲与传统曲发酵后酪胺含量分别占生物胺总量的8.04%和20.90%,组胺含量分别占生物胺总量的2.51%、5.46%,多菌种曲发酵两种生物胺含量和所占生物胺总量的百分比都低于传统曲发酵的青稞酒酒醅。说明多菌种曲发酵降低了酪胺和组胺的含量,从生物胺方面多菌种发酵的青稞酒比传统发酵青稞酒安全性更高,这可能是发酵过程中微生物菌相差别造成的。
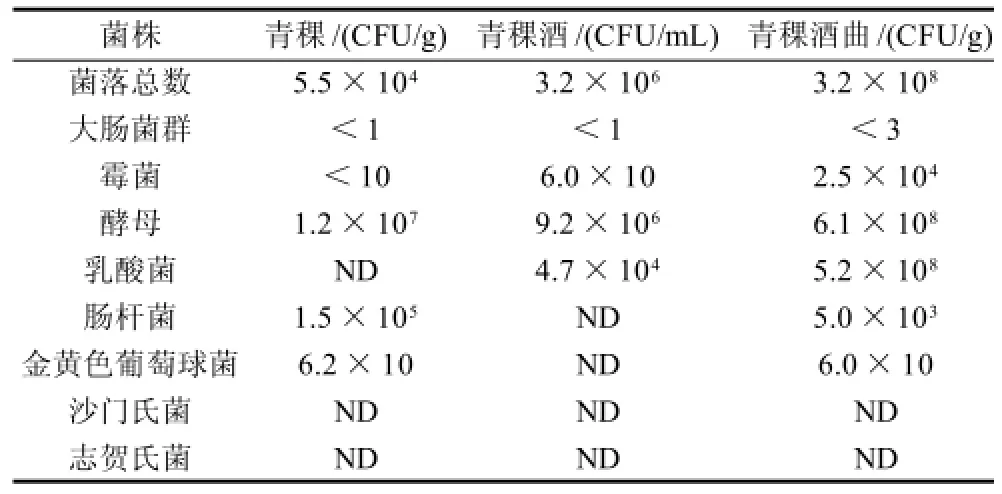
表1 传统青稞酒及青稞酒曲微生物指标的检测结果Table 1 Microbiological indexes of highland barely, fermentedhighland barley and highland barley wine
如表1所示,用取自同一藏民家的青稞,对传统青稞酒以及青稞酒曲做微生物检测,结果表明:传统青稞酒曲中含有大量乳酸菌和肠杆菌等,肠杆菌产生脱羧酶催化氨基酸脱羧产生生物胺,这些脱羧酶即使在细胞死亡后仍具有活性。多种微生物产生的氨基酸脱羧酶较多、活力强,使氨基酸脱去羧基而生成生物胺所致,所以传统曲发酵的酪胺和组胺的含量比多菌种曲发酵的高。
研究发现,酒曲中的微生物数量及种类都多于青稞酒,说明在青稞酒的发酵过程中,微生物如酵母、乳酸菌在同一醪液内发酵,在营养利用上互相竞争性抑制。多种微生态群落的演替过程和各菌种间的共生、共酵、代谢调控过程,并具有反馈抑制作用,而且直接影响酒的产量和质量。传统工艺的魅力,在于多种微生物群(包括酵母菌、细菌等)参与发酵,不但赋予酒特有的风味,而且由于多种微生物的代谢产物丰富,有利于酒的香气和口感。但要酿造好的酒,就要利用好有利微生物,抑制有害微生物的作用。乳酸菌中乳球菌、明串珠菌中的一些菌株,以及乳杆菌中的布氏乳杆菌、消化乳杆菌、植物乳杆菌、弯曲乳杆菌、香肠乳杆菌、巴伐利亚乳杆菌、同型腐酒乳杆菌、路氏乳杆菌和清酒乳杆菌的一些菌株产生最多的一种生物胺是酪胺[33]。由表1可知,从青稞到最后的青稞酒,乳酸菌数量明显增高。由图2a可知,在发酵过程中,酪胺含量呈逐渐上升的趋势,因为多种乳酸菌均可产生酪胺,随着发酵时间的延长,乳酸菌数量的增长,所以酪胺含量在发酵期间不断升高。
微球菌属和葡萄球菌属中的某些菌种具有组氨酸脱羧酶的活性。据报道,木糖葡萄球菌中76%的菌株能生产组胺。由表1可知,青稞和酒曲中均含有葡萄球菌,葡萄球菌产生组胺并且不断积累,如图2b所示,随着发酵时间的延长,组胺含量不断增加。
从青稞酒生产过程中筛选优良微生物制作的多菌种酒曲用于发酵,能够抑制有害微生物的生长、繁殖和外界微生物的侵入,保障发酵的正常进行和顺利完成,提高青稞酒的品质,特别是降低了酪胺和组胺的含量,确保发酵食品的安全。
2.3 青稞酒发酵过程中胍丁胺、精胺、亚精胺含量的变化

多胺化合物在生物体的生长过程中,能促进DNA、RNA和蛋白质的合成,加速生物的生长发育。如图3所示,多菌种发酵和传统曲发酵青稞酒过程中胍丁胺的含量随着发酵的进行呈下降趋势,精胺、亚精胺含量变化趋势不明显。但是胍丁胺是发酵过程中含量最高的生物胺,发酵终了酒醅中胍丁胺含量在多菌种发酵和传统发酵方式下分别是28.72μg/g和17.49μg/g,含量分别占生物胺总量的43.10%和31.32%。多菌种发酵过程中,3种多胺之和占生物胺总量的74.34%,而传统曲发酵3种多胺之和占生物胺总量的65.39%。说明多菌种发酵产生的生物胺主要是对人体没有直接毒性的多聚胺,因此这样的发酵是安全的。
2.4 青稞酒发酵过程中腐胺和尸胺含量变化
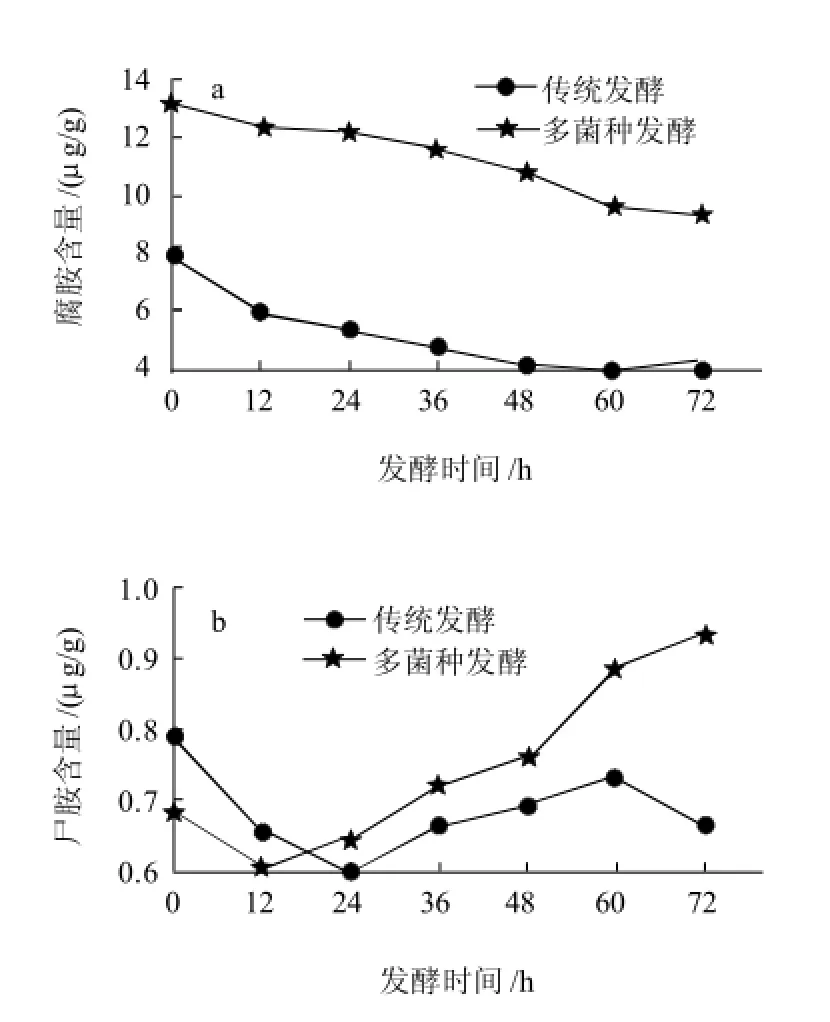
图4 发酵酒醅中腐胺和尸胺的含量变化Fig.4 Changes of putrescine and cadaverine content during fermentation
如图4所示,腐胺的含量变化随着发酵的进行呈下降趋势;发酵72h的青稞酒醅中,多菌种曲与传统曲两种发酵方式的腐胺为9.14μg/g和3.96μg/g,腐胺含量分别占两种发酵方式的生物胺总量的13.72%和7.09%。尸胺含量变化趋势不明显。
腐胺和尸胺等双胺与其他血管胺(酪胺、组胺、色胺、苯乙胺)不同,对人类健康并无不利的影响,但是它们却能通过抑制脱毒酶、双胺氧化酶和羟甲基转换酶的活性而潜在的影响组胺含量。而且,它们的积累与产品的微生物品质下降相关联,组胺的毒性在它们的存在条件下有增强的趋势。
2.5 青稞原料及成品青稞酒中生物胺的含量
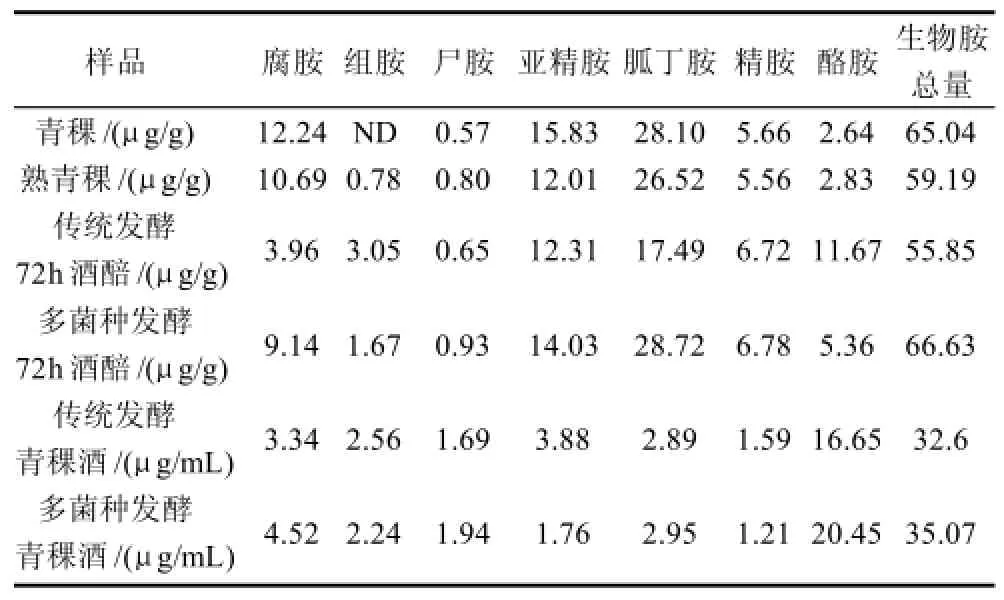
表2 青稞及青稞发酵产品中的生物胺含量Table 2 Content of biogenic amines in highland barely, fermented highland barley and highland barley wine
如表2所示,青稞原料中不含组胺,但是青稞酒醅及成品青稞酒中都含有组胺,分析是青稞酒曲中的肠杆菌发酵生成的,肠杆菌产生脱羧酶催化氨基酸脱羧产生生物胺,这些脱羧酶即使在细胞死亡后仍具有活性。但是不论是对食物安全造成最大威胁的组胺和酪胺含量或者是生物胺总量都低于食品中的限量,因此,青稞酒的优良酒曲发酵和多菌种曲发酵都不存在生物胺的安全性问题,所得青稞酒产品从生物胺角度评价是安全的,多菌种曲发酵青稞酒较传统曲发酵的青稞酒安全性更高。
3 结 论
青稞酒发酵过程中能检测到腐胺、组胺、尸胺、亚精胺、胍丁胺、精胺及酪胺7种生物胺,生物胺总量变化不显著,组胺及酪胺的含量随发酵进程逐渐上升,多菌种发酵的组胺及酪胺的含量均低于传统发酵。腐胺和胍丁胺的含量变化随着发酵的进行呈下降趋势;其余各种生物胺含量变化不明显。多菌种曲发酵青稞酒较传统曲发酵的青稞酒安全性更高。本实验检测的青稞酒醅中的生物胺总量范围在53.44~72.56μg/g,不存在生物胺安全问题。
[1]黎姗姗, 田园, 朱保庆, 等. 龙眼干白葡萄酒发酵过程中生物胺和氨基酸含量的变化[J]. 中外葡萄与葡萄酒, 2011(7): 4-8; 13.
[2]徐岩. 啤酒酿造中腐败细菌的研究[J]. 酿酒, 2000(6): 68-72.
[3]HALASE A, BARATH A, HOLZAPFEL W H. The biogenic amines content of beer, the effect of barley, malting and brewing on amine concentration[J]. Z Lebensm Unters Forsch A, 1999, 208(2): 418-423.
[4]HALASZ A, BARATH A, SIMON L, et al. Biogenicamines and their production by microorganisms in food[J]. Trends in Food Science and Technology, 1994, 5(2): 42-49.
[5]李志军, 吴永宁, 薛长湖. 生物胺与食品安全[J]. 食品与发酵工业, 2004, 30(10): 84-91.
[6]PATRICK M L, OLIVIER C, ALINE L. High frequency of histamine producing bacteria in the enological environment and instability of the histidine decarboxylase production phenotype[J]. Applied and Environmental Microbiology, 2008, 74(3): 811-817.
[7]BRINK B, DAMINK C. Occurrence and formation of biologically active amines in foods[J]. International Journal of Food Microbiology, 1990, 11(1): 73-84.
[8]SILLA S. Biogenic amines: their importance in foods international[J]. Journal of Food Microbiology, 1996, 29(2): 213-231.
[9]SHALABY A. Significance of biogenic amines to food safety and human health[J]. Food Research International, 1996, 29(7): 675-690.
[10]BODMER S, IMARK C, KNEUBFIHI M. Biogenic amines in foods: histamine and food processing[J]. Inflammation Research, 1999, 48(2): 296-300.
[11]HUANG Y, LIU K, HSIEH H. Histamine level and histamine-forming bacteria in dried fish products sold in Penghu Island of Taiwan[J]. Food Control, 2010, 21(9): 1234-1239.
[12]GOMEZ-ALONSO S, HERMOSIN-GUTIERREZ I, GARCIA-ROMERO E. Simultaneous HPLC analysis of biogenic amines, amino acids, and ammonium ion as aminoenone derivatives in wine and beer samples[J]. Journal of Agricultural and Food Chemistry, 2007, 55(3): 608-613.
[13]CHANG S C, KUNG H F, CHEN H C, et al. Determination of histamine and bacterial isolation in swordfish fillets (Xiphias gladius) implicated in a food borne poisoning[J]. Food Control, 2008, 19(1): 16-21.
[14]卢智, 朱俊玲, 马俪珍. 发酵香肠中生物胺含量的影响因素[J]. 肉类工业, 2005(8): 29-52.
[15]KOMPRDA T. Effect of starter culture and storage temperature on the content biogenic amines in dry fermented sausage polican[J]. Meat Science, 2001, 59(3): 207-276.
[16]SHUKLA S, PARK H, KIM J, et al. Determination of biogenic amines in Korean traditional fermented soybean paste (Doenjang)[J]. Food and Chemical Toxicology, 2010, 48(5): 1191-1195.
[17]CINQUINA A, CALY A, LONGO F, et al. Determination of biogenic armines in fish tissues by ion-exchange chromatography with conductivity detection[J]. Journal of Chromatography A, 2004, 1032(1/2): 73-77. [18]HURST W. A review of HPLC methods for the determination of selected biogenic amines in foods[J]. Journal of Liquid Chromatography, 1990, 13(1): 21-23.
[19]JEYA SHAKILA R, VASTMDLMM T S, KUMUDAVALLY K V. A comparison of the TLC-densilometry and HPLC method for the determination of biogenic amines in fish and fishery products[J]. Food Chemistry, 200l, 75(2): 255-259.
[20]KOVACS A, SIMON-SARKADI L, GANZLER K. Determination of biogenic amines by capillary electrophoresis[J]. Journal of Chromatography A, 1999, 836(2): 305-313.
[21]LANGE J, THOMAS K, WITTMARM C. Comparison of a capillary dectrophoresis method with high performance liquid chromatography for the determination of biogenic amines in various food samples[J]. Journal of Chromatography B, 2002, 779(2): 229-239.
[22]AYGUN O, SCHNEIDER E, SCHEUER R, et al. Comparison of ELISA and HPLC for the determination of histamine in cheese[J]. Journal of Agricultural and Food Chemistry, 1999, 47(5): 1961-1964.
[23]CINQUINA A, CALY A, LONGO F, et al. Determination of biogenic amines in fish tissues by ion-exchange chromatography with conductivity detection[J]. Journal of Chromatography A, 2004, 1032(1/2): 73-77.
[24]GB 4789.2—2010食品微生物学检验 菌落总数测定[S].
[25]GB 4789.15—2010食品微生物学检验 霉菌和酵母计数[S].
[26]GB 4789.3—2010食品微生物学检验 大肠菌群计数[S].
[27]GB 4789.4—2010食品微生物学检验 沙门氏菌检验[S].
[28]GB 4789.5—2010食品微生物学检验 志贺氏菌检验[S].
[29]GB 4789.10—2010食品微生物学检验 金黄色葡萄球菌检验[S].
[30]GB 4789.35—2010食品微生物学检验 乳酸菌检验[S].
[31]CHITRAKAR B, 张国农, 顾敏锋. 干酪中的生物胺[J]. 中国乳品工业, 2005, 33(1): 38-42.
[32]BODMER S, IMARK C, KNEUBUHL M. Biogenic amines in foods: histamine and food processing[J]. Inflamm Res, 1999, 48(2): 296-300.
[33]匡晓东, 向敏. 干发酵香肠中的生物胺[J]. 食品科技, 2005, 33(1): 32-35.
Dynamic Changes of Biogenic Amines in Highland Barley Wine during Fermentation
DU Mu-ying1,CHEN Zong-dao1,KAN Jian-quan1,Judit BECZNER2,Agnes BARATH2,Anna HALASZ2
(1. Laboratory of Quality and Safety Risk Assessment in Agricultural Products Preservation(Chongqing), Ministry of Agriculture, Chongqing Special Food Programme and Technology Research Center, College of Food Science, Southwest University, Chongqing 400715, China;2. Central Food Research Institute, Budapest H-1022, Hungary)
In this study, dynamic changes of biogenic amines in highland barley wine during fermentation were investigated. The content of seven different biogenic amines at different fermentation stages was determined using an amino acid analyzer to evaluate the fermentation environment and reasonably control the fermentation process and the quality of final fermentation products. The results showed that highland barley did not contain histamine, but both fermented highland barley and highland barley wine contained histamine. The dynamic change pattern of biogenic amines during fermentation for both traditional fermentation and inoculated fermentation was as follows: putrescine and agmatine contents declined while histamine and tyramine content increased gradually as the fermentation progressed. Tyramine content increased significantly from 2.98μg/g to 5.36μg/g during multi-strain fermentation and from 5.97μg/g to 11.67μg/g by traditional fermentation. The content of other types of biogenic amines and the total biogenic amines did not change significantly during fermentation. The variation of total biogenic amines was 53.44ˉ72.56μg/g, which is within the safe limit of biogenic amines.
highland barley wine;fermentation;biogenic amine composition
TS201.6
A
1002-6630(2012)03-0163-05
2011-09-30
中央高校基本科研业务费专项资金项目(XDJK2009C040);西南大学博士基金项目(SWUB2008068);科技部2005—2006年度中国与匈牙利政府间科技合作项目(CHN-12/2004)
杜木英(1972—),女,副教授,博士,研究方向为微生物与发酵工程。E-mail:muyingdu@swu.edu.cn
