桑黄多糖抗疲劳及耐缺氧实验研究
2012-05-30郭俊平赵述淼马姝萍梁运祥
郭俊平,赵述淼,马姝萍,梁运祥*
(华中农业大学生命科学技术学院/农业微生物学国家重点实验室,湖北 武汉 430070)
桑黄 (Phellinus linzeus)又名桑臣、桑耳、桑黄菇等。分类学上属担子菌亚门、层菌纲、多孔菌目、多孔菌科、针层孔菌属,是大型珍稀药用真菌[1]。桑黄含有多种化学成分,其最主要的活性成分是多糖。近年来,许多真菌研究者致力于桑黄抗肿瘤活性的研究,而对桑黄多糖的抗疲劳和耐缺氧活性研究甚少[2-3]。因此,对人工培养桑黄中的多糖进行生物活性研究,对开发利用我国珍稀药用真菌资源具有重要的学术意义,并且对桑黄天然药物和保健品的开发也具有一定的应用价值。
本研究将从灌胃小鼠抗疲劳和耐缺氧作用两方面,探讨桑黄多糖对改善机体体质的作用。
1 材料与方法
1.1 材料与试剂
缓解体力疲劳功能检测程序和方法见 《保健食品检验与评价技术规范 (2003版)》,主要采用负重游泳实验,进行血清尿素氮测定、肝糖元测定、和血乳酸测定;其负重游泳实验结果阳性,且血乳酸、血清尿素、肝糖原3项生化指标中任2项指标阳性,可判定该受试样品具有缓解体力疲劳功能的作用[4]。
提高缺氧耐受力功能检测程序和方法见 《保健食品功能学评价程序与检验方法规范》 (2003版)。通过常压耐缺氧、亚硝酸钠中毒、急性脑缺血性缺氧3个动物实验来认定"耐缺氧"的保健功能。如果3项实验中任意两项实验显示为阳性,就说明该产品有提高缺氧耐受性的保健功能[4-5]。本文选择常压耐缺氧实验和亚硝酸钠中毒存活实验。
1.1.1 实验菌种
实验菌株为桑黄 (P.linzeus),由华中农业大学菌种保藏中心提供。
1.1.2 实验动物
实验动物为雄性KM小鼠,300只,体重约20 g~23 g来自湖北省疾病控制中心,许可证号:SCXK(鄂)2008-0005。
1.1.3 试剂
肝糖原、血乳酸、血清尿素氮测定试剂盒 (购买于南京建成生物工程公司)、钠石灰 (上海五四化学试剂有限公司),亚硝酸钠、苯酚、硫酸、乙醇及其他试剂均为分析纯 (国药集团化学有限公司)。
1.2 仪器与设备
DU800分光光度计 (美国 BECKMAN COULTER公司);5810R台式高速冷冻离心机 (德国艾本德公司);AR1530分析天平 (美国奥豪斯公司);HQL150C恒温摇床 (武汉中科科仪有限公司);GHP-9270恒温培养箱 (上海索谱仪器有限公司);SHB-Ⅲ循环水式多用真空泵 (郑州长城科工贸有限公司);计时秒表;铅皮。
1.3 实验方法
1.3.1 桑黄多糖的提取
桑黄菌种经发酵筛分得到的菌丝体,料水比为1∶70,90℃水浴浸提3 h,抽滤,取滤液,加入适量的α-淀粉酶,60℃酶解1 h后,浓缩至所需体积,再向浓缩液中加入无水乙醇,混匀,使乙醇终浓度为60%,置于4℃冰箱中, 醇沉 12 h后, 5 000 r·min-1离心 20 min, 弃去上清,取沉淀,用80%的乙醇洗涤3次~4次,于60℃烘干,即得多糖样品。用50 mL蒸馏水溶解,将样品适当稀释后,用苯酚-硫酸法在490 nm处测定吸光度,根据标准曲线得出多糖含量,低温保存备用。
1.3.2 实验分组及给药剂量[8]
抗疲劳实验分为对照组、桑黄多糖低剂量组和桑黄多糖高剂量组,每组10只小鼠;
常压缺氧实验分为对照组、桑黄多糖低剂量组和桑黄多糖高剂量组,每组10只小鼠;
亚硝酸钠毒性实验分为对照组、桑黄多糖低剂量组和桑黄多糖高剂量组,每组10只小鼠。给药剂量见表1。
1.3.3 小鼠饲养及生长观察

表1 灌胃方式和剂量
小鼠购回后适应饲养1周,实验前,选取100只鼠龄一致、体重和形态较为接近的雄性小鼠,按照体重不同分为3个组别,并保证每组的个体体重偏差在±2 g内。小鼠饲养采用自由摄食、饮水。每7天称量一次小鼠体重,记录小鼠体重变化[9]。
1.3.4 抗疲劳负重比选择实验
小鼠游泳实验对水温和室温要求都较高,在游泳时要保证水温恒定,室温与游泳水温差值应在±2℃内。小鼠的负重比例也是影响实验效果的重要因素,在正式实验之前,通过预实验,对小鼠在一定水温、室温和负重情况下的游泳实验有一定把握,以选择效果差异较大且合理的负重比。因此,设计4个负重比,分别为3%、5%、7%、10%。
1.3.5 抗疲劳各指标的测定方法
小鼠力竭游泳时间的测定:小鼠末次灌胃给药1 h后,负重游泳,负重物为小鼠体重5%的铅皮,水深35 cm,水温 (25±1)℃。轻轻搅动水面使小鼠不停游动,并打散小鼠毛发上的气泡。记录小鼠从入水至力竭时的游泳时间,小鼠头部入水7 s不上浮时,判定其游泳运动已至力竭。
肝糖原测定:小鼠末次灌胃给药1 h后,不负重游泳。1 h后停止游泳,立即杀死小鼠,取肝脏经生理盐水漂洗后用滤纸吸干,按照肝糖原测试盒说明方法,测定肝糖原含量[10]。
血清乳酸含量的测定:小鼠末次灌胃给药1 h后,负重4%铅皮游泳。游泳前、游泳后和游泳后30 min分别采血,血样离心后按照乳酸 (Lactic Acid LD)测试盒说明方法测定血清乳酸含量。
血清尿素氮含量测定:小鼠末次灌胃给药1 h后,不负重游泳1 h后停止游泳,小鼠休息1 h后采血,血样离心后按照尿素氮 (BUN)测试盒说明方法测血清尿素氮含量 [11-12]。
1.3.6 耐缺氧实验各项指标的测定方法
常压耐缺氧实验:末次灌胃给药1 h后,将各组小鼠分别放入盛有10 g钠石灰的125 mL广口瓶中,每瓶1只,涂抹凡士林瓶盖封口,计时,以呼吸停止为计时终止指标[13]。
亚硝酸钠毒性实验:末次灌胃给药1 h后,称量小鼠体重, 将每只小鼠以 200/mg·kg-1·bw-1的剂量 i.p.亚硝酸钠,记录小鼠从给药到死亡的存活时间[14-15]。
1.4 实验数据统计分析
采用SPSS 13.0软件对各组实验数据进行单因素方差分析,组间比较用t检验。
2 结果与分析
2.1 桑黄多糖对小鼠体重增重的影响
桑黄多糖对小鼠体重的影响见表2。
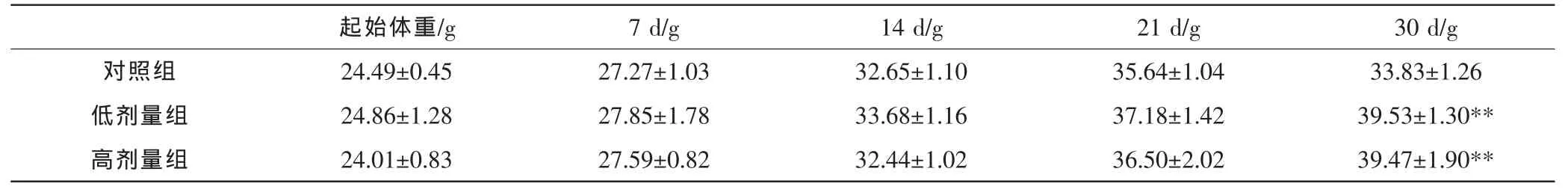
表2 桑黄多糖对小鼠体重的影响 (x±s,n=10)
经过30 d的桑黄多糖灌胃,高剂量和低剂量多糖灌胃组的小鼠体重与对照组相比,明显增加,且呈显著性差异 (P<0.01, P<0.05)。 增重与多糖灌胃剂量呈现出正向剂量关系,灌胃桑黄多糖高剂量的小鼠平均体重增重量为15.48 g, 高于低剂量的增重量 14.67 g。
2.2 抗疲劳实验
负重游泳各项指标 (时间长短,糖原,血乳酸以及血清尿素氮的变化)是机体运动耐力的体现,直接表明机体的疲劳情况与抗疲劳能力[16-17]。
2.2.1 小鼠负重游泳负重比的选择
小鼠负重游泳负重比选择结果见表3。

表3 小鼠游泳负重比的选择结果 (X±s,n=10)
从表3可以看出,在室温和水温相同的情况下,不同的负重比对小鼠的游泳时间长短有很大的影响。负重比为3%、7%和10%时,各组小鼠没有表现出明显的差异,这可能是3%的负重比过轻,对小鼠自身机能没有明显影响,而7%、10%的负重比过重,大大影响了灌胃小鼠的自身机能。结果表明,在选用负重比为5%时,对照组和灌糖组表现出的差异性最为明显。因此,后期的负重游泳实验选用5%的负重比。
2.2.2 桑黄多糖对小鼠负重游泳时间的影响
运动耐力的提高是抗疲劳能力加强最直接的表现,游泳时间的长短可以反应动物运动疲劳的程度。桑黄多糖对小鼠负重游泳时间的实验结果见表4。
从表4可以看出,低剂量和高剂量的桑黄多糖灌胃组与生理盐水灌胃组相比,小鼠的游泳时间明显延长,且低剂量组的效果不如高剂量组明显。高剂量组与对照组相比, 游泳时间明显延长, 差异显著 (P<0.01, P<0.05), 而低剂量组的时间也有延长,差异较显著 (P<0.05)。因此,桑黄多糖尤其是高剂量可以明显延长小鼠的游泳时间,增加率达70.62%,即增强小鼠的抗疲劳性,对小鼠的疲劳有显著的拮抗作用。

表4 桑黄多糖对小鼠负重游泳的影响 (x±s,n=10)
2.2.3 桑黄多糖对小鼠游泳后肝糖原含量的影响。

表5 桑黄多糖对小鼠游泳后肝糖原含量的影响 (x±s,n=10)
从表5可以看出,低剂量和高剂量的桑黄多糖组与生理盐水组相比,小鼠长时间游泳后的肝糖原储备量增加,差异达到极显著 (P<0.01, P<0.05)。 低剂量组的作用效果比高剂量组的更为明显,肝糖原储备量提高33.36%。因此,桑黄多糖能够增加小鼠的肝糖原储备量,具有显著增强小鼠抗疲劳体质的作用,但多糖的量效关系,并非随剂量的增加而增强。
2.2.4 桑黄多糖对小鼠游泳后血清乳酸含量的影响
桑黄多糖对小鼠游泳后血清乳酸含量的影响结果见表6。
从表6可以看出,与对照组相比,各剂量组小鼠游泳前血乳酸的差异不显著 (P>0.05);各剂量组小鼠游泳后0min血乳酸含量均低于对照组,差异具有显著性 (P<0.05,P<0.01);在休息20 min后,高剂量组小鼠游泳后20 min血乳酸含量低于对照组,且均差异极显著 (P<0.01);低剂量组和高剂量小鼠三个时间点的血乳酸曲线下面积都低于对照组,差异均达到了极显著 (P<0.01),且高剂量组曲线下面积最小为211.61,相比对照组面积减小22.89%。因此,桑黄多糖能够降低小鼠剧烈运动后的血乳酸含量,具有显著的抗疲劳作用。
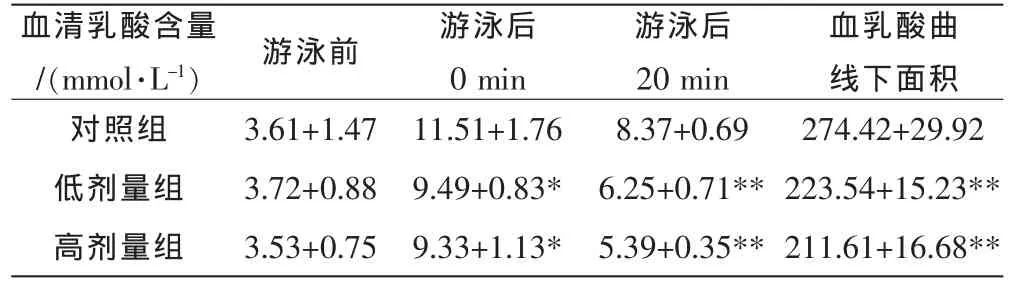
表6 桑黄多糖对小鼠游泳后血清乳酸含量变化的影响 (x±s,n=10)
2.2.5 桑黄多糖对小鼠游泳后血清尿素氮含量的影响
桑黄多糖对小鼠游泳后血清尿素氮含量的影响结果见表7。

表7 桑黄多糖对小鼠游泳后血清尿素氮含量的影响 (x±s,n=10)
从表7可以看出,小鼠经长时间的游泳,低剂量和高剂量桑黄多糖组的小鼠血清尿素氮含量与生理盐水组相比, 显著降低 (P<0.01, P<0.05), 其中, 高剂量组血清尿素氮含量降低较为明显, 为 7.33 mmol·L-1比对照组降低23.17%。因此,桑黄多糖能够降低小鼠剧烈运动后的血清尿素氮含量,减轻小鼠运动后的生理负荷,对小鼠的疲劳有显著的拮抗作用。
2.3 耐缺氧实验
耐缺氧能力是间接反映抗疲劳能力的一组指标。疲劳的过程中,往往伴随着组织缺氧,若机体携氧、利用氧的能力强,就能产生更多的能量,同时减少无氧酵解产生的乳酸,延缓疲劳现象的出现。
常压耐缺氧实验是一种以测定小鼠缺氧存活时间为观测指标的实验方法,常用于评价抗缺氧作用。亚硝酸钠会使正常2价铁血红蛋白转变为3价铁血红蛋白,破坏血红蛋白携氧能力,造成组织缺氧,并表现出相应的缺氧症状。本研究通过常压缺氧以及注射亚硝酸钠,考察服用桑黄多糖的小鼠耐缺氧能力[18-19]。
2.3.1 桑黄多糖对小鼠常压耐缺氧能力的影响
桑黄多糖对小鼠常压耐缺氧时间影响见表8。
从表8可以看出,低剂量组的小鼠常压耐缺氧时间为32.18 min, 明显高于对照组的 22.65 min, 存活时间提高42.08%且差异显著 (P<0.01, P<0.05), 同时也高于高剂量组的23.58 min。而高剂量组与对照组的差异也较明显(P<0.05),低剂量组的耐缺氧时间明显高于高剂量组。因此,低剂量的桑黄多糖能显著提高小鼠的常压耐缺氧能力,增强小鼠体质。

表8 桑黄多糖对小鼠常压耐缺氧时间的影响 (x±s,n=10)
2.3.2 桑黄多糖对小鼠耐亚硝酸钠毒性的影响
桑黄多糖对小鼠耐亚硝酸钠毒性的影响实验结果见表9。

表9 桑黄多糖对小鼠亚硝酸钠毒性存活时间的影响 (x±s,n=10)
从表9可以看出,对照组的小鼠注射亚硝酸钠后存活时间为12.78 min,而采用低剂量和高剂量的桑黄多糖灌胃的小鼠存活时间分别为 15.21 min、 15.68 min, 明显高于对照组的结果,高剂量较对照延长35.29%(显著性P<0.01, P<0.05)。 同时, 低剂量和高剂量组的小鼠存活时间没有明显差异。因此,桑黄多糖能够显著提高小鼠耐亚硝酸钠毒性的能力,增强其体质。
3 结论与讨论
20世纪70年代以来,药用真菌多糖的研究开发进入了一个崭新的发展时期。这些药用真菌多糖的研究主要集中在灵芝,虫草等一些常见真菌,对桑黄多糖的抗疲劳活性研究还尚少。
桑黄菌丝体经热水浸提、乙醇沉淀去除小分子量糖分,得到分子量较大的桑黄菌丝体粗多糖,与文献报道的活性桑黄多糖分子量范围相符,本文对其进行了进一步活性研究。
疲劳是一个综合性的生理过程,涉及了很多的生理和生化因素,它是人体脑力活动或者体力活动达到一定阶段时,机体必定会表现出的一种正常的生理现象,疲劳既是机体原有的工作能力暂时下降的表现,又是机体可能发展到伤病状态的一个先兆[5,10,11]。灌胃桑黄多糖抗疲劳实验表明,低、高剂量组小鼠的游泳实验各项指标均明显优于生理盐水组,即桑黄多糖对有关疲劳的生化指标有着积极的影响,可以提升机体的运动耐力,具有抗疲劳作用;同时灌胃剂量的高低对抗疲劳的作用效果也有差异,以上结果显示出在一定剂量范围内,桑黄多糖剂量越高,抗疲劳功效越显著。
缺氧对机体是一种紧张性刺激,影响机体各种代谢,特别是影响机体的氧化功能,最终会导致机体的心、脑等主要器官缺氧供给不足而死亡[9,12,16]。灌胃桑黄多糖耐缺氧实验表明,桑黄多糖能显著延长小鼠常压耐缺氧条件下的存活时间,同时减少机体受亚硝酸钠毒性影响,增加血液携氧能力,清除血液中的自由基,从而延长小鼠的喘气时间,提高小鼠对缺氧的耐受能力,同时灌胃剂量的差异对常压耐缺氧也有不同的效果,低剂量的桑黄多糖能显著提高小鼠的常压耐缺氧能力,但是剂量高低对小鼠耐亚硝酸钠毒性的能力没有明显差异。然而,桑黄活性多糖的成分及其深层的作用机制尚待进一步研究。
综上所述,桑黄多糖可以提高小鼠的抗疲劳和耐缺氧能力,从而可为桑黄走向保健品、药品市场提供实验依据。随着桑黄菌丝体规模化生产的实现,与之相关的生物产品,在职业疲劳人群和老年人群中必将具有广阔的市场前景。
[1]宋力,孙培龙等.桑黄的研究进展[J].中国食用菌,2004,24(3):7-10.
[2]戴玉成.药用担子菌-鲍式层孔菌 (桑黄)的新认识 [J].中草药,2003,34(1):94-95.
[3]李国俊,吴国用等.裂蹄木层孔菌菌丝培养及其应用研究 [J].中国食用菌,1998,72(5):27-28.
[4]卫生部卫生监督司.保健食品检验与评价技术规范[Z].北京:中华人民共和国卫生部,2003:87-93.
[5]黄林章,黄宝康等.中药抗疲劳作用机制的研究进展[Z].现代药物与临床,2010,25(3):161-165
[6]周勇.桑黄水溶性多糖的分离纯化及结构的初步研究[D].长春:吉林农业大学,2007.
[7]陈瑜,梁运祥等.固体发酵灵芝菌丝多糖的提取及组分分析 [J].中国食用菌,2007,26(3):34-37.
[8]李仪奎.中药药理实验方法学 [M].上海:上海科学技术出版社,2006:10-13,148-154.
[9]张勇,张立实等.保健食品提高缺氧耐受力功能实验结果分析[J].现代预防医学,2004,31(3):341-345.
[10]包怡敏,许家佗.中药抗运动性疲劳的现代研究进展[J].中国中医基础医学杂志,2008,14(10):800-802.
[11]罗琼.纯品枸杞果糖对小鼠抗疲劳的效果[J].武汉大学学报 (自然科学版),1999,45(4):501.
[12]曹寅,胡园等.开心散对缺氧和力竭运动小鼠的抗氧化及抗疲劳作用研究[J].2011,27(4):307-313.
[13]QIN Ru-lan, MENG Qing-shuang.Effects of Total Saponins from Ranunculus japonicus on Hypoxia Tolerance and Memory Ability of Mice[J].Medicinal Plant, 2011, 2(6):41-42.
[14]刘衡川,张弘等.高氧水耐缺氧、抗疲劳作用机制初探[J].四川大学学报 (医学版),2005,36(1):74-76.
[15]邹梅,孙兰等.中保牌健生胶囊的耐缺氧作用 [J].中国实用医药,2009,4(13):127-128.
[16]侯春丽,闫守扶等.运动性疲劳的细胞基质及研究进展[J].首都体育学院报,2004,23(2):196.
[17]罗金花,屈红林.复方中药对实验小鼠抗疲劳效果的研究[J].时珍国医国药,2008,19(8):1975-1976.
[18]Reddy KV, Kumar TC, et al..Pulmonnary lipid peroxidation and antioxidant defenses during exhaustive physical exercise:the role of vitamin E and selenium[J].Nu-trition, 1998, 14(5):448-451.
[19]Liu W, Zhao W, et al..Clinical pathological study of treatment of chronic hepatitis with hyperbaric oxygenation[J].Chinese Medical Journal, 2002, 115(8):1153-1161.
