多巴胺D3受体基因Ser9Gly多态性与阿立哌唑及利培酮治疗效应的关联研究☆
2012-05-25胡晓凤,王芳,郁昊等
阿立哌唑(Aripiprazole)与利培酮(Risperidone)均为非典型抗精神病药物,而关于非典型抗精神病药物所致血催乳素(Prolactin,PRL)水平升高的不利报道日益增多,但不同研究之间所得结论并不一致[1]。
多巴胺是催乳素抑制因子,在下丘脑催乳细胞表面有多巴胺受体,抗精神病药物通过阻断结节-漏斗通路的多巴胺受体而引起高催乳素血症。因此,DRD3基因(3q13.3)成为精神分裂症的候选基因。Lundsortm等发现不同基因型编码的DRD3与多巴胺亲和力有显著差异,Gly/Gly编码的DRD3受体与多巴胺的亲和力显著高于Ser/Gly和Ses/Ser[2]。由于女性患者出现催乳素增加所致使月经紊乱、泌乳情况较为多见[3],因此,我们针对接受阿立哌唑或利培酮治疗的女性首发精神分裂症患者进行比较研究,分析两组药物的药物疗效和对血浆催乳素水平的影响及其与DRD3基因Ser9Gly多态性的关联。
1 对象与方法
1.1 研究对象 选择于2003年至2010年在北京大学第六医院门诊和/或住院部的首发精神分裂症患者。入组标准:①符合中国精神疾病分类与诊断标准(CCMD-3)精神分裂症的诊断标准;②均为女性;③年龄18~45岁;④病程2个月~5年;⑤阳性与阴性症状量表(positive and negative symptom scale,PANSS)总分≥60分。排除标准:①妊娠、哺乳期或绝经期妇女;②药物过敏;③重大躯体疾病;④精神活性物质滥用及其它重性精神疾病等。入组患者都签署了书面知情同意书。本研究获得北京大学第六医院医学伦理委员会的审查批准。
1.2 研究方法
1.2.1 给药方法 136例精神分裂症病人随机入组,每组各68例,均采用口服给药方法。阿立哌唑以5mg/d为起始剂量,3d后加至10mg/d,1周内加至15mg/d,最大剂量可加至30mg/d,平均药物治疗剂量(21.09±5.51)mg/d。利培酮以1mg/d为起始剂量,3d后加至2mg/d,1周内加至3mg/d,最大剂量加至6mg/d,平均药物治疗剂量(5.16±0.87)mg/d。观察疗程为8周。因恶心、EPS、兴奋或不适分别脱落8例,阿立哌唑治疗组和利培酮治疗组实际完成8周药物治疗观察者各60例。阿立哌唑组平均年龄(30.4±8.3)岁,病程中位数为15个月(范围1~31个月),平均药物治疗剂量(20.6±4.3)mg/d,平均体重(61.60±10.85)kg;利培酮组平均年龄(28.2±6.4)岁,平均病程(15.3±19.4)月,平均药物治疗剂(4.16±0.71)mg/d,平均体重(62.54±14.36)kg。两组间年龄、病程及治疗前体重差异均无统计学意义(t=0.65;t=0.89;t=1.51,均P>0.05)。
1.2.2 疗效评定方法 均以PANSS评定两组受试者治疗前疾病严重程度,并以8周末PANSS减分率评定疗效,PANSS减分率=(治疗前PANSS总分-治疗8周末PANSS总分)×100%/(疗前PANSS总分-30)。疗效等级评定按PANSS减分率≥75%为临床痊愈,51%~74%为显著进步,26%~50%为进步,≤25%为无效,有效率按PANSS减分率≥50%计算。由两名主治职称以上医师同时对患者进行PANSS评定,一致性培训Kappa值>0.8。
1.2.3 血浆PRL水平检测 分别于治疗前及治疗8周后上午8:00时抽取静脉血3mL,EDTA抗凝,离心分离血浆,并置于-20℃冰箱保存待检。测定时一次性解冻,专人负责检测。检测仪器采用Roche公司生产的放射免疫计数器,试剂由Roche公司生产。采用放射免疫法进行双盲测定。批内变异系数为4.2%。
1.2.4 DRD3基因Ser9Gly多态性检测 所有受试者抽取外周静脉血5mL,分置于EDTA抗凝管中,保存于4℃冰箱,一周内采用Qiagen公司的小量血液基因组DNA抽提试剂盒提取基因组DNA,-70℃保存待用。采用DNA测序方法检测所有研究对象DRD3基因Ser9Gly(rs6280)基因型,PCR扩增引物序列:上游5′-ATACGCACAATCTTCACCCG-3′;下游5′-ATACCACCCAGGGCATCA-3′。PCR 扩增反应条件为:94℃预变性 5 min,94℃变性 30 s,55~59℃退火 30 s,72℃延伸 1 min,共 35个循环,最后 72℃后延伸 10 min。取 20 μL的 PCR产物经 AmpliTaq DNA聚合酶荧光标记测序试剂盒(Big Dye Terminator Cycle Sequencing Ready Reaction Kit)纯化,内引物扩增,采用ABI PRISM 377-96DNA测序仪检测,采用Chromas软件读取基因型。
1.3 统计分析 全部数据资料采用SPSS 11.0软件进行管理和分析,组间差异采用t检验。设定双侧检验显著性水平为P<0.05。
2 结果
2.1 阿立哌唑与利培酮治疗组间的临床疗效比较 阿立哌唑与利培酮治疗组疗前PANSS总分、治疗8周后PANSS总分及其减分率比较无统计学意义(t=0.79;t=1.60;t=1.89,均P>0.05),治疗8周阿立哌唑组临床痊愈21例、显著进步19例、进步12例、无效8例,PANSS减分率(59.79±23.48)%,有效率为86.7%,利培酮组临床痊愈20例、显著进步18例、进步15例、无效7例,利培酮组PANSS减分率(63.30±22.66)%,有效率为88.3%。两组比较差异无统计学意义,见表1。
2.2 阿立哌唑与利培酮治疗组间治疗前后血浆PRL水平比较 治疗前阿立哌唑与利培酮治疗组间血浆PRL水平(ng/mL)比较差异无统计学意义(t=1.25,P>0.05);药物治疗8周后利培酮组PRL水平升高了(26.92±9.48)ng/mL,阿立哌唑治疗8周后患者血浆PRL水平不仅没有升高,反而有所下降(-25.25±8.07)ng/mL;治疗后血浆PRL水平(ng/mL)两组间差异有显著统计学意义(t=5.86,P<0.05);其变化值两组间差异有显著统计学意义(t=4.59,P<0.05),见表1。
2.3 阿立哌唑和利培酮治疗前后对女性患者月经周期、泌乳及体重的影响 阿立哌唑治疗组60例女性精神分裂症患者中有4例(6.7%)出现月经紊乱,而利培酮治疗组60例女性患者中有14例(23.3%)出现月经紊乱或泌乳,两组比较差异有统计学意义(χ2=6.54,P<0.05)。阿立哌唑与利培酮治疗组间体重变化值差异有统计学意义(t=3.17,P<0.05)。
2.4 阿立哌唑与利培酮治疗8周疗效、血浆PRL水平变化与DRD3基因Ser9Gly的关联分析DRD3基因Ser9Gly多态性基因型在阿立哌唑与利培酮治疗组的分布频率均符合Hardy-Weinberg定律(P>0.05)。两种药物治疗8周后PANSS减分率与DRD3基因Ser9Gly多态性差异无统计学意义。阿立哌唑组血浆催乳素水平变化与DRD3基因多态性关联无统计学意义(t=0.286,P>0.05),见表2。利培酮组血浆催乳素水平增加与DRD3基因多态性关联差异有统计学意义(t=6.72,P<0.05),见表 3。
3 讨论
利培酮与阿立哌唑均为目前治疗精神分裂症的一线用药。利培酮与多巴胺D2受体和五羟色胺5-HT2受体有很高的亲和力,属于D2/5-HT2A受体平衡拮抗剂[4]。而阿立哌唑与D2、D3和5-HT1A和5-HT2A受体有很高的亲和力,可能是通过对D2和5-HT1A受体的部分激动作用及对5-HT2A受体的拮抗作用来产生抗精神病作用[5-6]。既往也有文献提示,经典抗精神病药如氯丙嗪等,由于在阻断中脑-边缘系统和中脑-皮质多巴胺通路D2受体的同时,还阻断了漏斗-结节多巴胺通路,故不仅可产生抗精神病效应,还有可能刺激PRL大量分泌,引起血中PRL水平升高。而大多数非典型抗精神病药如奥氮平等,由于更加特异性的阻断中脑-边缘系统和中脑-皮质通路,对漏斗-结节通路阻断作用相对较轻,故一般不引起明显的高催乳素血症。而利培酮则由于存在受体选择性作用不同,可引起明显的血PRL水平升高[7]。也有人认为可能有某些潜在因素直接作用于垂体泌乳细胞导致血PRL水平升高[1]。
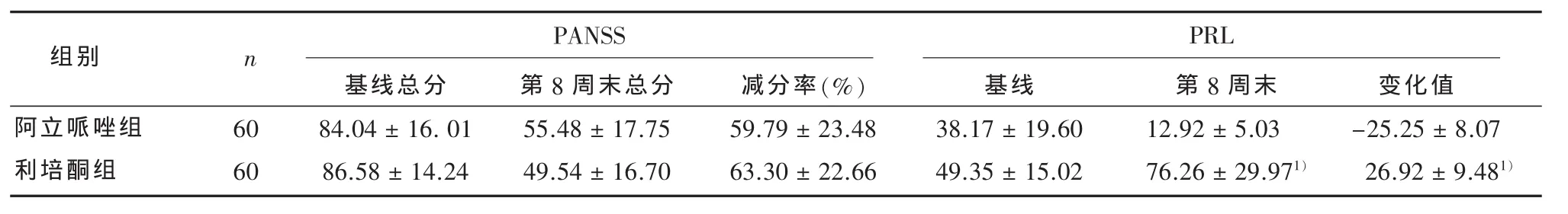
表1 阿立哌唑与利培酮组治疗前后PANSS总分,PANSS减分率(%)及治疗前后血浆PRL水平比较
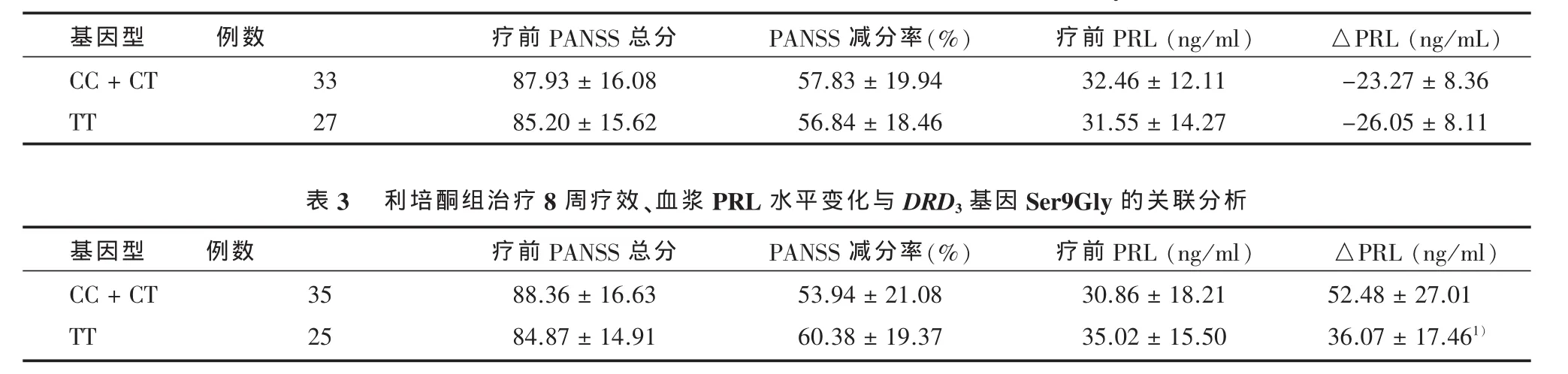
表2 阿立哌唑组治疗8周疗效、血浆PRL水平变化与DRD3基因Ser9Gly的关联分析
Gagliano等报道精神分裂症患者血浆PRL水平变化与利培酮及其代谢产物9-羟利培酮的血药浓度无关联[8]。Troost等研究发现,利培酮治疗前后血浆PRL水平变化与9-羟利培酮的血药浓度相关,但与利培酮血药浓度无关[9]。Duval等报道利培酮治疗前后血浆PRL水平变化与利培酮和9-羟利培酮的血药浓度相关,但与治疗前后患者的体重变化无关[10]。上述研究的差异可能与不同种族的生物学背景差异、药物治疗剂量、疗程以及所选患者临床特征等因素不同有关。
本研究结果显示,与利培酮相比,阿立哌唑治疗女性首发精神分裂症患者的疗效基本相当。这与国内外一些研究结论基本一致[11-14]。同时,本研究结果还显示,利培酮治疗8周后,女性首发精神分裂症患者血浆PRL水平呈明显上升趋势,而阿立哌唑对女性患者并不引起显著血浆PRL水平升高。利培酮治疗组出现泌乳和月经紊乱者多于阿立哌唑治疗组。此外,与阿立哌唑相比,利培酮治疗8周后患者体重明显增加。上述结论均与多数国内外研究结论基本一致[1,8,12,13]。
DRD3基因位于染色体3q13.3区内,其第一外显子的第9密码子存在A→G的单核苷酸置换多态性,导致DRD3的N端细胞外区域的丝氨酸(Ser)被甘氨酸(Gly)替换,成为 Ser9Gly 多态性(dbSNP库编码为rs6280)。Lundstrom等采用注射用重组人促红素(CHO)细胞模型进行多态性表达,结果发现,不同基因型(Gly/Gly,Ser/Gly,Ser/Ser)编码的DRD3受体与多巴胺神经递质的亲和力有显著差异:Gly/Gly纯合子基因型编码的DRD3与多巴胺的亲和力显著高于Ser/Gly杂合子及Ser/Ser纯合子[2]。究其原因可能与有化学极性丝氨酸(Ser)被无极性的甘氨酸(Gly)替换后,引起了DRD3蛋白质的三级结构发生变化。
Yasui-Furukori等对174例日本精神分裂症患者(68例男性,106例女性)接受利培酮药物治疗4周后进行血浆PRL水平及DRD2,DRD3,DRD4及儿茶酚-O-甲基转移酶(COMT)共4个候选基因的5个多态性位点进行检测,结果发现,利培酮治疗4周后血浆PRL水平变化与DRD3基因Ser9Gly多态性关联[15]。本研究结果显示,利培酮致血浆PRL水平变化与DRD3基因Ser9Gly多态性有关联,进一步支持了DRD3在利培酮治疗所致催乳素变化的关系。而阿立哌唑可能由于其多受体(D2,D3,5-HT1A)作用机制,从而降低了其引起血浆PRL水平升高的风险。本研究关于DRD3基因Ser9Gly多态性与利培酮治疗所致血浆PRL升高关联的研究结果还需要在不同人群中扩大样本量进一步验证。关于利培酮所致血浆PRL水平升高的神经内分泌改变机制及其临床后果我们还会开展进一步的深入研究。另外,关于利培酮治疗导致血浆PRL水平变化与药物治疗剂量的研究结论至今不一,我们还将针对利培酮药物治疗剂量与利培酮治疗导致血浆PRL水平变化进行验证。
[1]苏允爱,司天梅,舒良,等.抗精神病药与高催乳素血症[J].国外医学精神病学分册,2003,30(3):160-163.
[2]Lundstrom K,Turpin MP.Proposed schizophrenia related gene polymorphism: expression of the Ser/Gly mutant human dopamine D3receptor with the Semliki Forest virus system [J]. Biochem Biophys Res Commun,1996,225(3):1068-1072.
[3]于靖,王传跃,林守清,等.利培酮对女性精神分裂症患者神经内分泌的影响[J].中国神经精神疾病杂志,2003,29(6):445-447.
[4]Reynolds GP.Receptor mechanisms in the treatment of schizophrenia[J].Journal of Psychopharmacology,2004,18(3):340-345.
[5]Jordan S,Koprivica V,Chen R,et al.The antipsychotic aripiprazole is a potent,partial agonist at the human 5-HT1Areceptor[J].European journal of pharmacology,2002,441(3):137-140.
[6]Shapiro DA,Renock S,Arrington E,et al.Aripiprazole: a novel atypical antipsychotic drug with a unique and robust pharmacology [J].Neuropsychopharmacology,2003,28(8):1400-1411.
[7]王东平,李予春,冯砚国,等.阿立哌唑与利培酮治疗精神分裂症对照研究[J].临床心身疾病杂志,2006,12(4):245-245.
[8]Shapiro DA,Renock S,Arrington E,et al.Aripiprazole: a novel atypical antipsychotic drug with a unique and robust pharmacology[J].Neuropsychopharmacology,2003,28(8):1400-1411.
[9]侯静,徐贵云,马崔,等.氯氮平与利培酮对血清催乳素水平的影响[J].临床精神医学杂志,2001,11(1):123.
[10]Troost PW,Lahuis BE,Hermans MH,et al.Prolactin release in children treated with risperidone:impact and role of CYP2D6 metabolism[J].Clin Psychopharmacol,2007,27(1): 52-57.
[11]Duval F,Guillon MS,Mokrani MC,et al.Relationship between prolactin secretion,and plasma risperidone and 9-hydroxyrisperidone concentrations in adolescents with schizophreniform disorder[J].Psychoneuroendocrinology,2008,33(2):255-259.
[12]Potkin SG,Saha AR,Kujawa MJ,et al.Aripiprazole,an antipsychotic with a novel mechanism of action,and risperidone vs placebo in patients with schizophrenia and schizoaffective disorder[J].Arch Gen Psychiatry,2003,60(7):681-690.
[13]戴俊平,赵振环,刘国雄,等.阿立哌唑与奎硫平治疗精神分裂症的疗效和安全性比较[J].中国行为医学科学,2005,14(8):712-714.
[14]邹旭辉,孙录,黎建平.阿立哌唑与利培酮治疗精神分裂症对照研究[J].临床精神医学杂志,2006,16(4):230-232.
[15]国效峰,赵靖平,陈晋东,等.阿立哌唑治疗精神分裂症疗效与安全性的meta分析[J].中国神经精神疾病杂志,2007,33(12):752-755.
[16]Yasui-Furukori N,Saito M,Tsuchimine S,et al.Association between dopamine-related polymorphisms and plasma concentrations of prolactin during risperidone treatment in schizophrenic patients[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(6):1491-1495.
猜你喜欢
杂志排行
中国神经精神疾病杂志的其它文章
- 偏头痛患者伴发焦虑/抑郁及功能残疾的临床研究☆
- [20]右下肢麻木、无力20余年,左下肢麻木、无力8年,排尿困难2年(上)Numb and weakness in the right lower extremity for twenty years,numb and weakness in the left lower extremity for eight years,dysuria for two years
- 急性应激大鼠中枢色氨酸羟化酶-2表达变化☆
- 脑结核瘤的诊断及治疗(附17例报告)☆
- 抑郁症血清神经元特异性烯醇化酶和髓鞘碱性蛋白水平的研究☆
- 颈动脉狭窄程度及血hs-CRP水平对缺血性脑血管事件的影响
