热疗联合顺铂对小细胞肺癌NCI-H446细胞凋亡的影响及机制探讨
2012-05-23
(辽宁医学院附属第一医院,辽宁锦州121000)
小细胞肺癌(SCLC)恶性程度极高,早期易发生淋巴及血行转移,临床确诊时常已有广泛转移,并且治疗后容易复发[1]。热疗作为一门新兴技术,在肿瘤的综合治疗中发挥了重要作用。研究[2~4]表明,热疗与化疗联合应用,可以提高某些恶性肿瘤的治疗效果。2010年9月~2011年5月,我们观察了单独应用热疗、顺铂以及二者联合应用对SCLC细胞凋亡的影响,并通过检测凋亡相关基因Bax和Bcl-2的表达变化,探讨其对SCLC细胞凋亡的影响机制,为SCLC的临床治疗提供一定的理论依据。
1 材料与方法
1.1 实验材料 SCLC细胞株NCI-H446由中国科学院细胞库引进,顺铂注射液购于豪森药业股份有限公司,新生小牛血清和RPMI-1640培养基分别购于杭州四季青公司和美国Gibco公司;聚丙烯酰胺凝胶购于TaKaRa公司,Bax和Bcl-2一抗购于武汉博士德公司,AV-PI试剂盒购于上海晶美生物公司,Werstern blot试剂盒、CO2培养箱、超净工作台、流式细胞仪(美国BD公司)、电泳槽(美国BD公司)、凝胶成像系统(美国Gene公司)由辽宁医学院科学实验中心提供。
1.2 方法
1.2.1 细胞培养 将 NCI-H446细胞在含10%胎牛血清的RPMI-1640培养基37℃、CO2孵育箱中培养,2~3 d换新鲜培养液。当细胞长满瓶底进入对数生长期后,用0.25%胰酶消化分散,进行传代培养用于实验。
1.2.2 NCI-H446细胞凋亡情况的观察 采用流式细胞术。取对数生长期的 NCI-H446细胞,用0.25%胰酶消化后制成单细胞悬液,调整细胞浓度为1×105/mL。将细胞随机分为 A、B、C、D组。取6孔板,每组3个平行孔,每孔接种细胞悬液2 mL。A组常规培养,不进行特殊处理;B组将细胞消化后放置离心管中,在42℃水浴中加热2 h;C组依据参考文献[5],加入含2μg/mL顺铂的培养液每孔4 μg;D组先经过水浴处理后加入顺铂,具体方法同上。继续培养72 h后,吸去上清液,常规消化细胞;以1 500次/min离心5 min,弃上清;PBS重悬细胞后,移至EP管中,再次以1 500次/min离心5 min。加5μL的 AnnexinⅤ-FITC溶液和2.5μL的 PI到100μL的细胞混悬液中,混合后室温避光反应30 min,加入反应缓冲液400μL,上流式细胞仪检测细胞凋亡率。
1.2.3 NCI-H446 细胞中 Bax 和 Bcl-2 的检测 采用Western blot法。取对数生长期的 NCI-H446细胞,用0.25%胰酶消化后制成单细胞悬液,调整细胞浓度为1×105/mL。分组及处理方法同1.2.2,继续培养72 h。收取细胞,加入预冷裂解缓冲液,超声匀浆,低温超速离心(4℃,12 000 r/min离心30 min)。吸取上清液为总蛋白,Lowry法测定蛋白浓度,调整蛋白浓度至50μg/20μL。10%SDS-PAGE凝胶90 V电泳3 h后转印。缓冲液洗膜后1%BSA封闭非特异性抗原2 h。缓冲液洗膜后,与一抗(1∶250)4℃孵育过夜。缓冲液洗膜后与碱性磷酸酶标记二抗(1∶200)室温下孵育2 h。NBT/BCIP显色15 min,以NC膜上出现清晰的棕褐色条带为阳性,终止显色,漂洗并干燥后避光保存。应用凝胶成像系统对显色条带扫描的灰度值进行定量分析,以Bax和Bcl-2与内参β-actin的比值作为蛋白的相对表达量。
1.2.4 统计学方法 采用SPSS17.0统计软件。组间细胞凋亡率比较行χ2检验,组间Bcl-2、Bax表达比较行方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组 NCI-H446细胞凋亡率比较 NCI-H446细胞凋亡率 A 组4.25% ±0.56%、B组8.12% ±0.64%、C 组 10.02% ± 0.82%、D 组 12.12% ±0.49%;B、C、D 组 NCI-H446 细胞凋亡率与 A 组比较,P 均 <0.05;D 组与 B、C 组比较,P 均 <0.05;B、C 组比较,P >0.05。
2.2 各组 NCI-H446 细胞中 Bcl-2、Bax 相对表达量比较 见表1。
表1 各组NCI-H446细胞中Bcl-2、Bax相对表达量比较(±s)
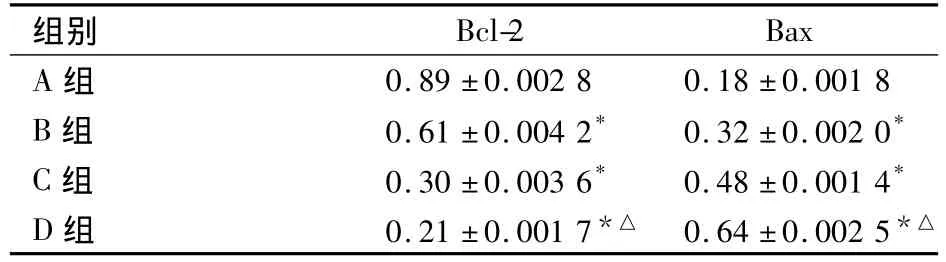
表1 各组NCI-H446细胞中Bcl-2、Bax相对表达量比较(±s)
注:与A 组比较,*P <0.05;与 B、C 组比较,△P <0.05
Bcl-2 Bax A组组别0.89 ±0.002 8 0.18 ±0.001 8 B 组 0.61 ±0.004 2* 0.32 ±0.002 0*C 组 0.30 ±0.003 6* 0.48 ±0.001 4*D 组 0.21 ±0.001 7*△ 0.64 ±0.002 5*△
3 讨论
热疗作为一种无创、不良反应少、疗效良好的治疗方法,为晚期恶性肿瘤的治疗提供了一种新的手段。目前,研究认为热疗抗肿瘤的机制包括直接杀伤肿瘤细胞,以及诱导肿瘤细胞凋亡。Krause等[6]发现,Ewing's肉瘤细胞在42℃环境中持续2 h后可产生细胞凋亡,并检测到凋亡相关基因Caspase-3显著激活。Li等[7]研究显示,对小鼠肝癌细胞进行加热治疗15、30、45 min后,通过流式细胞仪均可检测到细胞凋亡,并有一定程度的微血管损害。另外,热疗还可增强某些化疗药物的细胞毒作用。Ostrow等[8]对环磷酰胺在41.8℃和37℃时的药代动力学及药物与热疗间的协同性进行了比较,发现高热能促进未代谢的环磷酰胺在线粒体中代谢。顺铂为铂的金属络合物,作用类似于双功能烷化剂。其主要作用靶点为DNA,作用于DNA链间及链内交链,形成DDP-DNA复合物,干扰DNA复制。顺铂属细胞周期非特异性药物,具有抗瘤谱广、抗瘤作用强、与多种抗肿瘤药有协同作用且无交叉耐药等特点,为当前治疗SCLC联合化疗中最常用的药物之一。
细胞凋亡及基因调控异常,使得细胞的生态平衡失调,从而导致肿瘤的发生、发展[9]。其中,肿瘤细胞凋亡抑制是其发生的原因之一。研究[10]显示,细胞凋亡指数可作为预测SCLC患者预后的一个指标,凋亡指数越低,患者的生存期缩短,预后差。本研究结果显示,B、C、D组与A组比较,细胞凋亡率明显增加(P均<0.05),且D组凋亡率最高。这表明应用热疗、顺铂及联合治疗后,均显著增加了SCLC细胞的凋亡,且联合治疗的细胞凋亡率显著高于单独治疗组。
Bcl-2 主要的生理功能是调节细胞凋亡,Bcl-2过表达可抑制细胞凋亡,使那些具有遗传改变而又得不到修复的细胞免于死亡而进入细胞循环,从而导致细胞增殖和凋亡不平衡。Bax的作用与Bcl-2相反,对细胞凋亡具有促进作用。Bax基因过度表达可抑制 Bcl-2的功能,加速细胞凋亡[11]。许多细胞凋亡过程中都伴有Bax表达水平升高,转染Bax可以诱导多种细胞凋亡;Bcl-2过表达和Bax低表达,可使细胞凋亡受到抑制。Bcl-2和Bax的表达与肺癌患者的预后和生存期具有一定的相关性[12,13]。Bcl-2蛋白定位于线粒体外上,能阻滞细胞色素C的释放,从而使Caspase活化受阻,肿瘤细胞凋亡受抑,最终导致肿瘤产生化疗耐药性。因此,Bcl-2既是一种抗凋亡基因,也是一种耐药基因;降低Bcl-2基因的过度表达,可以逆转肿瘤化疗耐药性。已有研究[14]显示,以 Bcl-2 为靶基因抑制其表达,可逆转SCLC产生的化疗耐药性。本研究结果显示,B、C、D组NCI-H446细胞中 Bcl-2的表达水平明显低于 A组,Bax的表达水平明显高于A组,说明热疗、顺铂均可降低SCLC细胞Bcl-2的表达、增强Bax表达,两者联合应用可使该作用进一步增强。其机制可能为热疗可以增强细胞膜的流动性和通透性,使化疗药物更容易进入癌细胞内,杀灭癌细胞;同时,热疗还通过抑制DNA修复和多药耐药性P-糖蛋白的表达[15],来增加癌细胞对化疗药的敏感性、减少或逆转肿瘤耐药性的发生,使癌细胞更容易被杀伤,从而降低和逆转癌细胞对药物产生的耐药性,对化疗有成倍增效作用。这为我们应用热疗和顺铂治疗SCLC提供了一定的理论依据。
[1]Blackhall F,Faivre-Finn C.Treatment of limited small cell lung cancer:an old or new challenge[J].Curr Opin Oncol,2011,23(2):158-162.
[2]李相武,李丹.热疗对人乳腺癌细胞MCF-7凋亡的影响[J].实用预防医学,2008,15(1):72-74.
[3]蒋东,郑世营,陈锁成.全身热疗与肿瘤细胞凋亡的研究进展[J].医学综述,2008,14(1):37-39.
[4]Hilger I,Rapp A,Greulich KO,et al.Assessment of DNA damage in target tumor cells after thermoablation inmice[J].Radiology,2005,237(2):500-506.
[5]黄波,刘志良,王晓东.川芎嗪、顺铂对小细胞肺癌NCI-H446细胞株体外增殖的影响[J].山东医药,2010,50(42):72-73.
[6]Krause C,Klüttermann K,Mauz-Körholz C.Molecular mechanisms and gene regulation ofmelphalan and hyperthermia-induced apoptosis in Ewing sarcoma cells[J].Anticancer Res,2008,28(5A):2585-2593.
[7]Li K,Shen SQ,Xiong CL.Microvessel damagemay play an important role in tumoricidal effect for murineh(22)hepatoma cells with hyperthermia in vivo[J].J Surg Res,2008,145(1):97-104.
[8]Ostrow S,Van Echo D,Whitacre M,et al.Physiologic response and toxicity in patients undergoingwhole-body hyperthermia for the treatment of cancer[J].Cancer Treat Rep,2001,65(3-4):323-325.
[9]Halmos B,Huettner CS,Kocher O,et al.Down-regulation and antiproliferative role of C/EBP alpha in lung cancer[J].Cancer Res,2002,62(2):528-534.
[10]Dworakowska D,JasseMe,Jassem J,et al.Prognostic value of the apoptotic index analysed jointly with selected cell cycle regulators and proliferation markers in small cell lung cancer[J].Lung Cancer,2009,66(1):127-133.
[11]Heiser D,Labi V,ErlacherM,etal.The Bcl-2 protein family and its role in the development of neoplastic disease[J].Exp Gerontol,2004,39(8):1125-1135.
[12]De Bruin EC,Van de Velde CJ,Van de Pas S,et al.Prognostic value of apoptosis in rectal cancer patients of the dutch totalmesorectal excision trial:radiotherapy is redundant in intrinsically high apoptotic tumors[J].Clin Cancer Res,2006,12(21):6432-6436.
[13]Zereu M,Vinholes JJ,Zettler CG.p53 and Bcl-2 protein expression and its relationship with prognosis in small-cell lung cancer[J].Clin Lung Cancer,2003,4(5):298-302.
[14]戢福云,钱桂生,钱频等.Bcl-2对人小细胞肺癌细胞系H446/DDP多药耐药性的影响[J].中华结核和呼吸杂志,2006,29(3):156-160.
[15]Mohamed F,Marchettini P,Stuart OA,et al.Thermal enhancement of new the motherapeutic agents at moderate hyperthermia[J].Ann Surg Oncol,2004,10(4):463-468.
