DNA错配修复基因MSH2和MLH1单核苷酸多态性与食管癌发生风险相关性研究*
2012-05-07何丹任鹏亮范雪娇杨晓龙李俊葓刘琳刘戟
何丹 任鹏亮 范雪娇 杨晓龙 李俊葓 刘琳 刘戟△
(1.四川中医药高等专科学校药学与检验系,四川 绵阳 621000;2.四川大学华西基础医学与法医学院生物化学与分子生物学教研室,四川 成都 610041)
食管癌是常见恶性肿瘤,除饮食、环境因素外,包括乙醇代谢、叶酸代谢、致癌物代谢、DNA修复、细胞周期调控、癌基因在内的许多基因都可能与食管癌的发生相关联,人类DNA修复机制通过保护基因组免受由内外源性因素导致的各种损伤从而保持基因组稳定性[1]。单核苷酸多态性(Single nucleotide polymorphism,SNP)是人类遗传变异最普遍的形式,各种证据表明DNA修复基因特定单核苷酸多态性位点会影响酶的表达水平、酶活性以及个体对DNA损伤的修复效能,修复基因缺陷可能导致遗传不稳定和癌症发生[2-3],暗示肿瘤发生风险的个体差异与特定修复基因的多态性相关[1]。我们选择MSH2和MLH1两个基因作为错配修复基因的代表,探讨其对食管癌发生的作用。
错配修复(Mismatch repair gene,MMR)是DNA修复的几个酶系统之一,对保持遗传信息的完整性和稳定性,避免遗传突变的产生具有重要作用。MSH2基因突变可引起包括结直肠癌、遗传性无息肉病、Muir-Torre综合征等的发生。研究发现某些食管癌病人MSH2基因严重缺陷,其低水平表达与食管癌发生相关[4],体外实验证实MSH2基因多态性可能改变其蛋白功能[5]。MLH1基因突变是以DNA微卫星不稳定性为标志的大部分散发性肿瘤的特征之一,并常见于直肠、子宫内膜和胃部肿瘤中。此外MLH1基因还参与有丝分裂和减数分裂的重组事件,与异源双链的校正及细胞凋亡有关。但MSH2和MLH1基因与食管癌发生的关系尤其是其联合作用在中国人群中的研究尚少见报道。鉴定这些DNA错配修复酶突变基因型与食管癌发生的相关性可能有助于阐明食管癌的病因学机制并对该疾病发生风险进行预测和判断。因此,我们进行了一项基于医院的包括169例食管癌病人和132例对照的研究,探究MSH2c.2063T>G和MLH1IVS14-19A>G两个基因单核苷酸多态性位点与食管癌发病风险之间的关系。
1 材料与方法
1.1 研究对象
所有研究对象均为中国人群,包括2005年4月到2011年6月期间在四川省绵阳市肿瘤医院招募的169例经组织病理学确诊的食管癌患者(不受年龄、性别、组织学类型限制,术前未经放射和抗癌药物治疗)和132例无血缘关系的健康个体作为正常对照(主要来自于体检者,并按性别和年龄与病例频数配对)。
1.2 方法
1.2.1 DNA提取
采用北京百泰克生物技术有限公司生产的“全血基因组DNA快速提取试剂盒(溶液型)”提取全血基因组DNA。
1.2.2 单核苷酸多态性位点分析
采用PCR体外扩增目的基因片段和限制性内切酶片断长度多态分析(RFLP)方法检测目的基因多态性位点的基因型。引物序列设计及扩增反应条件和RFLP所用酶见表1。扩增反应在热循环仪MyGeneTMSeries Peltier Thermal Cycler上进行。酶切产物经8.0%聚丙烯酰胺凝胶电泳,溴乙锭染色,紫外光照射下在凝胶成像系统上观察分析。
1.3 统计学方法
采用SPSS12.0统计软件进行数据分析。病例组和对照组两组间的人口特征差异显著性以χ2检验所得P值确定。以非条件Logistic回归分别计算两组等位基因及基因型频率,通过经年龄、性别、吸烟、饮酒、癌症家族史等校正后的比值比(OR)及其95%可信区间(95%CI)评估各种基因型或者基因之间交互作用与食管癌风险的相关性。所有的统计检验均为双侧概率检验,差异显著性设定在P<0.05。
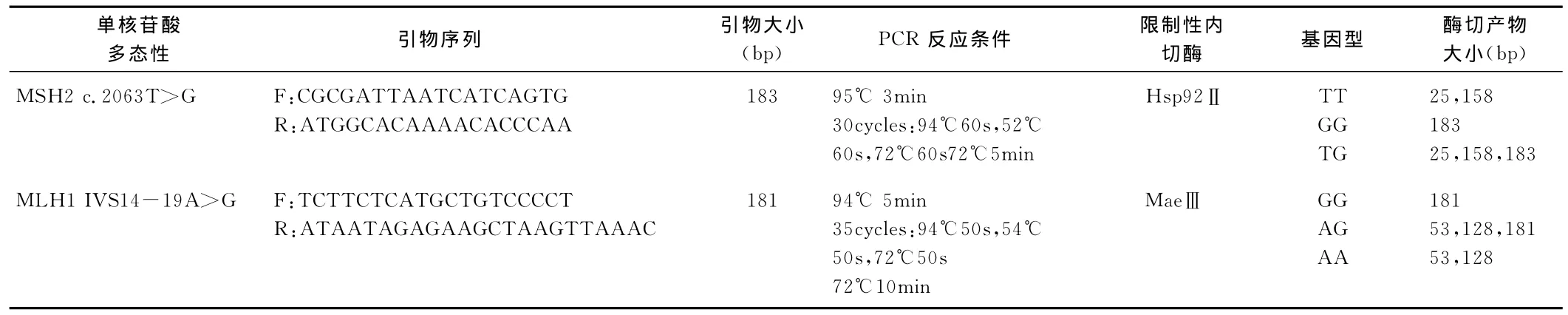
表1 PCR-RFLP引物序列设计及扩增反应条件和酶切分析结果
2 结果
2.1 人口特征
本研究中共计301个样本,包括169例食管癌患者和132健康人。表2显示了所研究人群主要特征。在年龄和性别分布上两组人群没有明显差别(P>0.05),但是吸烟和饮酒在病例组的比例明显高于对照组,分别是71.0%,59.8%和30.3%,32.6%,表明吸烟和饮酒是食管癌发生的危险因素,这与通常的认识相符,然而在癌症家族史上两组没有明显差别(P>0.05)。
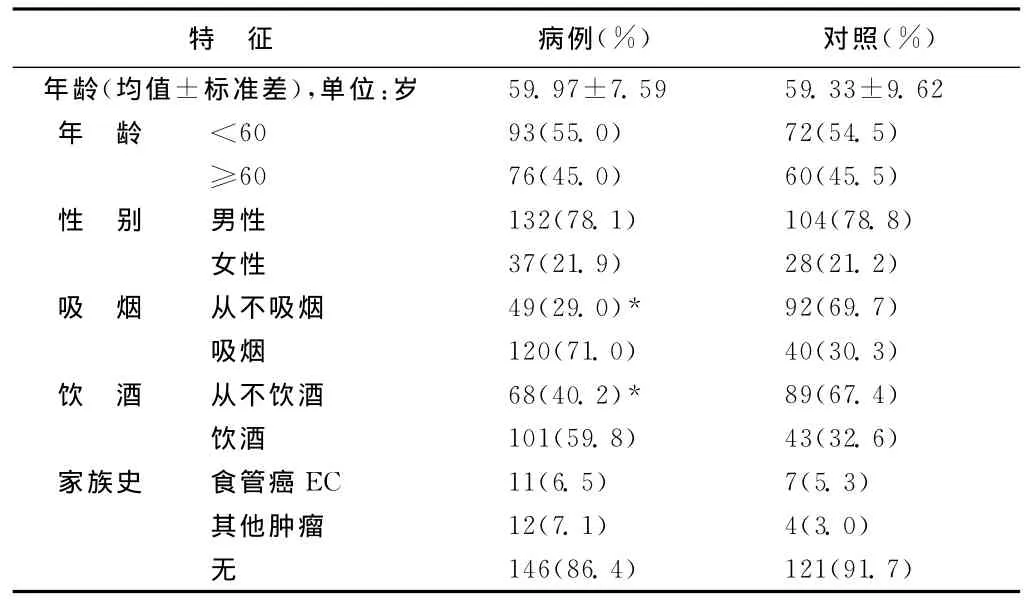
表2 病例组(169名)和对照组(132名)研究对象的人口特征分布
2.2 单核苷酸多态性和食管癌发生风险
表3显示了MSH2和MLH1基因在食管癌患者组及正常对照组中的等位基因与基因型频率分布。经Hardy-Weinberg遗传平衡定律检验,对照组所有基因型符合遗传平衡(P>0.05),具有群体代表性。在病例组中 MSH2TT,TG和GG基因型频率分布分别为115(68.1%),34(20.1%)和20(11.8%),与对照组差别极大,分别为122(92.4%),10(7.6%)和0。与野生型TT携带者相比,突变杂合子TG和纯合子GG更易患食管癌(OR=5.03,95%CI=1.99-11.08,P=0.001)。对于MLH1,病例组中AA,AG,GG基因型频率分布分别为118(69.8%),48(28.4%)和3(1.8%),与对照组也有一定差别,分别为107(81.1%),24(18.2%)和1(0.7%)。其中突变GG等位基因的携带者发生食管癌的风险是AA野生型纯合子的2.45倍(OR=2.45,95%CI=1.39-47.78,P=0.030)。
2.3 单核苷酸位点多态性相互作用和食管癌发生风险
由于癌症发生发展是一个错综复杂的多因素参与的过程,某一通路上的基因可能会与同一通路上的其它基因作用,甚至可能与其它通路上的某些基因有交互作用,共同调节癌症的易感性。基于先前研究,MSH2和MLH1基因在一定程度上均增加了食管癌的发生风险,我们进一步探究这两个基因之间的相互作用(见表4),发现MSH2和MLH1共同作用于食管癌的发生,且统计学差异性显著。表4所示仅携带一种突变基因型的人发生食管癌的风险是正常非携带者的1.87到2.42倍;携带两种突变基因型的人发生食管癌的风险大大增加,是正常非携带者的14.73倍,这一发现可能会对食管癌的发生提供新的线索。
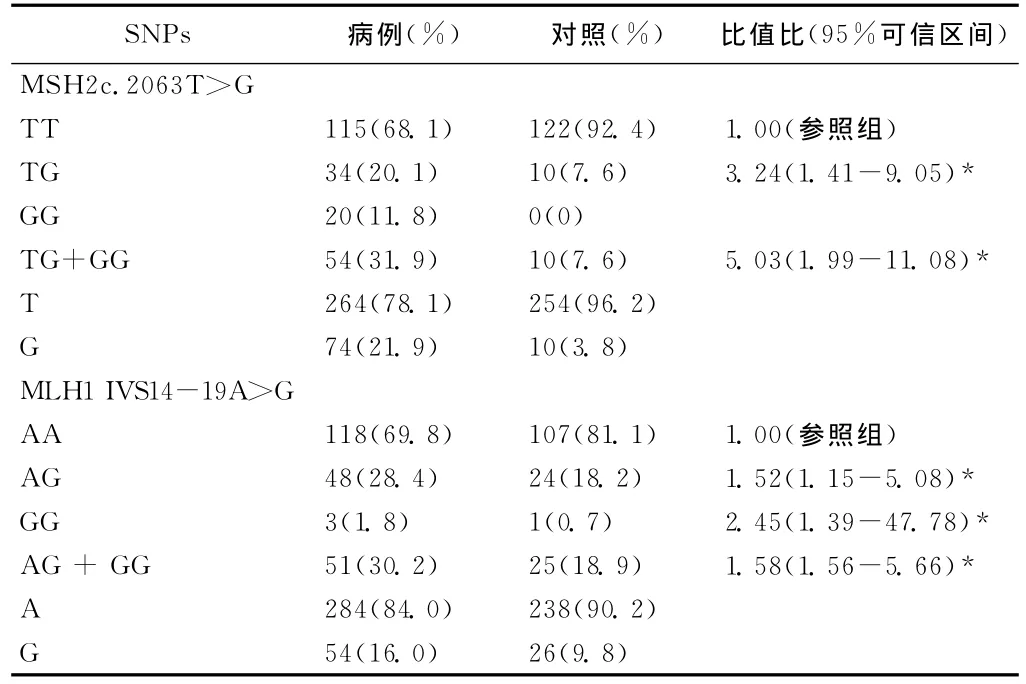
表3 MSH2和MLH1基因型频率分布及其与食管癌风险的关系
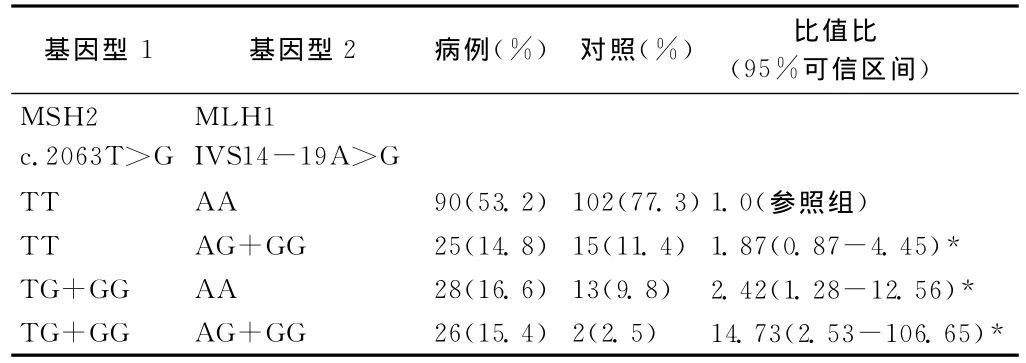
表4 联合分析MSH2和MLH1多态性与食管癌发生风险估计
3 讨论
细胞DNA容易遭受包括细胞内活性物质和环境因素等的一连串打击造成损伤,通过不同修复通路可将DNA损伤导致的中毒和突变的影响减到最小[6]。研究表明,DNA修复能力降低与癌症风险增加有关[1]。许多DNA修复基因具有单核苷酸多态性,导致氨基酸序列替代的SNP可能改变修复酶的活性,食管癌的发生发展,跟所有其他肿瘤一样,牵涉到包括异常细胞周期调控、DNA修复障碍,核受体缺陷等多个基因突变[7]。在本研究中,我们分析了DNA修复基因的两个多态性位点 MSH2c.2063T>G以及MLH1IVS14-19A>G与食管癌易患性的关系。结果发现,两个位点均使食管癌发生风险增加。
MSH2作为错配修复通路上的重要组件,在特定类型的错误比如新链DNA合成碱基配对的错配中起修复作用。在第13号外显子第688位密码子的MSH2c.2063T>G单核苷酸多态性位点位于Walker A基序,这个基序与ATP酶V型结构域的α和β磷酸基团相互作用,是 MSH2修复活性所必须[8]。研究证明,纯化的酵母和人MSH2–MSH6复合体中这一基序中的突变导致该蛋白与ATP的结合和水解能力急剧下降[9],并且在大肠杆菌和酵母中非保守氨基酸的替换导致错配修复能力的下降甚至丢失。这在本研究位点 MSH2c.2063T>G中同样有可能发生,随着非极性疏水性的甲硫氨酸被一个大的带正电荷的精氨酸替代,此结构域由于引入了一个大的正电荷残基可能会有结构上的重大改变。在对宿主细胞再活化分析中,第688位Arg等位基因可能会与内外源性致癌物导致的损伤修复低能有关[10]。目前对错配修复基因MSH2与食管癌关系的研究主要集中在组织蛋白表达水平。研究显示,在食管癌的发生发展过程中存在着MSH2基因的改变,其在组织中的表达下调[11]。另有报道称该基因启动子区DNA甲基化明显高于正常对照组,且甲基化程度随疾病进展增加,表明甲基化与MSH2基因蛋白表达缺失相关,是导致其错配修复功能缺陷的重要原因之一[4]。MLH1基因突变是以DNA微卫星不稳定性为标志的大部分散发性肿瘤的特征之一,此外MLH1基因还参与有丝分裂和减数分裂时的重组事件,与异源双链的校正及细胞凋亡有关。以上证据均不同程度印证了我们的结果,但仍需大量样本量和不同种群人口研究来确证。
MSH2和MLH1多态性联合作用对于食管癌发生风险的统计学意义上的显著性使我们推测,有这样的可能性:两个基因在某些水平相互作用共同维护基因组稳定性,它们中的一个或者两个基因缺陷可能会是食管癌的发生发展因素。总之,本研究表明MSH2c.2063G和mlH1IVS14-19G等位基因对于食管癌的发生起到一定作用,并且MSH2和MLH1两个多态性之间的交互作用大大增加了食管癌的发生风险,表明修复基因之间可能存在一定程度的“交流”,即错配修复基因MSH2和MLH1多态性间共同作用调节各自在食管癌易感性上的致癌效应。这一作用果真存在的话,对于食管癌的发生将是一项新的很有前景的发现,我们将对此进行更深入地研究,为对食管癌发生的分子机制进行更全面的理解、提高筛查效率以及食管癌的治疗和预防将大有裨益。
1 Hiyama T,Yoshihara M,Tanaka S,et al.Genetic polymorphisms and esophageal cancer risk[J].Int J Cancer,2007,121(8):1643-1658.
2 Goode EL,Ulrich CM,Potter JD.Polymorphisms in DNA repair genes and associations with cancer risk[J].Cancer Epidemiol Biomarkers Prev,2002,11(12):1513-1530.
3 Miller KL,Karagas MR,Kraft P,et al.XPA,haplotypes,and risk of basal and squamous cell carcinoma[J].Carcinogenesis,2006,27(11):1670-1675.
4 张功员,马春晓,刘秋亮,等.食管癌组织中hMSH2基因启动子区甲基化检测[J].中华肿瘤杂志,2005,27(9):541-543.
5 Jascur T and Boland CR.Structure and function of the components of the human DNA mismatch repair system[J].Int J Cancer,2006,119(9):2030-2035.
6 Wood RD,Mitchell M,Sgouros J,et al.Human DNA repair genes[J].Science,2001,291(8):1284-1289.
7 邢德印,齐军,谭文,等.北京地区汉族人群DNA修复基因XPD单核苷酸多态性与肺癌及食管癌风险的研究[J].中华医学遗传学杂志,2003,20(1):35-38.
8 Gorbalenya AE,Koonin EV.Superfamily of UvrA-related NTP-binding proteins implication for rational class cation of recombination/repair systems[J].J Mol Biol,1990,213(4):583-591.
9 Obmolova G,Ban C,Hsieh P,et al.Crystal structures of mismatch repair protein MutS and its complex with a substrate DNA[J].Nature,2000,407(7):703-710.
10 Medina-Arana V,Barrios Y,Fernández-Peralta A,et al.New founding mutation in MSH2associated with hereditary nonpolyposis colorectal cancer syndrome on the Island of Tenerife[J].Cancer Lett,2006,244(2):268-273.
11 唐郡,阎晓初,彭贵勇,等.食管鳞状细胞癌癌组织中hMLH1hMSH2的表达及其意义[J].现代生物医学进展,2007,7(11):1687-1689.
