游泳训练改善心梗造成的心肌氧化应激:激活PI3K-AKt信号级联的核心作用
2012-04-29张金梁
张金梁

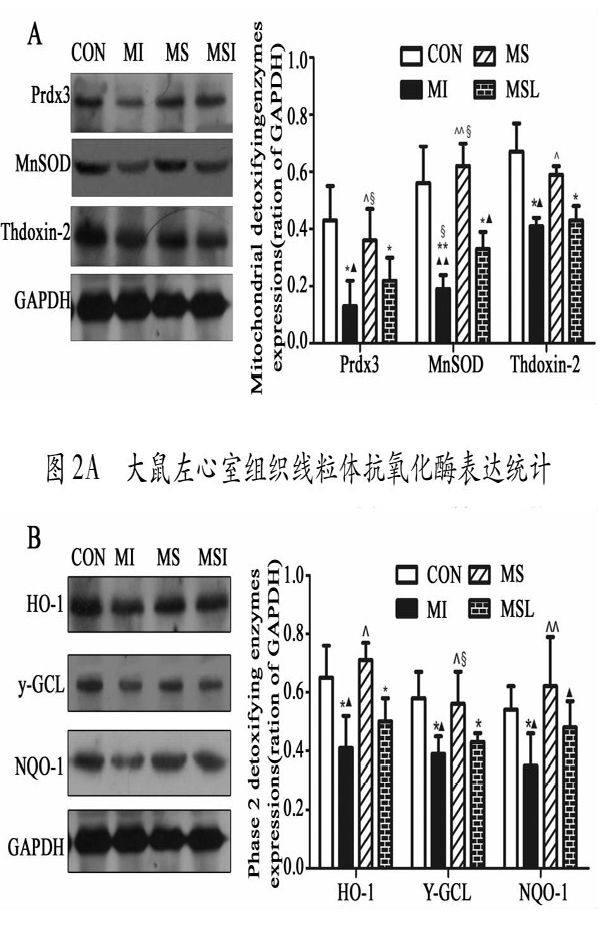

摘要:目的:观察游泳训练对心肌梗死造成的心肌氧化应激的保护作用,并对其内在影响机制进行探索。方法:实验材料Sprague-Dawley大鼠60只,心肌梗死造模完成后随机分成4组:假心梗组(CON),心梗组(MI),心梗游泳训练组(MS),心梗+游泳+LY294002组 (MSL)。每组15只。游泳训练时间共计8周。检测左心室组织氧化应激相关指标,抗氧化酶及相关调控通路及调节蛋白变化。结果:心梗(MI)可造成心肌组织氧化应激水平异常变化:活性氧(ROS)及丙二醛(MDA)明显升高(P< 0.05);线粒体(thioredoxin-2,MnSOD及peroxiredoxin 3)及胞浆中(HO-1,γ-GCL,NQO-1)抗氧化酶提示,MI可引起相关抗氧化酶的水平降低(P< 0.05)。另外,心梗可下调磷脂酰肌醇3激酶-蛋白激酶B (PI3K-AKt)信号通路活性,游泳训练可以有效抑制心梗造成的氧化应激紊乱(降低CAT及MDA),显著性提高线粒体及胞浆中抗氧化酶水平(P< 0.05)。游泳训练引起改善作用(降低氧化应激及提高抗氧化酶)在加入PI3K阻断剂LY294002后部分消失。结论:游泳训练可以有效降低心梗造成的氧化应激反应。其机制可能是,通过上调PI3K-AKt系统活性增加抗氧化酶水平而实现。
关键词:心肌梗死;游泳训练;氧化应激;抗氧化酶
中图分类号:G804.7 文献标识码:A文章编号:1006-2076(2012)05-0062-06
众多研究表明,心肌梗死导致大量心肌细胞坏死、溶解、炎症细胞浸润,导致心功能下降[1~2]。心肌梗死导致由于能量供给不足而引起的细胞内环境异常,心脏代偿性的收缩增加可引起细胞膜烟酰胺腺嘌呤二核苷酸磷酸(NADPH)引起的活性氧水平升高。更严重的是,该活性氧(ROS)水平的升高进而触发线粒体产生大量的ROS(线粒体内存在“氧触发氧释放”机制[3])。氧化应激不仅可攻击细胞膜及其细胞器,还可通过与炎症因子的相互增强作用而导致炎症反应的发生[4],进一步加重心梗造成的心肌损伤。所以,提高抗氧化酶水平,降低ROS含量常被作为心肌梗死治疗的重要思路之一。
相关研究证实,运动训练可以有效改善心梗大鼠病理性心肌重构[5],对抗心梗造成的氧化应激反应,减轻细胞凋亡[6]。虽然以往研究已从不同方面或角度揭示了运动训练对病理性心肌的保护作用,但不幸的是,对于运动训练对抗氧化应激的分子机制研究却令人失望,这也严重限制着运动康复疗法的处方的精确制定。
磷脂酰肌醇3激酶-蛋白激酶B(PI3K-AKt)信号通路参与众多细胞生理学过程,如调节线粒体介导的抗凋亡过程[7],促进糖原转运蛋白表达[8]等。最近有研究证实,该信号级联还参与线粒体内抗氧化酶的生成过程[9]。另有研究指出,该信号级联可能也是引起胞浆中抗氧化酶的重要上游调节机制[10]之一。然运动训练引起的抗氧化作用是否也通过上述机制,目前尚缺乏直接证据。
所以,本研究通过建立心肌梗死动物模型,用游泳训练作为干预手段,检测游泳对心梗大鼠心肌氧化应激状况及相关抗氧化酶的影响,并探讨PI3K/Akt在抗氧化酶调节中的可能作用, 为进一步丰富运动抗氧化作用的分子机制提供实验依据。
蛋白FOXO3a表达统计 在细胞核内的表达统计心肌梗死可造成心肌组织氧化应激水平升高而引起心肌组织氧化损伤。ROS作为一类第二信使,传递应激信号,对细胞产生各种作用。适度的ROS水平可以有效激活细胞的氧化还原敏感型信号通路如MAPKs、PI3K/AKt等,各通路之间可以相互联系,MAPKs、PI3K/AKt通过磷酸化来调节HSF-1、P53、NF-κB等转录因子,从而诱导一系列氧化还原敏感型基因的表达,控制细胞对生长、凋亡、应激等信号的反应[15]。然而超量的ROS可造成细胞凋亡或坏死[16]。心肌梗死引起氧化应激,造成心脏病理性心肌重构及心肌大已得到普遍认可[17~18]。本研究结果也显示,心梗后,大鼠心肌组织氧化应激水平升高(ROS及MDA增多及相关抗氧化酶的表达降低)。游泳训练则可以有效减少MDA及ROS水平(图1)。
线粒体作为细胞中能量合成的最重要细胞器,其不仅为细胞提供能量,同时也是细胞内ROS重要的形成场所。线粒体有自身抗氧化酶系Thioredoxin-2, Prdx3, MnSOD等[19],该体系主要FOXO3a[20]所调控(图4)。正常情况下,能量合成过程所产生的ROS可通过线粒体内抗氧化酶及解耦连蛋白2(UCP2)所清除,所以正常组织中有少量的ROS产生,对于维持正常细胞生理活动发挥激活作用。心肌缺血后由于ROS水平的急剧升高,超过了线粒体其自身清除能力时就会首先造成线粒体损伤(ROS可直接攻击线粒体的DNA[21]及其编码的线粒体蛋白,也包括不饱和脂肪酸如心磷脂),导致线粒体融合及溶解[22]。因此提高线粒体内抗氧化酶对于减轻氧化应激起着第一时间窗作用。FOXO3a不仅可以影响细胞的增殖过程[23]同时还是线粒体抗氧化酶的上游调节蛋白[9]。PI3K/AKt信号通路作为其上游重要的调节机制,直接决定着其活性及功能变化(图4)。因此对于心梗造成的氧化损伤治疗,无论是药物或是补剂都集中在对线粒体抗氧化酶的提高[24]。本研究显示,游泳训练可以显著性增加线粒体内抗氧化酶含量,这和先前的研究结论相一致[25]。
图4 游泳训练引起胞浆及线粒体内抗氧化酶形成的可能机制示意图。左边为线粒体内抗氧化酶形成机制示意图[9];右边为胞浆中抗氧化酶形成示意图[10]。另外,当线粒体ROS含量超过其内抗氧化酶能力时,过多的ROS被释放到胞浆中,又会损伤其他细胞器及细胞膜结构,进而造成心肌细胞损伤。因此,减少胞浆中ROS常作为维持细胞正常功能的次级治疗靶点。其中提高二相酶(胞浆中抗氧化酶如:GST、NQO-1、HO-1)水平也日益受到关注。Nrf2作为二相酶最重要的转录因子,上调Nrf2/ARE通路能够显著提高细胞的抗氧化能力。相关研究证实[26,28-29],线粒体营养素可以有效提高二相抗氧化酶的生成,并指出线粒体营养素能够促进Keap1与Nrf2解离水平及Nrf2磷酸化后向核内转移速率,在细胞核中与更多的Nrf2与抗氧化酶基因上的共同序列ARE结合,从而增加二相解毒酶和抗氧化酶的表达[27](图4)。本研究结果提示,心梗造成二相酶表达减少,提示心梗弱化Nrf2与Keap1的解离水平。这也与Nrf2在细胞核中的表达结果相一致(图3D)。而PI3K/AKt信号通路的变化也证实了其对Nrf2的调控作用。
总之,本研究提示,游泳训练可以有效降低心梗造成的氧化应激,而对PI3K/AKt的激活作用可能是其提高胞浆及线粒体内抗氧化酶的共同机制之一。因此,洞察运动介导的抗氧化作用将有助于全面了解心梗造成的心肌损伤机制及运动训练的保护效应,为心肌梗死的临床防治提供新的治疗思路和实验依据。
参考文献:
[1]Golbidi S, Ebadi S A, Laher I. Antioxidants in the Treatment of Diabetes[J]. Curr Diabetes Rev, 2011.
[2]Henriksen E J, Diamond-Stanic M K, Marchionne E M. Oxidative stress and the etiology of insulin resistance and type 2 diabetes[J]. Free Radic Biol Med, 2010.
[3]Gustafsson A B, Gottlieb R A. Heart mitochondria: gates of life and death[J]. Cardiovasc Res, 2008, 77(2): 334-343.
[4]Martinon F. Signaling by ROS drives inflammasome activation[J]. Eur J Immunol, 2010, 40(3): 616-619.
[5]Xu X, Wan W, Powers A S, et al. Effects of exercise training on cardiac function and myocardial remodeling in post myocardial infarction rats[J]. J Mol Cell Cardiol, 2008, 44(1): 114-122.
[6]French J P, Hamilton K L, Quindry J C, et al. Exercise-induced protection against myocardial apoptosis and necrosis: MnSOD, calcium-handling proteins, and calpain[J]. FASEB J, 2008, 22(8): 2862-2871.
[7]Cheng S M, Ho T J, Yang A L, et al. Exercise training enhances cardiac IGFI-R/PI3K/Akt and Bcl-2 family associated pro-survival pathways in streptozotocin-induced diabetic rats[J]. Int J Cardiol, 2012.
[8]Cao S C, Zhao G, Chang B, et al. [Effects of exercise on expression and phosphorylation of PI3K and PKB in insulin signaling in the skeletal muscles of type 2 diabetic rats][J]. Nan Fang Yi Ke Da Xue Xue Bao, 2010, 30(6): 1217-1221.
[9]Cox A G, Winterbourn C C, Hampton M B. Mitochondrial peroxiredoxin involvement in antioxidant defence and redox signalling[J]. Biochem J, 2010, 425(2): 313-325.
[10]Feng Z, Liu Z, Li X, et al. alpha-Tocopherol is an effective Phase II enzyme inducer: protective effects on acrolein-induced oxidative stress and mitochondrial dysfunction in human retinal pigment epithelial cells[J]. J Nutr Biochem, 2010, 21(12): 1222-1231.
[11]Wang Y H, Hu H, Wang S P, et al. Exercise benefits cardiovascular health in hyperlipidemia rats correlating with changes of the cardiac vagus nerve[J]. Eur J Appl Physiol, 2010, 108(3): 459-468.
[12]史仍飞,胡莉莉,李志刚,等.雷帕霉素和LY294002对游泳训练大鼠骨骼肌生长及PI3K/Akt/mTOR信号通路的影响[J].体育科学,2011(7).
[13]王湧涛,景志强,张钧.运动对糖尿病大鼠LPL和HL影响的研究[J].北京体育大学学报,2008, 31(1): 47-49.
[14]Zhu L, Liu Z, Feng Z, et al. Hydroxytyrosol protects against oxidative damage by simultaneous activation of mitochondrial biogenesis and phase II detoxifying enzyme systems in retinal pigment epithelial cells[J]. J Nutr Biochem, 2010, 21(11):1089-1098.
[15]朱红军,江钟立.运动与氧化应激的预适应[J].中国康复医学杂志,2003,(2): 58-60.
[16]Hori M, Nishida K. Oxidative stress and left ventricular remodelling after myocardial infarction[J]. Cardiovasc Res, 2009, 81(3): 457-464.
[17]Kinugawa S, Tsutsui H, Hayashidani S, et al. Treatment with dimethylthiourea prevents left ventricular remodeling and failure after experimental myocardial infarction in mice: role of oxidative stress[J]. Circ Res, 2000, 87(5): 392-398.
[18]Surekha R H, Srikanth B B, Jharna P, et al. Oxidative stress and total antioxidant status in myocardial infarction[J]. Singapore Med J, 2007, 48(2): 137-142.
[19]Cox A G, Winterbourn C C, Hampton M B. Mitochondrial peroxiredoxin involvement in antioxidant defence and redox signalling[J]. Biochem J, 2010, 425(2): 313-325.
[20]Victor V M, Rocha M, Herance R, et al. Oxidative stress and mitochondrial dysfunction in type 2 diabetes[J]. Curr Pharm Des, 2011, 17(36): 3947-3958.
[21]Ide T, Tsutsui H, Hayashidani S, et al. Mitochondrial DNA damage and dysfunction associated with oxidative stress in failing hearts after myocardial infarction[J]. Circ Res, 2001, 88(5): 529-535.
[22]Tsutsui H, Kinugawa S, Matsushima S. Mitochondrial oxidative stress and dysfunction in myocardial remodelling[J]. Cardiovasc Res, 2009, 81(3): 449-456.
[23]Miyamoto K. FoxO3a is essential for the maintenance of hematopoietic stem cell pool[J]. Rinsho Ketsueki, 2008, 49(3): 141-146.
[24]Tsutsui H, Kinugawa S, Matsushima S. Mitochondrial oxidative stress and dysfunction in myocardial remodelling[J]. Cardiovasc Res, 2009, 81(3): 449-456.
[25]Brinkmann C, Chung N, Schmidt U, et al. Training alters the skeletal muscle antioxidative capacity in non-insulin-dependent type 2 diabetic men[J]. Scand J Med Sci Sports, 2011.
[26]Kwak M K, Itoh K, Yamamoto M, et al. Enhanced expression of the transcription factor Nrf2 by cancer chemopreventive agents: role of antioxidant response element-like sequences in the nrf2 promoter[J]. Mol Cell Biol, 2002, 22(9): 2883-2892.
[27]Liu J. The effects and mechanisms of mitochondrial nutrient alpha-lipoic acid on improving age-associated mitochondrial and cognitive dysfunction: an overview[J]. Neurochem Res, 2008, 33(1): 194-203.
[28]Liu J, Atamna H, Kuratsune H, et al. Delaying brain mitochondrial decay and aging with mitochondrial antioxidants and metabolites[J]. Ann N Y Acad Sci, 2002, 959: 133-166.
[29]Zhu L, Liu Z, Feng Z, et al. Hydroxytyrosol protects against oxidative damage by simultaneous activation of mitochondrial biogenesis and phase II detoxifying enzyme systems in retinal pigment epithelial cells[J]. J Nutr Biochem, 2010, 21(11): 1089-1098.
