云南红河和文山地区女性宫颈人乳头瘤病毒感染基因亚型分布状况研究
2012-04-26赵菊芬杨柳风霍竹蕙段丽娅
赵菊芬,李 茜,张 琴,杨柳风,霍竹蕙,段丽娅
子宫颈癌是最常见的妇科恶性肿瘤之一,在全球妇女癌症死亡率中位居第二。高危型人乳头状瘤病毒 (HPV)的持续感染是宫颈癌及其癌前病变的直接原因,对HPV感染的检测是诊断宫颈病变的重要依据[1]。HPV感染具有很强的地域性,不同国家与地区HPV感染基因分型的流行病学分布不同。为了解云南红河和文山多民族地区HPV感染流行病学特征,我院采用凯普医用核酸分子快速导流杂交基因芯片技术,对来自云南红河和文山多民族地区的2 887名女性进行生殖道21种HPV感染基因亚型筛查,分析常见感染亚型及分布特点,现报道如下。
1 资料与方法
1.1 临床资料 选取2009年3—9月在我院就诊的来自云南省红河和文山两个多民族地区的女性2 887名,年龄20~79岁,平均年龄 (38.9±2.4)岁。均无盆腔放疗、化疗史。
1.2 仪器与试剂 HPV-DNA提取试剂盒、聚合酶链式反应(PCR)扩增仪、凯普Hybrimax医用核酸分子快速杂交仪,HPV基因微阵列分型检测试剂盒。
1.3 标本采集和处理 采用凯普公司配套专用宫颈刷置于宫颈口,沿顺时针旋转5周获得足够的移行区上皮细胞样本取出,放入3 ml专用细胞保存液中,沿刷柄折痕处将宫颈刷柄折断,旋紧管盖,做好样本标记,立即送检。
1.4 检测方法 HPV感染基因亚型检测步骤:(1)样本DNA提取:取标本500μl,以14 000 r/min离心1 min,弃上清液后,用试剂盒提取DNA。(2)PCR扩增:将PCR试剂及Taq酶按比例混合后在反应管加入24μl,混合后进行PCR扩增。每一批同时扩增HPV 18型阳性对照及阴性对照各一份。(3)核酸分子快速导流杂交:采用凯普医用核酸分子快速杂交仪及配套试剂盒,在杂交平台上放入标记有21种HPV基因型寡核苷酸探针的低密度基因芯片杂交膜,按试剂盒说明进行导流杂交,酶标显色。(4)结果判断:肉眼观察检测结果,阳性点为清晰可见的蓝紫色圆点,根据膜条HPV分布图,判断阳性点为何种类型的HPV。本检测将HPV分为21种基因亚型,其中13种高危亚型为:16、18、31、33、35、39、45、51、52、56、58、59、68,5种低危亚型为:6、11、42、43、44,中国人常见亚型为:53、66、CP8304。
1.5 统计学方法 采用SPSS 11.5统计软件进行统计学分析,计数资料采用χ2检验,p<0.05为差异有统计学意义。
2 结果
2.1 HPV基因型分布 2 887名女性中有406名感染HPV,总阳性率为14.1%,21种基因亚型均被检出。HPV各亚型感染率分布从高到低依次为 HPV 68(24.1%,98/406)、16(19.5%,79/406)、52(13.5%,55/406)、58(9.6%,39/406)、18(9.1%,37/406)、31(8.1%,33/406)、6(6.8%,28/406)、33(5.7%,23/406)、CP8304(5.2%,21/406)、43(4.2%,17/406)、39(3.9%,16/406)、11(3.9%,16/406)、53(3.4%,14/406)、59(2.7%,11/406)、66 (2.0%,8/406)。44 (1.0%,4/406)、56(1.0%,4/406)、35(1.0%,4/406)、45(0.7%,3/406)、51(0.7%,3/406)、42(0.2%,1/406)型。高危型中排列前5位的是:68、16、52、58、18;低危型中最常见的是:6、43;中国人常见亚型:CP8304。
2.2 不同年龄组女性HPV感染基因亚型检出情况比较2 887名女性按不同年龄段分为3组,20~35岁组1 328例、36~45岁组1 168例、>45岁组391例。HPV感染人群中以高危亚型 (包括单纯高危感染及高低危混合感染例数)为主,占82.8%(336/406)。3组的HPV感染检出率及类型比较,差异均无统计学意义 (P>0.05,见表1)。
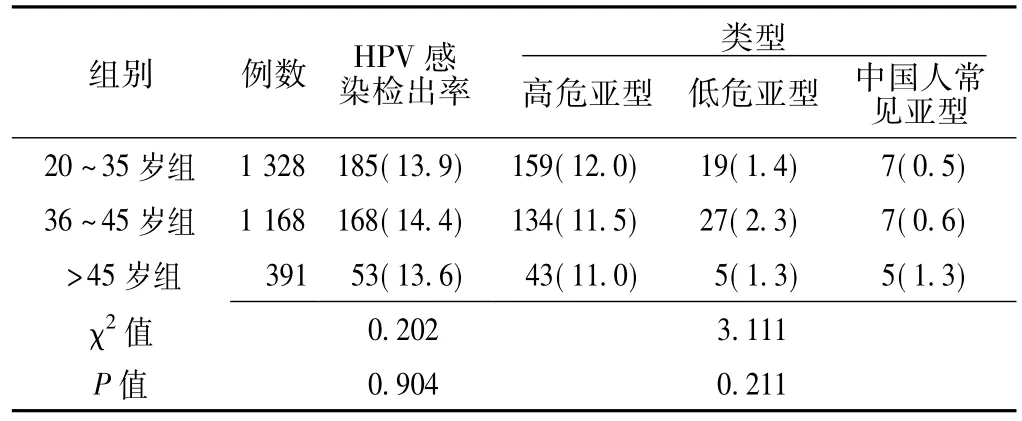
表1 不同年龄组女性HPV感染基因亚型检出情况比较〔n(%)〕Table1 Comparison of HPV subtype detection between different age groups of women
2.3 不同年龄组女性HPV单一感染和多重感染率比较2 887名女性HPV感染阳性406例,其中单一感染330例,占81.3%;二重感染57例,占14.0%;三重感染15例,占3.7%,四重感染3例,占0.7%,六重感染1例,占0.2%;无五重感染;感染最多的有6个亚基因型,仅有1例样本。3组单一感染与多重感染率比较,差异均无统计学意义 (P>0.05,见表2)。
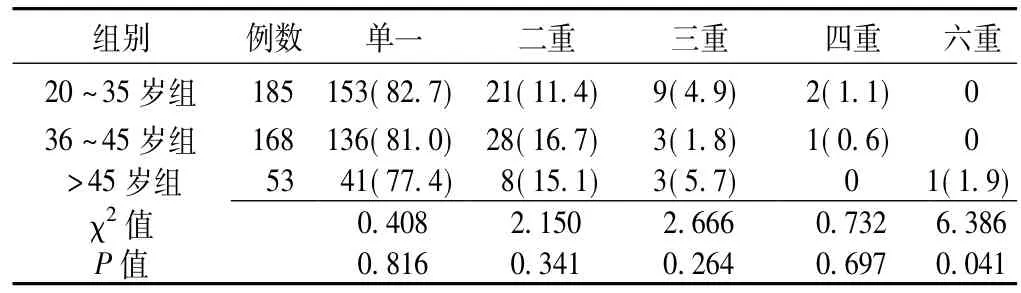
表2 不同年龄组女性HPV单一感染和多重感染率比较〔n(%)〕Table 2 Comparison of HPV single infection and multiple infections between different age groups of women
3 讨论
近年来,女性生殖道的HPV感染由于与宫颈癌密切相关而越来越受到人们的重视。HPV基因分型检测方法在评价宫颈癌前病变和宫颈癌的流行及发生方面,被认为是一种初筛宫颈癌较好的方法[2]。高危型HPV的持续感染是宫颈癌及其癌前病变的直接病因,没有持续高危的HPV感染,便没有可能发生宫颈癌。HPV感染的检测已成为预防、诊断、处理宫颈病变的重要依据[1]。
3.1 HPV感染率及基因亚型存在地区差异 本研究利用导流杂交技术对云南省红河和文山2个多民族地区的2 887名女性的宫颈HPV感染基因亚型进行检测,HPV感染406例,总感染率为14.1%,高于冯淑燕等[3]报道的福建厦门市思明区1 026例育龄妇女11.6%的感染率;低于沈艳红等[4]报道的山西省子宫颈癌高发区30~50岁妇女27.55%的感染率和彭秀红等[5]报道的广东674例年轻女性23.33%的感染率以及周杨杨[6]报道的淮安457例妇女55.6%的感染率。与彭永排等[7]报道广州市1 285例20~74岁女性17.7%的感染率相近。高危型HPV持续感染是宫颈癌及癌前病变发生发展的必要条件,在国际癌症协会 (IARC)的最新研究中,15种最常见的亚型分别为 16、18、45、31、33、52、58、35、59、51、73、68、66、53和83[8]。但上述研究未包括中国人。除16亚型外,18亚型感染率最高;居第3位的在非洲、南亚、欧洲、北美是45亚型,而在美国中南部则为31亚型;居第4位的在非洲北部是33和31,非洲南部则是33、58和56亚型,美国中南部是45和33亚型,南亚是52和58亚型,欧洲和北美是31和56、58亚型[9]。日本52亚型居第2位,韩国33和58亚型分别居第2、3位。目前,全世界HPV感染基因亚型最常见的是16,中国人中16、18、52、58、31、33是常见亚型[10],其他常见亚型存在地区差异。本研究结果显示,HPV 68感染率最高,HPV 16为第2位,HPV 52、58为第3、4位,与世界范围的研究不太一致。但HPV 52、58仅次于HPV 16,这一点符合亚洲人群研究结果。与我国境内其他地区相比,HPV常见基因亚型也有一定地区差异:浙江省台州地区常见基因亚型依次为16、11、52、33、58;北京地区常见基因亚型依次为16、58、52、53、33;西安地区常见基因亚型依次为16、6、39、58、11;广州地区宫颈癌常见基因亚型为:16、52、58、68、33、53、59、CP3804、44[2]。本研究中云南红河和文山多民族地区常见HPV感染基因亚型依次为68、16、52、58、18、31型。杨英捷等[11]研究北京地区女性,陶萍萍等[12]研究绍兴地区女性,结果均提示HPV感染基因亚型除16、52、58型外,CP8304在我国最常见。本研究结果显示,中国人常见HPV感染基因亚型仍为CP8304,与上述研究结果一致。但本研究中高危亚型HPV 68感染率最高,与其他研究结果均有所不同,最常见低危亚型HPV 6、43感染率与其他研究结果一致。表明HPV感染常见基因亚型具有明显的人群和地域特点。
3.2 HPV感染的年龄分布 目前对HPV感染与年龄的相关性有不同观点。我国对山西省子宫颈癌高发区30~50岁女性HPV感染的调查结果显示,不同年龄女性HPV感染率无明显差异[4]。杨英捷等[11]报道北京地区女性各年龄段HPV感染检出率差异有显著性意义。王鲁平等[1]报道北京地区各年龄组女性HPV感染无差异,但年龄是HPV感染的重要因素,30岁以前的性活跃期,HPV感染颇为常见且易于清除;30岁以后HPV感染率下降,但随着年龄增长,宫颈癌发病率明显上升。高危型HPV感染容易促成宫颈癌的发生,并随年龄增加其构成比逐步增加[13]。本研究结果显示,不同年龄段HPV感染率无差异。
HPV感染主要通过性生活传播,感染后通常无明显的临床症状。HPV在人群中普遍存在,然而大多数女性HPV感染是一过性的,特别是年轻女性机体对病毒的限制或清除功能远比年长女性强[14]。因此,应用HPV检测在宫颈癌防癌筛查中应注意受检者的年龄。35岁以后高危亚型HPV的持续感染是宫颈癌的直接原因,特别是同一基因高危亚型HPV的持续感染更易造成宫颈癌。因此,对已婚女性,尤其对围绝经期女性积极开展HPV感染基因亚型检测以预防宫颈癌及宫颈癌前病变的发生很重要。
3.3 HPV多重感染情况 云南省红河和文山两地区女性HPV感染以单一感染为主,占81.2%。HPV多重感染率为18.71%,低于陶萍萍等[12]报道的44.35%。本研究结果显示,在多重感染中,二重感染比例最高,为75.0%,各年龄段的单一感染率及多重感染率无差异。HPV感染的基因亚型数的多少是否提高宫颈病变的发生率一直是学者们关注的问题,但目前仍无统一说法。不少学者认为HPV多重感染并不增加宫颈癌的发生,但也有学者认为HPV多重感染出现持续性感染的危险性更大,而HPV的持续感染是宫颈病变发生的原因,因此,多重感染易导致宫颈病变[15]。HPV多重感染可能与患者的性伴侣数有关,性伴侣越多,多重感染可能性就越大。研究发现,HPV单一感染和多重感染的清除率相当,但某些特殊亚型,如HPV 16的感染和多重感染清除率低可能更易导致持续性感染,发生宫颈上皮内瘤变 (CIN)2、3级甚至鳞癌(SCC)[16]。对于云南红河和文山地区HPV感染基因亚型与宫颈病变的关系,需在以后的工作中继续研究。
由于HPV感染与宫颈癌及癌前病变的关系密切,且高危亚型与低危亚型以及单一和多重感染引起组织学变化不同,因此,早期、定期进行HPV分型检测并结合宫颈细胞学检查对宫颈癌的预防和治疗极为重要。
1 于妍妍,金哲,刘艳霞,等.宫颈高危HPV感染与阴道内环境相关因素分析 [J].疑难病杂志 ,2011,10(9):673.
2 罗招凡,王惠英,彭永排,等.快速导流杂交法检测人乳头瘤病毒基因分型及其临床意义 [J].中国热带医学,2007,27(9):144-145.
3 冯淑燕,冯淑玲.1026例育龄妇女HPV感染情况调查及分析[J].中国妇幼保健,2011,26(9):1374-1377.
4 沈艳红,陈凤,黄曼妮,等.我国山西省子宫颈癌高发区人乳头瘤病毒感染调查[J].中国医学科学学报,2003,25(4):381-384.
5 彭秀红,毛玲芝,邓群娣,等.人乳头瘤病毒DNA分型检测在年轻妇女宫颈病变诊断中的价值 [J].中国生育健康杂志,2009,20(2):183-186.
6 周杨杨.人乳头瘤病毒感染筛查结果分析[J].临床检验杂志,2009,27(3):187-192.
7 彭永排,林仲秋,陆晓楣,等.广州市1285例志愿者宫颈人乳头瘤病毒病毒感染调查 [J].国际医药卫生导报,2010,16(1):20-24.
8 钟伟明,郭静,吴汉锋,等.高危型人乳头瘤病毒感染状况和年龄分布[J].中国全科医学,2011,14(5):1515.
9 邱小华,刘伟.宫颈癌患者人乳头瘤病毒基因检测分型研究 [J].中国全科医学,2011,14(7):2360.
10 郜红艺,张佳立,张江宇,等.人乳头瘤病毒病毒感染者宫颈组织病理学研究[J].热带医学杂志,2006,6(7):188-192.
11 杨英捷,赵健.2285例女性下生殖道人乳头瘤病毒病毒感染筛查结查分析[J].中国实用妇科与产科杂志,2006,27(6):111-113.
12 陶萍萍,苄美璐,欧华,等.导流杂交基因芯片技术在人乳头状瘤病毒检测中应用的研究 [J].中华妇产科杂志,2006,41(1):43-47.
13 周武,陈占国,陶志华,等.不同HPV亚型的多重感染和年龄因素与宫颈病变的关系[J].中国卫生检验杂志,2008,18(12):172-174.
14 涂权梅,邱海凡,刘奕,等.人乳头瘤病毒检测筛查早期宫颈癌的意义——妇科门诊3 700例人乳头瘤病毒筛查分析[J].中国全科医学,2010,13(5):1611.
15 吕荣宇.宫颈病变与HPV多重感染的关系探讨[J].中国热带医学,2007,7(9):146-147.
16 周莉,陈姗,张帝开,等.持续性人乳头瘤病毒感染与宫颈癌的研究进展 [J].中国病理生理杂志,2010,26(12):2482-2486.
