郫县豆瓣高酶活米曲霉选育鉴定及复合菌制曲改善酶系组成研究——郫县豆瓣高酶活米曲霉的选育鉴定
2012-04-13周昌豹张蓓蓓
李 峰,赵 萍,周昌豹,宋 萍,张蓓蓓
(四川省食品发酵工业研究设计院,四川 成都 611130)
郫县豆瓣是我国传统特色发酵食品的典型代表,历史悠久,为中华传统生物食品产业之瑰宝,是源自中国本土的生物技术产业,是全国著名的地理标志产品。郫县豆瓣因红润光亮、酱香浓郁、味辣香醇、瓣粒酥脆、黏稠绒实等优点受到消费者青睐,堪称川菜之魂。其依赖四川优越的气候、地理、环境、人文、饮食条件及独创性的生产技艺,历经300多年的演变、沉淀、锤炼、升华,自成一家、长盛不衰,深受国内外消费者喜爱和同行的广泛关注与认同。非物质文化遗产郫县豆瓣于2000 年4 月21 日获得国家工商总局商标局批准的“郫县豆瓣”地理标志证明商标,并获得中国驰名商标等荣誉称号。目前郫县豆瓣从传统的烹饪调料发展到系列复合调味品:火锅底料、烧菜调料、鱼调料、饭扫光、佐料系列等新产品,销售遍布全国各省、市,并出口美国、加拿大、新西兰、日本等国家。
1 材料和试剂
豆瓣样品:从郫县豆瓣生产企业采集样品。
培养基:菌落分离采用PDA培养基;菌种鉴定采用察氏培养基。
PDA培养基:马铃薯削皮,切成块煮沸30min,然后用纱布过滤,再加糖及琼脂,溶化后补足水至1000mL,pH值自然,121℃菌20min。
察氏培养基:硝酸钠3g,磷酸氢二钾1g,氯化钾0.5g,硫酸镁(MgSO4·7H2O)0.5g,硫酸亚铁0.01g,蔗糖30g,琼脂20g,蒸馏水1000mL,加热溶解,分装后121℃灭菌20min。
固体培养基:按照麸皮:豆粕为4:1的比例混匀,并加入干料量75%(v/w)的水,拌匀。121℃、0.1 MPa灭菌45min。
主要试剂:福林试剂(Folin试剂)、二硝基水杨酸(DNS)试剂均为实验室自配、Tris-HCl,EDTA,PCR扩增产物纯化试剂盒等;蚕豆、麸皮、豆粕均购自农贸市场;其他试剂均购自成都百旺化学试剂公司。
2 仪器和设备
主要仪器:752型紫外可见分光光度计,HH-600(0)型电子恒温水浴锅,LXJ-II离心沉淀机,PHS-3C型精密pH计,LRH-250A型生化培养箱,XS-18型光学显微镜,Bio-rad PCR仪,Thermo小型离心机,电泳仪,摇床,超净工作台。
3 实验内容和方法
3.1 米曲霉的分离纯化
无菌条件下,将曲捣碎,称取适量样品,选取适宜的稀释度用生理盐水稀释,采用含青霉素100单位/mL的PDA培养基,采用稀释涂布平板法。每个稀释接种3个平板,放置于30℃的培养箱内培养至48h,进行观察,将菌落形态不同的菌种分离,各自传代培养,至少进行3次传代分离,得到纯化菌种,保存菌种备用。
3.2 高酶活米曲霉的筛选
将纯化好的单个菌株接入到固体发酵培养基中,按照麸皮:豆粕为4:1的比例混匀,并加入干料量75%(v/w)的水,拌匀。121℃、0.1MPa灭菌45min,冷却后分别接入菌种,在30℃恒温培养72h。以酸性蛋白酶、中性蛋白酶和淀粉酶活力作为复筛的标准,筛选出酶活相对较高的米曲霉菌株。
3.3 菌种鉴定
对筛选出的菌株采用划线平板培养后进行培养特征的观察。菌体特征及孢子结构观察从菌落上挑取菌丝及产孢结构,制普通玻片进行光学显微镜观察;根据筛选菌株的菌落、菌丝、抱子形态显微镜照片特性进行鉴定。
3.4 酶活力测定
3.4.1 蛋白酶测定方法
粗酶液制取方法:上述制得固体曲样品中按重量加入1:20(w/v)的缓冲溶液,于40℃水浴中浸提1h,间歇搅拌,过滤得粗酶液。此粗酶液用于各种蛋白酶酶活性测定。
酶活测定方法:采用福林酚法。
3.4.2 淀粉酶测定
样品处理:酶液提取方法同蛋白酶测定,取5mL粗酶液,在7000r/min离心30min,吸取上清液测定酶活性。
酶活测定方法:参照SOMOGYI M的方法进行测定。
3.5 菌株DNA的提取
(1)取适量菌丝,加入500mL 5×CTAB,再加适量的玻璃珠,漩涡振荡器上高速振荡4min~5min。
(2)65℃保温20min,每隔10min摇匀1次。
(3)加入等体积氯仿:异戊醇(24:1,v/v),12000r/min离心10min。
将上清液移入新的离心管中,重复此步骤。
(4)在上清中加入2倍体积预冷的无水乙醇,-20℃静置20min~30min,12000r/min离心10min。
(5)倒掉上清,加70%vol的酒精200mL洗沉淀,室温干燥。
(6)加入100mL TE使DNA完全溶解;加入RNase A(10mg/mL),65℃保温30min。
(7)重复步骤4~6。最后DNA 溶于30mL超纯水。
3.6 PCR扩增
根据真菌整个ITS区设计通用引物序列为:
正向引物:ITS4:5‘-TCCTCCGCTTATTGATATGC-3’反向引物:ITS5:5‘-GGAAGTAAAAGTCGTAACAAGG-3’,以霉菌的DNA基因组为模板,扩增ITS序列。
PCR扩增条件:94℃预变性5min,94℃变性30s,50℃退火1min,72℃延伸1min,进行35个循环,最后72℃延伸10min。
3.7 PCR产物的电泳
进行1%的琼脂糖凝胶电泳。90V电压条件下,电泳40min。
4 结果分析
4.1 酶活力测定
将筛选出的菌种ddQ-125和jcQ-93进行蛋白酶活力和淀粉酶活力测定,对照菌是市售曲精C结果见图1。
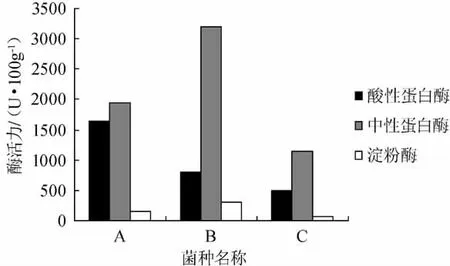
图1 米曲霉菌种的酶活力Fig.1 Enzyme activity of the Aspergillus oryzae strain
由图1可知,菌株ddQ-125酸性蛋白酶活力最强,菌株jcQ-93的中性蛋白酶和淀粉酶的酶活力较菌株最强,酶活力均高于对照市售曲精C。
4.2 菌种的形态学观察
经平板筛选和分离纯化,从郫县豆瓣生产企业收集样品中分离筛选出2株霉菌,编号为ddQ-125和jcQ-93。
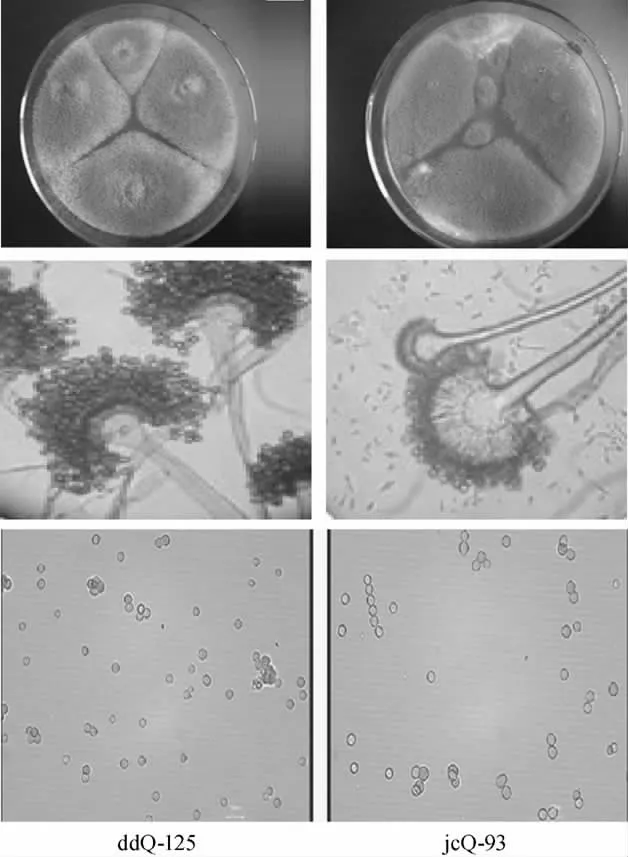
图2 菌种的形态特征Fig.2 Morphological characteristics of strains
菌株ddQ-125和jcQ-93的菌落、菌丝和抱子形态如图2,在PDA培养基上,25℃培养7d,产出黄色或黄绿色孢子,菌落表面絮状、边缘白色绒毛状。菌落蔓延迅速,初为白色,后变成黄绿色或黄褐色。背面无色或中央略带黄褐色。分生抱子梗自基质中伸出,分生孢子穗半圆形,小梗1层或2层;顶囊半球形、圆拱形以至球形;分生孢子球形。通过形态和显微观查结果,初步鉴定这两株菌为米曲霉。
4.3 PCR反应结果
将反应后的PCR产物于1.0%琼脂糖缓冲系统,90V电压条件下,电泳40min,用凝胶成像系统观察并摄影记录。所有菌株都产生单一的明亮条带,且所有的条带均为所需条带的长度,正好为目的片段的长度,见图3。

图3 菌株ddQ-125和jcQ-93的rDNA-ITS部分序列的PCR扩增电泳图Fig.3 Electropherogram of strain ddQ-125 and jcQ-93 partial sequences of rDNA-ITS PCR amplification
4.4 菌株的ITS序列分析
4.4.1 ddQ-125菌株扩增ITS部分基因序列
CGAAGGACATTACCGAGTGTAGGGTTCCTAGCGAG CCCAACCTCCCACCCGTGTTTACTG TACCTTAGTT G CTTCGGCGGGCCCGCCATTCATGGCCGCCGGGG GCTCTCAGCCCCGGGC CCGCGCCCGCCGGAGACA CCACGAACTCTGTCTGATCTAGTGAAGTCTGAGTT GATTGTA TCGCAATCAGTTAAAACTTTCAACAATG GATCTCTTGGTTCCGGCATCGATGAAGAACGCAGC GAAATGCGATAACTAGTGTGAATTGCAGAATTCCG TGAATCATCGAGTCTTTGAACG CACATTGCGCCCC CTGGTATTCCGGGGGGCATGCCTGTCCGAGCGTCA TTGCTGCCCATC AAGCACGGCTTGTGTGTTGGGT CGTCGTCCCCTCTCCGGGGGGGACGGGCCCCAAAG GCA GCGGCGGCACCGCGTCCGATCCTCGAGCGTAT GGGGCTTTGTCACCCGCTCTGTAGGCCC GGCCGGC GCTTGCCGAACGCAAATCAATCTTTTTCCAGGTTGA CCTCGGATCAGGTAGGG ATACCCGCTGAACTTAAG CATATCAATAAG GGAGGAAA
4.4.2 jcQ-93菌株扩增ITS部分基因序列
CTACCTGATCCGAGGTCACCTGGAAAAAGGATGAT TTGCGTTCGGCAAGCGCCGGCCGGG CCTACAGAGC GGGTGACAAAGCCCCATACGCTCGAGGATCGGACG CGGTGCCGCCGCTGC CTTTGGGGCCCGTCCCCCCC GGAGAGGGGACGACGACCCAACACACAAGCCGTGC TTGAT GGGCAGCAATGACGCTCGGACAGGCATGCC CCCCGGAATACCAGGGGGCGCAATGTGCGT TCAAA GACTCGATGATTCACGGAATTCTGCAATTCACACTA GTTATCGCATTTCGCTGCG TTCTTCATCGATGCCGG AACCAAGAGATCCATTGTTGAAAGTTTTAACTGATT GCGATA AATCAACTCAACTTCACTAGAATCAGACA GAGTTCGTGGTGTCTCCGGCG GCGCGGGCCCGGGG CTGAGAGCCCCCGGCGGCCATGAATGGCGGGCCCG CCGAAGCAACTAAGGTACAG TAAACACGGGTGGG AGGTTGGGCTCGCTAGGAACCCTACACTCGGTAAT GATCCTTCCGC AGGTTCACCTACGGAAACCTTGTTA CG
采用真菌通用R/F引物扩增米曲霉ITS部分序列。经PCR扩增测序进一步鉴定其中ddQ-125和jcQ-93菌株确属于Aspergillus oryzae;将测得的A、B菌株的ITS序列在Gen-Bank数据库中进行同源序列比对。结果显示,两菌株与米曲霉的ITS序列相似性达到99%以上。
5 结论
从郫县豆瓣中分离筛选出得到两株优势菌,根据形态学和分子生物学的特性,鉴定为米曲霉,本研究采用真菌核糖体转录间隔区(ITS)的引物,进行PCR扩增,并将PCR产物进行ITS序列测序。测序结果与Genbank进行同源序列比对,结果显示菌株ddQ-125和jcQ-93的序列与Genballk已知序列相似率可达99%以上。霉菌的序列分析结果与形态学鉴定基本一致。新分离的高酶活菌株将用于郫县豆瓣复合菌制曲的研究。
[1]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[2]刘彩香.传统酱种曲中霉菌的分离鉴定及培养条件的优化[D].武汉:湖北工业大学硕士论文,2011.
[3]解顺昌,等.一株甲基对硫磷降解菌——米曲霉JMUPMD-2 的分离与鉴定[J].微生物学通报,JUL 20,2011,38(7):1007-1013.
[4]鲁 绯,等.一株丹贝中分离霉菌的鉴定[J].中国酿造,2010,29(6):35-37.
[5]贡汉坤,姚海清.传统酱类自然发酵的微生物学分析[J].中国调味品,2003(10):9-12.
[6]陈 丽.传统发酵豆酱制品菌群动态分析及功能菌的筛选[D].哈尔滨:黑龙江大学硕士论文,2009.
[7]李幼筠.“郫县豆瓣”剖析[J].中国酿造,2008,27(11):83-84.
[8]邓 静,徐 静,吴华昌,等.米曲霉高产酸性蛋白酶菌株的选育[J].中国调味品,2010(1):53.
[9]周其洋,陶文沂.米曲霉多酶系优良菌株的诱变选育[J].中国调味品,2009(9):60.
[10]刘旭川,王 勇,罗 成,等.Viili 中霉菌的分离纯化与鉴定[J].食品科学,2010,31(3):208.
[11]SOMOGYI M.Modifications of two methods for the assay of amylase[J].Clin Chem,1960,6(1):23-35
[12]MILLER G L.Use of dinitrosalicylic acid reagent for determination reducing sugar[J].Anal Chem,1959,31(3):426-428.
