一株水解大豆蛋白细菌的鉴定及其酶学性质研究
2012-04-13李娟娟
任 丹,陈 曦,李娟娟,冯 镇*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
我国传统发酵大豆食品资源丰富,主要有豆酱、豆豉、酱油和腐乳等[1]。许多大豆发酵食品多以传统的方式进行生产,因而存在生产周期长的问题。过长的成熟期会导致较高的生产成本。为了缩短传统发酵食品的成熟周期,国内外学者做了大量研究,主要途径为提高成熟温度、使用经过修饰的发酵剂、添加辅助发酵剂或是直接添加蛋白酶,而在这些途径中,使用蛋白酶来缩短发酵周期被认为是最简单和行之有效的方法[2-5]。研究表明,对于具体的发酵食品而言,使用非固有发酵剂虽然可以达到促进成熟的目的,但往往改变了产品的特征质构与风味[6]。对于外源酶的使用也存在相同的问题。因此,为了不改变传统发酵食品的特征质构与风味,研究者往往是从发酵食品中筛选具有良好发酵特性的固有发酵剂菌株或是利用来源于固有发酵剂菌株的酶,进行发酵食品的促熟研究。发酵食品特征风味的形成是一个复杂生物化学反应的综合结果,包括由发酵微生物导致的糖酵解、脂肪水解和蛋白水解。对于发酵食品的风味和质构特性而言,蛋白水解无疑是最重要的生化过程[7]。因此,发酵食品成熟的实质之一是参与发酵的微生物所分泌蛋白酶作用于蛋白质的结果。微生物所分泌的蛋白酶水解食品基质中的蛋白质产生游离氨基酸和肽,同时赋予发酵食品特征的风味和质构。因此,研究参与食品发酵微生物所分泌蛋白酶的酶学性质对于微生物及其蛋白酶的应用至关重要。
在前期工作中,从我国传统发酵腐乳中筛选出一株可以水解大豆蛋白的细菌,本研究是在此基础上对该菌进行分子生物学鉴定。就酶制剂应用于传统大豆发酵食品而言,由于纯酶制剂的价格较高,因此限制了其的应用[8]。而粗酶的价格相对低廉更利于其推广应用。因此,在本研究中对该菌蛋白酶粗酶的酶学性质进行了研究,目的是为通过酶法促进大豆发酵食品的成熟奠定基础。
1 材料与方法
1.1 材料与试剂
菌株F1来源于东北农业大学食品学院保藏。菌株的活化培养基为胰蛋白酶消化大豆肉汤(TSB)(Becton,Dickinson and Co.,Sparks,USA)培养基。菌株的产酶培养基为含6%(w/v)脱脂乳粉的胰蛋白酶消化大豆肉汤(TSB)培养基。其他生化试剂均为分析纯。
1.2 仪器与设备
Bia-Rad电泳仪:美国Bia-Rad有限公司;T6型紫外可见分光光度计:北京普析通用仪器有限责任公司;TDL-40B型离心机:上海安亭科学仪器厂;DK-98-11A型电热恒温水浴锅:天津市泰斯特仪器有限公司;ZWY-2102C/1102C型摇床培养箱:上海智城分析仪器制造有限公司;BX51-P型显微镜:奥林巴斯。
1.3 方法
1.3.1 形态结构观察及分子生物学鉴定
形态结构观察参照文献[9]。将经过活化的菌株F1接种于灭菌的TSB液体培养基中,30℃摇瓶发酵12h。试剂盒法提取细菌的总DNA,以总DNA为模板进行PCR反应,扩增细菌的16s rDNA序列,测定该序列并进行同源性分析(http://www.ncbi.nlm.nih.gov/BLAST/)。所用的引物为细菌通用引物[27f(5′-AGAGTTTGATC CTGGCTCAG-3′)和1512r(5′-ACGGCTACCTT GTTACGACT-3′)]。
1.3.2 粗酶液的制备及蛋白酶分子量的测定
将经过活化的菌株F1接种于产酶培养基中进行培养,30℃培养3d。4℃、12000r/min离心10min,除去菌体得粗酶液,4℃保存备用。蛋白酶分子量的测定通过聚丙烯酰胺凝胶电泳的方法[10]。采用不连续系统,5%浓缩胶,12%分离胶,电泳缓冲液为Tris甘氨酸缓冲溶液(pH 8.0),加样液与载样液等量混合,煮沸2min~3min,考马斯亮兰染色。将粗酶液与上样缓冲溶液混合,在进行电泳之前样品不经历任何加热处理。电泳后将凝胶浸没于含有2.5%(v/v)Triton X-100的100mmol/L glycine-NaOH(pH 9.0)缓冲溶液中,缓慢摇动30min以除去SDS。用100mmol/L glycine-NaOH缓冲溶液(pH 9.0)清洗凝胶3次,以除去Triton X-100。在40℃的条件下,将凝胶在含有1%(w/v)酪蛋白的100mmol/L glycine-NaOH缓冲溶液(pH 9.0)中放置40min。最终用考马斯亮蓝R-250对凝胶进行染色。
1.3.3 温度对蛋白酶活性和稳定性的影响
温度对蛋白酶活性的影响,在50mmol/L Tris-HCl的缓冲溶液(pH 7.0)中,分别在20℃、30℃、40℃、50℃、60℃和70℃时测定蛋白酶的活性,在进行试验前将酶样品和含有底物的50mmol/L Tris-HCl缓冲溶液(pH 7.0)培养到预定的温度。对于蛋白酶热稳定性的研究,将酶样品分别在20℃、30℃、40℃、50℃、60℃和70℃的条件下培养1h,然后在标准的条件下测定残留的酶活力,未进行热处理的酶样品作为空白。
1.3.4 pH值对蛋白酶活性和稳定性的影响
在pH 5.0~13.0的范围研究pH值对蛋白酶活性的影响,应用浓度为50mmol/L柠檬酸钠(pH 5.0)、磷酸钾(pH 6.0~8.0)、Tris-HCl(pH 7.0~9.0)、硼酸钠(pH 9.0~10.0)和甘氨酸-氢氧化钠(pH 11.0~13.0)的缓冲溶液。pH值对蛋白酶稳定性的影响,将蛋白酶在上述不同pH值的缓冲溶液中于30℃的条件下培养1h,在标准的条件下测定残留的蛋白水解活力。
1.3.5 NaCl和乙醇对蛋白酶活性和稳定性的影响
在NaCl浓度为0~15%(w/v)和乙醇浓度为0~8%vol的条件下研究NaCl和乙醇对酶活力的影响,在标准的条件下测定酶活力。NaCl和乙醇对蛋白酶稳定性的影响,酶在30℃的条件下于上述不同浓度的乙醇和NaCl溶液中培养1h。在标准的条件下测定残留的酶活力。未经NaCl和乙醇处理的酶样品作为空白。
1.3.6 金属离子对蛋白酶活性的影响
10mmol/L MgCl2、CaCl2、KCl、ZnCl2、FeSO4和MnCl2被用来研究金属离子对蛋白酶活力的影响。在进行试验之前,酶的样品与金属盐在30℃培养60min。在标准的条件下测定残留的酶活性。未经金属盐处理的酶样品作为空白。
1.3.7 蛋白酶活力的测定
蛋白酶活力的测定标准参照参考文献[11],以酪蛋白为底物。
2 结果与分析
2.1 形态结构观察及分子生物学鉴定

图1 菌株F1水解大豆蛋白与菌落及菌体形态图Fig.1 Hydrolyzed soy protein,colony and cell morphology of F1
从我国传统的腐乳中筛选出一株对大豆蛋白有较强水解活性的细菌F1,在大豆蛋白琼脂培养基中产生的水解现象见图1A。菌株F1的菌落和菌体的形态学特征见图1B和图1C。菌株F1在TSB平板上菌落光滑、湿润、橙黄色、边缘整齐。采用革兰氏染色显微镜下观察,细胞为球形、无芽孢、过氧化氢酶阴性、革兰氏阳性。菌株F1的16S rDNA测序结果见图2,在Genebank中进行序列的同源性比对,与模式菌株Staphylococcus carnosusATCC 51365T(AB009934)的16S rDNA序列的同源性为99.7%,因此确定菌株F1为肉葡萄球菌(Staphylococcus carnosus)。肉葡萄球菌是凝固酶阴性球菌的一种常见菌株(Coagulase-negative cocci,CNC),这类细菌广泛的存在于各种发酵食品中[12]。因CNC具有亚硝酸盐和硝酸盐还原酶活性,因此可以抑制脂质氧化和食品的腐败。CNC具有较强的蛋白水解作用,可以将食品中的蛋白质水解为肽和游离氨基酸,而这些小分子物质是许多发酵食品的重要风味物质或是风味物质的前体,同时赋予发酵食品特殊的质构和风味[13]。因此这类细菌作为食品发酵剂而被广泛应用于发酵食品的生产。

图2 菌株F1的16S rDNA序列Fig.2 16S rDNA sequence of strain F1
2.2 粗酶液的制备及蛋白酶分子量的测定
按实验方法中的方法进行粗酶液的制备,以酪蛋白为底物在标准的条件下进行蛋白酶活力的测定,粗酶液的蛋白水解活力为83.87U/mL。SDS-PAGE 显示该蛋白酶的分子量约为45ku。用酪蛋白作底物,在电泳图中出现一条透明的条带,说明该酶具有较强的蛋白酶活性。

图3 蛋白酶分子量的测定Fig.3 Electrophoretic analysis of protease molecular weight
2.3 温度对蛋白酶活性和稳定性的影响
温度对蛋白酶催化活性和稳定性影响结果见图4。实验结果表明,蛋白酶在30℃~50℃时(相对酶活力>50%)表现出较高的催化活性,蛋白酶的最佳催化温度为40℃,此时的酶活力为92U/mL。就酶的稳定性而言,当酶在不同温度经历1h的处理时,蛋白酶在20℃~50℃时表现出较高的酶活力(残留蛋白酶活力>80%),而当温度为70℃时相对残留酶活力仅为2%,因此该酶具有较低的耐热性。多数发酵豆制品的发酵温度为30℃,在本研究中的蛋白酶在30℃~50℃时显示出较高的催化活力和稳定性,因此,该蛋白酶适合于应用通过提高发酵温度或者是酶法生产发酵豆制品而促进发酵豆制品的成熟。此外,该酶具有较低的耐热性,可以通过较高的热处理温度使其失活,从而防止其在应用过程中造成过度成熟。

图4 温度对酶活力和稳定性的影响Fig.4 Effect of temperature on the activity and stability of the protease
2.4 pH值对蛋白酶活性和稳定性的影响
pH值对蛋白酶活力和稳定性的影响见图5。实验结果表明,蛋白酶在pH 7.0~11.0(相对酶活力>50%)表现出较高的催化活力,最佳催化pH值为10.0,此时的蛋白酶活力为133U/mL。就pH值的稳定性而言,当酶在不同pH值条件下经历1h的处理时,在pH 7.0~11.0(残留相对酶活力>58%),实验结果表明,该蛋白酶为碱性蛋白酶,并且在较宽的pH范围内表现出较强的催化活性和稳定性。本研究结果表明,该蛋白酶对pH值表现出的催化活性和稳定性的特点对于许多发酵大豆食品是非常重要的,因为多数发酵大豆食品为碱性发酵食品,如kinema、Natto、Hawaijar、Thua nao、douche和sufu[14-16]。因此,就蛋白酶对pH值表现出的催化活性和稳定性而言,该酶适合于应用在大豆发酵食品中通过酶法或辅助手段进行促熟。
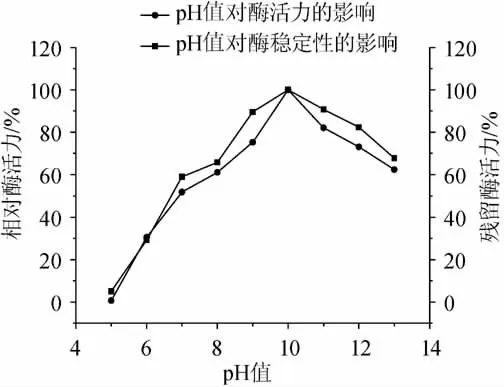
图5 pH值对酶活力和稳定性的影响Fig.5 Effect of pH value on the activity and stability of the protease
2.5 NaCl和乙醇对蛋白酶活力和稳定性的影响
NaCl对蛋白酶稳定性和活力的影响见图6。实验结果表明,当NaCl的浓度为0~1%时,蛋白酶的活力明显增加。当NaCl的浓度大于1%时,随着NaCl浓度的不断增加酶活力明显下降。当NaCl的浓度为9%时,蛋白酶的相对活力为66%,其蛋白酶的催化活力为33U/mL。就酶的稳定性而言,当NaCl的浓度小于9%时,蛋白酶相对残留活力大于48%。乙醇对蛋白酶稳定性和活力的影响见图7,实验结果表明,该蛋白酶对乙醇表现出较高的活力和稳定性,当乙醇的浓度为8%vol时,蛋白酶的相对活力为76%。就酶的稳定性而言,当乙醇的浓度为8%vol时,其蛋白酶相对残留活力仍为70%。研究结果表明,该酶对乙醇具有较强的耐受性。
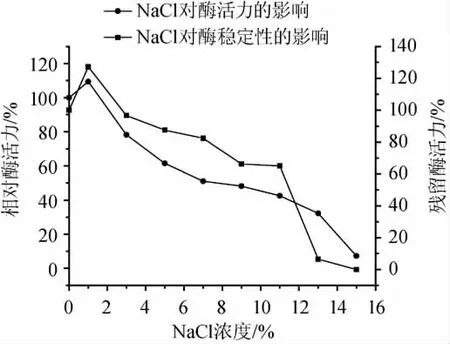
图6 NaCl对酶活力和稳定性的影响Fig.6 Effect of NaCl on the activity and stability of the protease
在发酵食品的成熟过程中,微生物所分泌的蛋白酶水解发酵基质中的蛋白质产生肽和氨基酸,但由微生物产生的蛋白酶可能会被一些盐或者是添加剂所抑制,因此研究酶对具体的添加剂的耐受性是十分必要的[17]。该蛋白酶对NaCl和乙醇表现出较强的耐受性,这是非常重要的特性对于在发酵豆制品中的应用,如sufu、miso、koji和soy sauce等,为了获得较好的风味和抑制一些治病菌的生长和繁殖,这些大豆发酵食品中往往在配料中加入较高浓度的NaCl和乙醇[18]。

图7 乙醇对酶活力和稳定性的影响Fig.7 Effect of ethanol on the activity and stability of the protease
2.6 金属离子对蛋白酶活性的影响
几种金属离子对蛋白酶活性的影响见附表。在实验考查的6种金属离子中Mg2+、Ca2+、K+、Fe2+和Zn2+增强了蛋白酶的催化活性,而Mn2+减弱了蛋白酶的催化活性。许多金属离子可以影响蛋白酶的催化活性,超过75%的酶需要金属离子作为激活剂才能表现出催化活力[19]。本实验的研究结果为该蛋白酶在大豆发酵食品工业中的应用过程中通过金属离子来调节酶的催化活力奠定了基础。

附表 金属离子对蛋白酶活力的影响Attached table Effects of metal ions on the activity of the protease
3 结论
本实验对筛选出的一株对大豆蛋白具有良好水解能力的细菌进行了鉴定并对其粗酶的酶学性质进行了研究。16S rDNA测序结果表明该菌与模式菌株Staphylococcus carnosusATCC 51365T(AB009934)的16S rDNA序列的同源性为99.7%,因此确定菌株F1为肉葡萄球菌。电泳法测得菌株F1产蛋白酶的分子量约为45ku。菌株F1产蛋白酶的最适反应温度和pH值分别为40℃和10.0,在20℃~50℃和pH 7.0~11.0 范围内较稳定。Ca2+、Mg2+、K+、Fe2+和Zn2+对粗酶的催化活性有增强作用。粗酶对较高浓度的NaCl和乙醇表现出较好的稳定性。
[1]DAE YK,JAMES WDIII,HYUN JK,et al.Antidiabetic effects of fermented soybean products on type 2 diabetes[J].Nutr Res,2010,30(1):1-13.
[2]CATHERINE T,AGNIESZKA K,SANDRA H,et al.Glutamate dehydrogenase activity:a major criterion for the selection of flavour-producing lactic acid bacteria strains[J].Antonie Van Leeuwenhoek,2002,82(4):271-278.
[3]ANJANI K,KAILASAPATHY K,PHILLIPS M.Microencapsulation of enzymes for potential application in acceleration of cheese ripening[J].Int Dairy J,2007,17(1):79-86.
[4]BRONCANO JM,TIMON ML,PARRA V,et al.Use of proteases to improve oxidative stability of fermented sausages by increasing low molecular weight compounds with antioxidant activity[J].Food Res Int,2011,44(9):2655-2659.
[5]KILCAWLEY KN,NONGONIERMA AB,HANNON JA,et al.Evaluation of commercial enzyme systems to accelerate Cheddar cheese ripening[J].Int Dairy J,2012,26(9):50-57.
[6]MIRNA MF,MARION E,ANDREA S,et al.Bacterial communities associated with the production of artisanal Istrian cheese[J].Int J Food Microbiol,2010,142(1):19-24.
[7]RANDAZZO CL,PITINO I,RIBBERA A,et al.Pecorino Crotonese cheese:Study of bacterial population and flavour compounds[J].Food Microbiol,2010,27(3):363-374.
[8]赵德安.酶制剂应用于传统大豆发酵食品酿造的探讨[J].中国酿造,2007(4):58-61.
[9]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,19991.
[10]萨姆布鲁克丁,弗里齐EF,曼尼阿蒂斯T,金冬雁译.分子克隆实验指南[M].北京:高等教育出版社,1993.
[11]KEMBHAVI AA,KULKARNI A,PANT A.Salt-tolerant and thermostable alkaline protease fromBacillus subtilisNCIM No.64[J].Appl Biochem Biotech,1993,38(1):83-92.
[12]LING G,KYEUNG HC,JONG-HOON L.Analysis of the cultivable bacterial community in jeotgal,a Korean salted and fermented seafood,and identification of its dominant bacteria[J].Food Microbiol,2011,28(1):101-113.
[13]KALLIOPI R,LUCA C.New developments in the study of the microbiota of naturally fermented sausages as determined by molecular methods:A review.Int J Food Microbiol,2006,108(2):255-267.
[14]NOUT MJR,BAKSHI D,SARKAR PK.Microbiological safety of kinema,a fermented soya bean food[J].Food Control,1998,9(6):357-362.
[15]JEYARAM K,MOHENDRO SINGH W,PREMARANI T,et al.Molecular identification of dominant microflora associated with‘Hawaijar’-A traditional fermented soybean(Glycine max(L.))food of Manipur,India[J].Int J Food Microbiol,2008,122(3):259-268.
[16]KATEKAN D,ARUNEE A,EKACHAI C,et al.Free-amino acid profiles ofthua nao,a Thai fermented soybean [J].Food Chem,2011,125(2):342-347.
[17]RUIZ-RAMIREZ J,ARNAU J,SERRA X,et al.Effect of pH,NaCl content and proteolysis index on the relationship between water content and texture parameters inbiceps femorisandsemimembranosusmuscles in dry-cured ham[J].Meat Sci,2006,72(2):185-194.
[18]BREWER MS.Encyclopedia of food microbiology[M].Urbana:Academic Press,2000.
[19]TUNGA R,BANERJEE R,BHATTACHARYA BC.Some studies on optimization of extraction process for protease production in SSF[J].Bioprocess Eng,1999,20(6):485-489.
