超氧化物歧化酶在膝骨关节炎患者血清中的变化及相关因素分析
2012-04-13程园园刘健冯云霞刘磊万磊
程园园,刘健,冯云霞,刘磊,万磊
(1.安徽中医学院,合肥230038;2安徽中医学院第一附属医院;3.湖北中医药大学)
骨关节炎(OA),又称骨关节病、退行性关节病和增生性关节炎等,是一种常见的慢性、进展性关节疾病。其主要病理改变为关节软骨变性、破坏、软骨下骨硬化,关节边缘和软骨下骨反应增生、骨赘形成等。但对导致OA发生的确切病因尚缺乏真正了解,一般认为OA与衰老、创伤、肥胖、代谢障碍和遗传、免疫等因素有关。有研究表明[1],自由基与细胞因子相互作用,参与了OA的病理过程,与OA的发生发展有密切关系。本研究通过分析血清超氧化物歧化酶(SOD)在膝骨关节炎KOA患者中的变化及相关影响因素,为SOD作为膝骨关节炎病情活动性指标及探索新的治疗思路提供临床依据。现将62例KOA患者超氧化物歧化酶(SOD)变化及其相关性分析报告如下。
1 资料与方法
1.1 临床资料 所选62例膝骨关节炎患者均来自2011年10月至2012年3月安徽中医学院第一附属医院风湿免疫科住院患者,女47例,男15例;年龄32~80岁,平均(61.4 ±13.7)岁;病程 3个月 ~30年,平均(9.4±5.4)年。所选病例均符合2003年中华医学会风湿病学分会起草的《骨关节炎诊疗指南(草案)》诊断标准[2]。
1.2 排除标准 ①不符合上述KOA疾病诊断标准的患者;②合并心血管、呼吸系统、肝、肾和造血系统等严重原发性疾病及其他风湿免疫类疾病;③年龄在18岁以下,70岁以上的患者;④孕妇或哺乳期女性的患者;⑤精神病患者;⑥未按规定用药,无法判断疗效或资料不全等影响疗效或安全性判断者。⑦研究者判断不宜进行此项临床试验的受试者。
1.3 研究方法
1.3.1 实验室指标 SOD、免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、补体C3、C4:采用日立7060型全自动生化分析仪进行测定。ESR(魏氏法);hs-CRP(日立HITACHI7060全自带生化分析仪检测)。白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)(日本 SysmexXT-2000i全自动血细胞分析仪检测)。
1.3.2 膝骨关节炎严重程度指数(Lequesne MG)[3]根据Lequesne MG评分原则将62例KOA患者分轻中重3组(轻度组11例、中度组36例、重度组15例),并以年龄为界限把62例KOA患者分为<50岁组(16例)、51~65岁组(17例)、>66岁组(29例),以5年为界限把62例KOA患者分为<5年组(27例)、≥5年组(35例)。
1.3.3 中医证侯分级量化表[4]包括10个条目,每条根据症状轻重程度分为无、轻、中、重四级,分别记作0、3、6、9 分。
1.4 统计学处理 采用SPSS17.0软件包对数据进行统计学处理,计量资料采用±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,正态性检验不符合条件资料采用秩和检验,指标间相关性采用Spearman分析。
2 结果
2.1 KOA患者SOD值 与血清SOD正常参考值(129~216 u/ml)比较,KOA组SOD水平低于正常值占36例(58%)。KOA患者中,按LequesneMG分级,轻度组与中度组、轻度组与重度组、中度组与重度组比较显示重度组血清 SOD水平[(118.27±22.55)u/ml]显著低于轻度组[(146.27 ±24.14)u/ml]及中度组[(125.28 ± 21.30)u/ml],(P<0.05),中度组血清SOD水平显著低于轻度组(P<0.05)。
2.2 按照临床因素分组比较各组SOD的变化 与病程<5 年组[(135.93 ±29.43)u/ml]比较,病程≥5 年组[(121.29 ±16.49)u/ml]血清 SOD 水平显著降低(P<0.05)。而年龄、性别因素对KOA患者血清SOD水平影响不大(均P>0.05)。
2.3 KOA患者血清SOD水平与年龄、中医症候积分、LequesneMG、病程、ESR、CRP、IGM、C3、C4 相关性分析 相关性分析示SOD与LequesneMG、中医症候积分、病程、ESR、CRP、IGM 呈负相关,与 C3、C4呈正相关(P<0.05)。与其他实验室指标无相关性,见表1。
3 讨论
本研究结果显示,62例KOA患者血清SOD水平低于正常参考值者36例(58%),且表现出随着膝关节严重程度指数由轻到中重度变化及病程的延长,SOD值呈下降趋势,而性别对血清SOD水平影响不大。随着患者年龄的增长,其SOD值有下降的趋势,但在各年龄组之间比较,差异无统计学意义(P<0.05)。说明年龄并非是影响SOD降低的主要原因。相关性分析还显示SOD水平与关节严重程度指数、中医症候积分、病程、红细胞沉降率、超敏C反应蛋白、IGM、C3、C4呈负相关。而与年龄、WBC、RBC、HGB、PLT、IGG、IGA 无相关性。说明骨关节炎患者出现SOD降低可能跟疾病病程增加,炎症的进一步刺激,关节病变程度加重,以及由此导致的补体调节紊乱、氧化应激效应相关。同时,SOD的降低亦可加重骨关节炎的进一步发展。
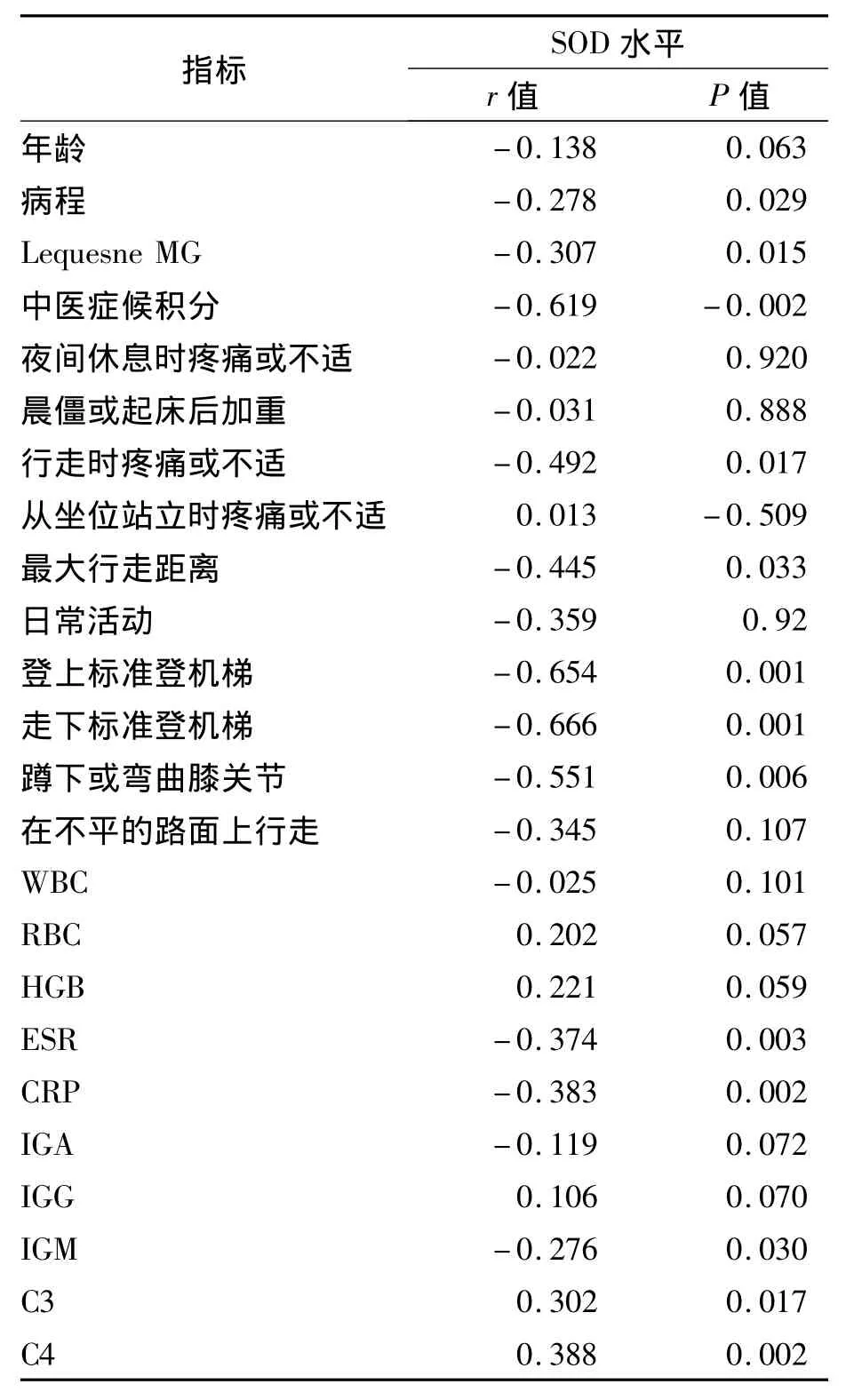
表1 KOA患者血清SOD水平与其他指标相关性分析(n=62)
现代医学认为KOA是由多种因素引起的,以关节软骨细胞、基质和软骨下骨合成和分解代谢异常为病理表现的风湿性疾病,其症状的产生与关节的高压及骨高压,静脉瘀滞关系密切,软骨损伤是KOA的病变基础。尽管KOA的病因十分复杂,发病机制未明,但是自由基对关节软骨的损伤作用已开始为人们所认识。病理情况下,过量自由基抑制软骨细胞增殖引起软骨细胞死亡,抑制软骨基质蛋白多糖和胶原的合成,加速软骨基质的降解,从而降低软骨的弹性和强度[5]。自由基还可抑制软骨细胞DNA的合成,破坏蛋白多糖和胶原分解合成代谢,从而降低软骨细胞的合成能力,引起软骨细胞损伤[6],加速软骨代谢,进而导致骨关节炎此类退行性疾病的发生,从而引起机体组织功能的丧失,出现病理状态如关节活动受限和疼痛的产生。自由基代谢中与KOA关系最密切的是活性氧(ROS)的代谢。已证明在OA关节液中氧自由基含量升高[7]。
已经有研究证实,OA的发病过程中存在着自由基清除剂SOD的损伤。本研究发现KOA患者血清SOD水平有一半以上者低于正常参考值,并随着关节严重程度指数由轻到中重度变化及病程的延长,呈下降趋势。这种结果提示SOD可以反应膝骨关节炎的严重程度。目前,KOA尚缺乏明确实验室指标反应病情活动度及严重程度,如确能证实SOD水平与KOA患者病情进展程度的关系,其意义不仅在于SOD可用于评估KOA病情严重程度,还在于为治疗KOA提供新的治疗思路及疗效评价指标。
一般认为SOD是反映衰老的一个重要指标,与年龄呈明显相关。最近随着KOA发病机制的深入研究发现,炎性反应在KOA的发病中起着重要作用。而高水平的氧自由基主要来源于免疫和炎症过程中,如中性粒细胞、巨噬细胞、炎性滑膜等均可产生过量氧自由基[8],从而加速KOA的发生发展。故而,疾病本身对SOD水平的影响占有主导作用,而年龄因素的影响则相对较小,结合年龄与SOD相关性分析,提示年龄因素亦对SOD水平变化起着作用,只是这种作用在疾病过程中则不如在正常人中那么明显,因此3个年龄组无明显差异。相关性分析还显示SOD水平与关节严重程度指数、病程、中医症候积分、红细胞沉降率、超敏C-反应蛋白、IGM、C3、C4 呈负相关。而与 WBC、RBC、HGB、PLT、IGG、IGA无相关性。红细胞沉降率、超敏C-反应蛋白、IGM、C3、C4在多数疾病中都可用来作为疾病活动性指标,指标越高,疾病活动度越强。现代研究已证实在KOA的发病过程中存在细胞因子、免疫学机制的参与。KOA病理过程中,大量中性粒细胞、巨噬细胞被活化,聚集于关节、滑膜、滑液中,可释放大量自由基,当其表面受到免疫复合物、补体成分等攻击,可加剧这个反应。由此,SOD水平的降低程度可以从侧面反映KOA的炎症严重程度。这亦说明了SOD可以作为评价KOA病情活动度的重要指标之一[9-10]。
综上可见,KOA患者存在SOD水平的下降,并与患者的病程、LequesneMG积分、中医症状积分、ESR、CRP、IGM、C3、C4 有相关性,说明 SOD 的表达失调参与了KOA的发病过程,其机制可能与炎症、氧化应激、免疫失调等相关,提示SOD可以作为评价KOA病情活动度的重要指标之一,反应疾病发生发展情况,故而应早期治疗KOA患者,并在治疗时注意提高患者的SOD的水平,从而延缓或抑制病情发展。
[1] Clancy RM,Amin AR,Abramson SB.The role of nitric oxide in inflammation and immunity[J].Arthritis Rheum,1998,41(7):1141-1151.
[2] 中华医学会风湿病学分会.骨关节炎诊治指南[J].中华风湿病学杂志,2003,7(11):702.
[3] Lequesne MG,Samsons S.Indices of severity in osteoarthritis of weight bearing joints[J].J Rheum,1991,18(suppl 27):16-18.
[4] 郑筱萸.中药新药临床研究指导原则[M].北京:中国医药科技出版社,2002:123.
[5] 陈瑞莲.超氧化物歧化酶在骨关节炎中的研究意义探讨[J].中医药临床杂志,2011,23(6):475-477.
[6] 康一凡,逄育.氧自由基与膝骨关节炎关系的实验及临床研究[J].第二军医大学学报,2001,22(10):945-948.
[7] Drewar CL,Harth M.Superoxide production from cytokine-treated adherent rheumatoid neutrophils[J].Clin Invest Med,1994,17(1):52-60.
[8] Taraza C,Mohora M,Vargolici B,et al.Importance of reactive oxygen species in rheumatoid arthritis[J].Rom J Intern Med,1997,35(1-4):89-98.
[9] 王桂珍,张金山.膝骨关节炎患者超氧化物歧化酶变化及相关性分析[J].中医药临床杂志,2011,23(6):530-531.
[10]吴蠡荪.自由基与临床医学(下)[J].微循环学杂志,1998,8(4):24-26.
