重组人血清白蛋白/粒细胞刺激因子融合蛋白的药效学、药理学和毒理学研究
2012-04-13富岩尹丽莉顾静良马宪梅左从林于在林
富岩,尹丽莉,顾静良,马宪梅,左从林,于在林
·论著·
重组人血清白蛋白/粒细胞刺激因子融合蛋白的药效学、药理学和毒理学研究
富岩*,尹丽莉*,顾静良,马宪梅,左从林,于在林
目的对重组人血清白蛋白/粒细胞刺激因子融合蛋白(rHSA/GCSF)开展药效学、药理学和毒理学动物评价研究,以确认其安全性和有效性。
血清白蛋白; 粒细胞集落刺激因子; 药理学; 毒理学; 融合蛋白
www.cmbp.net.cn 中国医药生物技术, 2012, 7(4):241-256
重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor,rhG-CSF)的应用已成为肿瘤治疗的重要支持手段之一。rhG-CSF 可以减少化疗后中性粒细胞减少性发热的发生率,从而降低医疗费用,改善患者的生活质量。同时 rhG-CSF 的应用不仅可以保证常规化疗如期足量进行,而且使患者能耐受提高剂量强度的化疗或剂量密集性化疗,还用于高剂量化疗联合自体造血干细胞移植的干细胞动员与移植后造血重建,从而保证甚至提高化疗的疗效[1-2]。作为一种蛋白质类药物,rhG-CSF 的半衰期短,需要每日注射1 ~ 2 次,给治疗带来了不便。人血清白蛋白(HSA)结构稳定,它在血管和血管外循环中分布较广,半衰期较长,是血液中重要的运输载体,因此也成为改善药物半衰期的载体蛋白。重组人血清白蛋白/粒细胞刺激因子融合蛋白(rHSA/GCSF)是将 hGCSF基因的 N 端直接融合到人血清白蛋白基因的 C 端而形成的融合蛋白,与 rhG-CSF 相比有更长的血液半衰期,在临床使用中可以降低给药频率,减少患者痛苦,提高治疗的顺应性。
Halpern 等[3]报道了由酵母菌 S. ceravenia 表达制备的重组人血清白蛋白/粒细胞刺激因子融合蛋白(AlbugraninTM)在小鼠和猕猴中的药代动力学初步研究结果并给予了成药性的提示。同时,富岩等[4]开展了由酵母菌 P. pastoris 表达制备的重组人血清白蛋白/粒细胞刺激因子融合蛋白新药的详尽和全面的药学研究。本试验目的是考察rHSA/GCSF 融合蛋白在保持 GCSF 生物学作用的同时,是否延长了 GCSF 的生物半衰期,是否可用于肿瘤患者化疗或放疗后的中性粒细胞减少症的治疗。为认识该新药的药理毒理学特点,结合国家有关新药的法规及该融合蛋白的特点进一步开展了系统的临床前药效学、药理学、毒理学以及药代/毒代的完整安全性动物评价研究。
1 材料与方法
1.1 材料
1.1.1实验动物 昆明小鼠(SPF 级)460 只、Beagle 狗 12 只(普通级)、Wistar 大鼠(SPF 级)183 只、食蟹猴(普通级)77 只、恒河猴 1 只分别购自于中国药品生物制品检定所实验动物中心、福州振和实验动物技术开发有限公司、中国医学科学院实验动物研究所、广西新丰源生物科技有限公司以及军事医学科学院实验动物中心(北京)。本实验涉及的所有动物处理内容均遵从实验动物实验管理和动物福利相关条例和法规,并由北京昭衍新药研究中心有限公司的动物伦理委员会(IACUU)批准和监督执行。研究者已努力做到最大可能地减少实验动物的使用数量。
1.1.2供试品、试剂及检测试剂盒 注射用重组人血清白蛋白/粒细胞刺激因子融合蛋白冻干粉针剂由天津溥瀛生物技术有限公司生产,批号为 9314/20080502,规格为 1.5 mg/ml/支;批号为9314/20080503,规格为 1 mg/ml/支;阳性对照药重组人粒细胞集落刺激因子注射液(惠尔血)由日本麒麟啤酒株式会社原液制造,麒麟鲲鹏(中国)生物药业有限公司制剂生产,批号为 20080651,规格为 300 μg/1.2 ml/支。化疗药物氟尿嘧啶注射液(5-Fu)由天津金耀氨基酸有限公司生产,批号为0803112,标示量为 0.25 g/10 ml/支。其他试剂为药用级、分析级纯度;主要检测试剂盒 Human G-CSF Instant ELISA 由丹麦 Bender MedSystems GmbH公司制造。
1.1.3仪器 美国 Biopac 公司的 MP150 多导生理记录仪;美国 Bayer 公司的 Bayer Advia 2120全自动血球分析仪;日本东芝公司的 TBA-120FR型全自动生化分析仪;美国 Medica 公司的Easylyte 型全自动电解质分析仪;高效液相色谱仪SHIMADZU 10AT 为日本岛津公司产品;TSK G3000 SWxl 300A,10 μ,7.8 × 300 mm 的凝胶柱购自日本 TOSOH 公司;酶标仪为美国 Bio-Rad公司或 Thermo Multiskan MK3 酶标仪。
1.2 方法
1.2.1药效学研究
1.2.1.1体外药效学实验 取体重 5 ~ 6 kg 恒河猴,经戊巴比妥钠静脉麻醉,用 16 号骨髓穿刺针在髂后上脊处取骨髓细胞液 5 ml,注入含 EDTA的抗凝真空管中,混匀后 1800 × g 离心 10 min;弃上清,用 5 ml IMDM 重新溶解悬浮细胞,加入5 ml 淋巴细胞分层液,再次离心 20 min,取中层有核细胞用 PBS 溶液洗涤 2 遍,用 6 ml IMDM重新悬浮,稀释至(3 ~ 4)× 106个/ml 待用。实验组加入 125 μl 不同浓度的 rHSA/GCSF(2.4、12、60、300、1500 μg/ml);阳性组加入 12 μl 阳性对照药(10 μg/ml);阴性对照组加入 12 μl PBS,各组配制 3 ml 的培养体积,混匀,在 24 孔板中加入 0.5 ml 体系培养,每组重复 4 孔。放入 37 ℃,饱和湿度 5% CO2培养箱中培养。8 ~ 10 d 后于倒置显微镜下计数集落,多于 50 个细胞判读为一个集落。
1.2.1.2小鼠放疗和化疗实验 140 只小鼠,随机分为 7 组,每组 20 只,分别为正常对照组,模型对照组,rHSA/GCSF 4 个剂量组(500、150、50 和 15 μg/ml)和阳性对照组(惠尔血 5 μg/ml);阴性对照为 0.9% 氯化钠注射液,给药途径为皮下注射,给药容量为 0.1 ml/10g。除正常对照组外,其余各组动物按 150 mg/kg 给予 5-Fu,给药途径为静脉注射,给药容量为 0.1 ml/10g。给予化疗药24 h 后分别于第 1(给予 5-Fu 后的 24 h)、5、9 天给予受试药,第 1 ~ 12 天每天给予阳性对照药。
放疗实验则是在除正常对照组外,其余各组动物于第 1 天接受 5.0 Gy(剂量率约为 1.4 Gy/min)60Coγ 照射,并于当天给予受试药及阳性对照药,第 5、9、13、17 天给予受试药 rHSA/GCSF;第1 ~ 20 天每天给予阳性对照药。
两个实验给药后每日观察动物的一般生理指标,包括动物的精神状态、行为活动、进食、饮水、发病、死亡等症状。记录异常症状出现的时间、发展和缓解情况。放疗于照射前及第 3 天、第 5 天、第 7 ~ 20 天检测动物的血液学指标,包括白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)。每次每组取血 10 只动物,间隔进行。化疗则是在给药前及给药后第 3、5、7、8、9、10、11、12、13 天检测动物的血液学指标,包括白细胞计数、红细胞计数、血小板计数。每次每组取血动物 10 只,间隔进行。化疗第 13 天,放疗第21 天对全部动物实施安乐死,取脾脏并称重,计算脾脏相对于体重的相对重量,即脏器系数(脾重量/体重 × 100%),比较给药组与模型对照组的差异。同时取动物股骨骨髓,用中性福尔马林固定,脱钙后制石蜡切片,HE 染色,观察骨髓造血情况。
血细胞计数、脾脏器重量/脏器系数用均数 ±标准差(x±s)表示,用 t 检验比较给药组和同期模型对照组的差异,判定给药的治疗效果。
1.2.1.3食蟹猴药效学研究 30 只食蟹猴,随机分为 6 组,每组 5 只,分别为正常对照组,模型对照组,阳性对照组和3 个剂量的供试品组。供试品给药浓度为 600、200、60 μg/ml;阳性对照品浓度为 40 μg/ml;阴性对照品为 0.9% 氯化钠注射液。除正常对照组外,其余各组动物于第 1 天接受 3.0 Gy(剂量率约为 1.4 Gy/min)60Coγ 照射,照射前 1 日给予每只动物庆大霉素 8 万单位,预防胃肠道症状,并于照射当天(照射后 5 h内)给予 rHSA/GCSF 或阳性对照品。第 1、5、9、13、17、21 天给予供试品;第 1 ~ 24 天每天给予阳性对照品。给药途径为皮下注射,给药容量为 0.25 ml/kg。临床观察指标有一般生理指标、体重、外周血细胞计数。骨髓细胞培养(体外药效学研究)、骨髓细胞涂片观察、病理组织学检查等。
1.2.2安全药理
1.2.2.1小鼠安全药理研究 单次皮下给药rHSA/ GCSF 的安全药理试验考察是在 SPF 级昆明小鼠中开展的。实际使用 80 只小鼠,雌雄各半(由于交叉设计,得到 120 只小鼠的数据)。用 1 ml 一次性无菌无热原注射器准确抽取药物后,于动物颈背部皮下给药。3 个 rHSA/GCSF 剂量组分别为 500、1500 和 3000 μg/kg。将动物按上述分组为供试品组和生理盐水阴性对照组,每组 10 只(雌雄各半)。直接观察给药后动物一般行为表现、姿势、步态、流涎、肌颤及瞳孔变化。考察对正常小鼠自主活动的影响:上述动物于给药后第 6 小时和第 24 小时分别测试 10 min 内各组小鼠自主活动数,比较组间结果。对戊巴比妥钠阈下剂量催眠作用的影响则是将动物按上述分组给药,于给药后 6 h,分别腹腔注射 0.3% 戊巴比妥钠(30 mg/kg),观察 30 min 内睡眠情况,如有动物出现翻正反射消失,需记录出现的动物数及出现睡眠时间、睡眠消失时间。对正常小鼠攀网能力的影响考察是把金属网呈 45° 置于实验台上,将动物按上述分组用药后 370 min、24 h的时间点时,将实验小鼠每次每组 1 只放于网上任其攀爬,观察 10 min 内各组落下的小鼠只数。
1.2.2.2对狗心血管和神经系统的安全药理研究 取 12 只 Beagle 狗,按性别分为两个区段后随机分为实验组和对照组 2 组,每组 6 只动物,雌雄各半,体重雌性为 6.51 ~ 8.26 kg,雄性为6.54 ~ 8.62 kg。对照组动物试验结束后,间隔 7 d消除期,用于低剂量组试验。将动物用 35 mg/kg 的戊巴比妥钠静脉注射麻醉后固定。气管及股动脉插管,连接呼吸传感器、血压传感器及心电极。待角膜反射消失、四肢及腹部肌肉松弛、呼吸平稳认为麻醉适度。记录动物各项指标药前值后,用一次性无菌无热原注射器准确抽取药物后,于动物后肢内侧皮下多点注射给药,每点注射量约 2 ml。rHSA/ GCSF 给药剂量分别为 0、50、200 μg/kg。观察记录对照组及给药组给药即刻、15、30、60、90、120、150 min 血压、心电、心率、心律的变化及呼吸频率和潮气量等各项指标的变化。
1.2.3安全性评价
1.2.3.1急性毒性实验
⑴小鼠急性毒性实验 采用区段随机分组法,将小鼠先按性别分成雌雄两个区段,然后根据每个区段的动物数、临时编号和标记,用 Excel 软件给出随机号,使随机号与动物号对应。然后将随机号从小到大进行排序,按照随机号的大小将动物分组。给药体积为 0.25 ml/10g。采用一次性无菌注射器准确抽取所需药液,皮下注射给药组注射部位为动物的颈背部皮肤。静脉注射给药组采用尾静脉注射,注射速度约为 0.5 ml/10 秒;对照组尾静脉注射相应量的生理盐水。将动物分组后,按静脉注射对照组,皮下注射给药组,静脉注射给药组的顺序给药。给药后连续观察 4 h,以后每天上下午各观察记录 1 次,共观察14 d。给药后开展一般生理指标观察、体重、食量考察。实验结束后,腹腔注射戊巴比妥钠 50 mg/kg 麻醉动物,待动物进入无意识状态后,通过股动脉放血法,将动物安乐死后均进行大体解剖,大体解剖观察到有异常的器官则要做组织病理学检查。试验结束后对不同组别动物的体重和食量进行统计学分析。体重、食量数据以均数 ± 标准差(x±s)表示,组间进行成组 t 检验。单次给药的毒性试验结果以 MTD 表示,如未见动物死亡,则 MTD 大于等于该给药剂量。
⑵食蟹猴急性毒性实验 取食蟹猴 3 只,1 雌(2.16 kg)2 雄(2.11 和 2.33 kg),给药剂量分别为 2.3、5.2 和 11.6 mg/kg。给药途经为皮下注射(双后肢皮下注射给药)。多点注射,每点注射量不超过 3 ml。检测指标主要有临床观察、体温、体重、食量、心电图、经全自动血球分析仪开展各种血细胞计数、凝血功能指标、血生化检查、尿常规检查、骨髓切片检查、病理检查;组织病理检查则是在动物安乐死后观察所有动物组织,如果有异常则纪录并进行组织病理学检查。将动物给药前后的体重、体温、心电图、血液学、血液生化等指标直接进行比较,综合评价。
1.2.3.2长期毒性实验
⑴大鼠长期毒性实验 将 160 只 Wistar 大鼠(SPF级)按 1.2.3.1⑴ 中的分组方法将动物分为 4 组。给药途经为颈背部皮下,3 个供试剂量分别为 5000、1200 和 300 μg/kg,空白对照组给药生理盐水。给药的频率及周期为每 4 天给药1 次,连续给药 13 周,共给药 23 次。试验观察主要有一般临床观察、注射部位观察和每周 1 次的详细体检;体重、体温、食量观察,血液学指标主要有血细胞计数、凝血功能、血液生化指标检查;尿常规、眼科检查、抗体检查和中和抗体测定;脏器重量和脏器系数组织学和器官检查则在给药4 周、末次给药后 2 d 及停药 4 周后,分别安乐死部分试验动物检查肝脏、脾脏、肺脏、给药局部和胸骨骨髓、股骨骨髓、跖骨和踝关节。给药 4 周即第 8 次给药后 2 d,每组安乐死动物数雌雄各5 只;末次药后 2 天,每组安乐死的动物数雌雄各 10 只。停药后剩余动物继续观察 4 周(恢复期),以便了解毒性反应的恢复情况和可能出现的延迟性毒性,恢复期结束后将动物实施安乐死。
试验结果的统计分析主要有:计算各组动物的体重、体重增长量(率)、体温、血液学、凝血功能指标、血液生化指标、器官重量和脏器系数等指标的组平均数和标准差。这些数据用 Levene’s 检验方差齐性。如果没有统计学意义(P > 0.05),用单因素方差分析(ANOVA)进行统计分析,如果ANOVA 有统计学意义(P ≤ 0.05),用 Dunnett’s test 进行比较分析;如果方差不齐(P ≤ 0.05),则用 Kruskal-Wallis 检验。如果 Kruskal-Wallis 检验有统计学意义(P ≤ 0.05),则用 Mann-Whitney 法进行均数间的两两比较。分析数据的生物学意义时,如有必要分析给药前后的指标变化,统计方法采用配对 t 检验。
⑵食蟹猴长期毒性实验 试验动物分组方法与大鼠长毒试验分组方法相同。实验动物 24 只,分为 4 组:阴性对照组、供试品低剂量组(30 μg/kg)、中剂量组(150 μg/kg)和高剂量组(750 μg/kg),每组 6 只,雌雄各半。注射部位为双后肢内侧皮肤,进行多点皮下注射,每点注射量不超过 2 ml,给药容量 0.5 ml/kg,给药频率及周期为每周给药1 次,共给药 9 次。临床考察指标和所有内容与大鼠长毒试验中考察内容和指标相同。为检测受试动物体内是否产生抗 rHSA/GCSF 的抗体,则是以rHSA/GCSF 蛋白质包被自制 ELISA 96 孔板,计算对照组动物或阴性对照组最低稀释度血清 OD值的平均值和标准差,计算x± 2s 值,当样品 OD值为 0.1 以上,且样品 OD 值 > ODx± 2s时判断为抗体阳性。通常对照组动物或阴性对照组血清稀释度为 1∶100 时的 OD 值在 0.2 以内时,认为系统可靠。决定检测到的受试动物体内产生的抗体是否是中和抗体,则是将血清样品经适当稀释后,直接开展 NFS-60 细胞 MTT 比色法测定生物学活性。
1.2.4药代/毒代评价
1.2.4.1非临床药代动力学试验125I-rHSA/GCSF在昆明小鼠和 Wistar 大鼠中的分布及代谢动力学研究是将125I 标记后的125I-rHSA/GCSF 及未标记的rHSA/GCSF混合,用注射用水配制至 300 μg/m(l大鼠用,共约 6 ml)和60 μg/m(l小鼠用,共约 6 ml)。将标记后的125I-rHSA/GCSF 进行生物活性测定。
试验开始前进行了方法学确认试验。取 6 只小鼠,3% 戊巴比妥钠麻醉后,取脑、肌肉、生殖腺、淋巴结、小肠、脾、肾、肝、肺、心、甲状腺、血清、尿等 13 种器官/组织或体液,加入缓冲液,制成匀浆,加入 5 个不同梯度放射性的125I-rHSA/ GCSF[分别为 102、103、104、105、106cpm(count per minute);等同于(eqv)1200、120、12、1.2、0.12 ng],样本混匀后,测定总放射性,而后加入等体积 20% TCA 沉淀蛋白(使其终浓度为 10%),离心后去除上清,测定沉淀部分放射性。并对方法的特异性、灵敏度及可靠定量下限、线性、精密度和回收率等进行考察。
组织分布测定:取 24 只小鼠,皮下注射125I-rHSA/GCSF,每只0.2 ml(12 μg/只),分别于注射后 4、24、72 和 168 h 麻醉动物,股静脉放血安乐死 6 只(雌雄各半),取甲状腺、心脏、肺脏、肝、脾、肾上腺、肾、膀胱、生殖腺、注射局部淋巴结、肠淋巴结、肠内容物、肠内粪、小肠、脂肪、肌肉、骨髓(股骨)、脑、眼球、胰腺、胸腺、颌下腺、血清、尿等组织或体液。体液用精密移液器计量,组织用感量 0.1 mg 的电子天平称湿重,制成匀浆,测定总放射性,而后加入等量 20% TCA 沉淀蛋白,离心后去除上清,测定沉淀部分放射性。以 µg 当量/g 组织新鲜湿重或体积(ml)表示放射性浓度。
血药浓度测定:取 12 只 Wistar 大鼠,分为皮下注射组和静脉注射组,按各自给药途径给予125I-rHSA/GCSF 0.2 ml/只(60 μg /只)。皮下组于注射后 1、3、8、10、24、48、72、96、120、168 h 眶静脉取血,每个时间点 6 只大鼠;静脉组于给药后 2 min、15 min、1、4、8、24、48、72、96、168 h 眶静脉取血,每个时间点 6 只大鼠。离心分离血清,测定总放射性,加入等体积的 20% TCA沉淀蛋白,离心后去除上清,测定沉淀部分放射性,并计算血药浓度。
粪尿排泄:取 5 只 Wistar 大鼠,每只皮下注射 0.2 ml(60 μg)的125I-rHSA/GCSF 药液,单独饲养在代谢笼内。于注射后第 1、2、3、4、5、6、7、8、9 d 分别收集尿和粪,测定放射性,计算排出放射性占注入放射性量的百分比。
胆汁排泄:取 6 只 Wistar 大鼠,用 3% 戊巴比妥钠麻醉,切开腹腔,分离胆总管,远端结扎,近端插入引流管引流胆汁,待大鼠清醒后皮下注射125I-rHSA/GCSF,每只0.2 ml(6 μg),每小时收集1 次胆汁,收集 8 h。测定放射性,计算排出放射性占注入放射性量的百分比。
血浆蛋白结合率:取正常大鼠血浆,每管200 μl,分别加入125I-rHSA/GCSF,使血浆药物浓度分别为 30、300 和 3000 ng/ml。37 ℃ 水浴 30 min后,用分子排阻 HPLC 法检测125I-rHSA/GCSF 与血浆蛋白结合情况,并计算血浆蛋白结合率。
部分血清、胆汁、尿液样品的 SEC-HPLC 分析:考察样品中125I-rHSA/GCSF 原型及代谢物的存在、生成情况。SEC-HPLC 色谱方法条件为:岛津高压泵,TSK G3000 SWxl 凝胶柱,300A,10 μ,7.8 × 300 mm。洗脱液:0.02 mol/L 磷酸盐缓冲液,内含 0.4 mol/L NaCl,pH 7.0,流速 1 ml/min。自动部分收集器收集洗脱液体,测定每管放射性,origin 软件作图。
参数计算及统计分析:使用 WinNolin Version5.2 按照非房室模型法(NCA)计算动力学参数,采用均值 ± 标准差(x±s),以及变异系数(CV%)进行统计描述。
1.2.4.2食蟹猴药代/毒代评价 药代评价采用s.c. 给药 5、15、50 μg/kg 的 3 个剂量组,低剂量组兼作反复给药组,i.v. 给药组(15 μg/kg)和对照组 15 μg/kg(rhG-CSF),每组 4 只食蟹猴。毒代则结合食蟹猴长毒试验 3 个剂量组[见1.2.3.2 (2)],并于首次和第 8 次给药前和给药后的 4、8、10、24、48、72、96、120、168 h 分别取血开展毒代动力学研究。取血部位均为后肢皮下静脉,每次采血量约 1.0 ml。所获血清样品还开展结合抗体、中和抗体检测。
2 结果
2.1 药效学研究
2.1.1体外药效学研究 以猴骨髓细胞为研究系统,在体外条件下培养骨髓粒细胞-巨噬细胞集落,计数不同浓度的供试品对 CFU-GM 数的影响。培养 8 d,各组体系内均有不同数量的 CFU-GM 集落生成,rHSA/GCSF 浓度在 100 ng/ml ~ 62.5 μg/ml范围内,促进 CFU-GM 生成作用,并且在一定剂量下有剂量反应关系。在 2.5 μg/ml 以上剂量时量效关系不明显。阴性对照组集落数较少。试验结果见表 1。
2.1.2小鼠白细胞低下的疗效 在小鼠化疗模型中,检定了氟尿嘧啶注射液(5-Fu)所致的小鼠白细胞减少症的治疗作用。与模型对照组比较,各给药组均显示了升高白细胞作用,主要是升高中性粒细胞。对外周血红细胞和血小板未见明显的影响。骨髓组织学检查可见骨髓粒系造血细胞及成熟中性粒细胞增多(图 1)。由此可见,rHSA/GCSF 具有治疗氟尿嘧啶所致的小鼠白细胞减少症的作用,可见一定的剂量-效应关系,并且具有长效作用,其单次注射与市售的普通 rhG-CSF 多次注射的作用有可比性。
60Coγ 射线照射放疗所致的小鼠白细胞减少症模型的结果显示,与模型对照组比较,各给药组均显示了升高白细胞作用,主要是升高中性粒细胞。对外周血红细胞、血小板未见明显影响。给药动物脾增大,骨髓组织学检查可见骨髓粒系造血细胞及成熟中性粒细胞增多(图 2)。由此可见,rHSA/ GCSF 具有治疗60Coγ 照射所致的小鼠白细胞减少症的作用,可见一定的剂量-效应关系,并且具有长效作用,其单次注射与市售的普通 rhG-CSF 多次注射的作用有可比性。
2.1.3食蟹猴白细胞低下的疗效 结果显示,各给药组及阳性对照组具有明显的升高白细胞作用(图 3),特别是升高中性粒细胞。同时对红细胞、血小板未见明显影响。骨髓粒系集落培养结果显示,给药组粒系集落明显增多,骨髓粒系增生活跃,照射后 42 d,骨髓细胞学检查结果显示中高剂量给药组部分动物出现粒系增生明显活跃,其他给药组动物、阳性对照组及模型组动物骨髓细胞学比例基本正常,各组动物细胞形态未见明显异常。病理检查结果显示,各组均有部分动物出现了骨髓粒系造血细胞增多,高剂量组有 2 只动物出现了肝脏中性粒细胞的浸润,阳性对照组 1 只动物腹股沟淋巴结髓质淋巴窦内可见粒系造血细胞。脾脏未见异常改变。说明 rHSA/GCSF 在剂量为 15、50 和150 μg/kg 时,每 4 天注射 1 次,对60Coγ 照射所致的猴外周血白细胞减少症具有治疗作用,与市售普通 rhG-CSF 每天注射 1 次具有可比性。
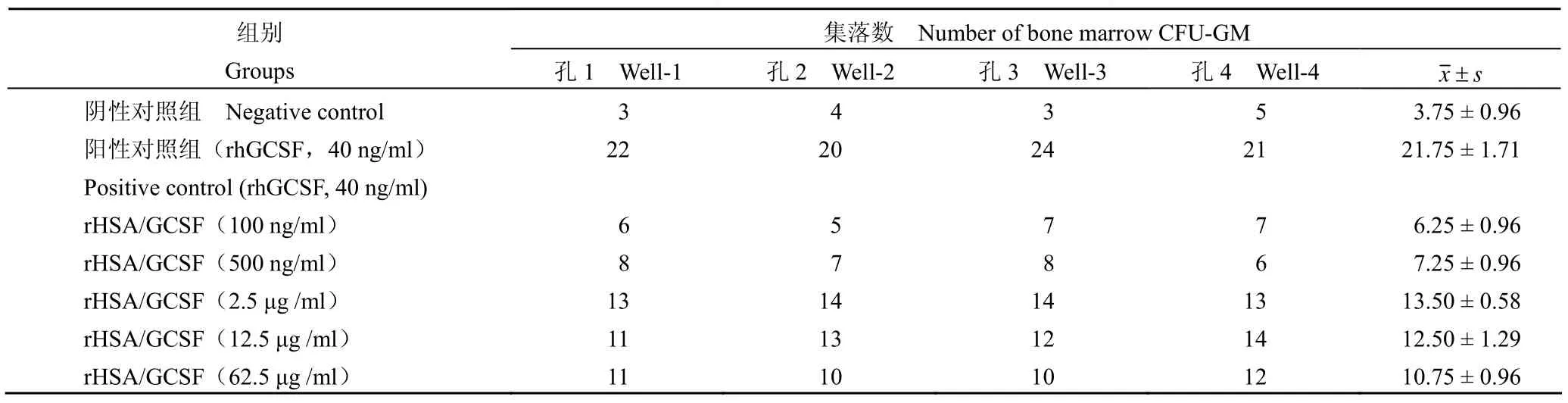
表1 rHSA/GCSF 对骨髓 CFU-GM 集落形成的影响Table 1 rHSA/GCSF stimulating function on bone marrow forming CFU-GM

图1 rHSA/GCSF 对 5-Fu 化疗小鼠 WBC 影响的变化趋势图Figure 1 The effect of rHSA/GCSF on peripheral WBC of mice after treated with 5-Fu
2.2 安全药理
2.2.1小鼠安全药理试验 给药后,供试品组动物一般行为活动好,未见异常姿势、步态,无流涎、肌颤等现象发生,瞳孔无改变,观察时间内未见其他异常。rHSA/GCSF 组与生理盐水阴性对照组对小鼠自主活动的影响比较未见明显差异,由此认为给药对小鼠的自主活动没有影响。rHSA/GCSF 对小鼠睡眠情况影响试验中,给药组对戊巴比妥钠引起的翻正反射消失数、入睡时间及睡眠持续时间与生理盐水阴性对照组比较未见明显差别。
2.2.2狗安全药理试验 对狗一般状况的影响试验过程中,狗均处于比较稳定的麻醉状态,角膜反射消失,四肢及腹部肌肉松弛,呼吸深大且平稳。对狗心血管系统和呼吸系统的影响心电图指标:给药后各给药组动物心电图各参数值(心率、QRS 间期、QRS 电压、Q-T 间期、QTc 间期)与对照组比较,均无明显差异;低剂量组在给药后 60、90、120 min 与同一时间点对照组比较 P-R 间期均延长,与药前比较无明显差异;其他时间点未见异常;各组动物心电图波形均未见异常改变。血压指标:给药后各剂量组动物的收缩压与同一时间点对照组比较均无统计学差别,低剂量组在药后 60 min与同一时间点对照组比较,平均动脉压和舒张压均降低,与药前比较无明显差异,其他时间点未见异常。呼吸系统指标:各给药组动物的呼吸频率、呼吸幅度与对照组比较未见明显差异。因此,可以确认各组药物对狗呼吸系统无明显影响。

图2 rHSA/GCSF 对60Coγ 射线照射小鼠 WBC 水平的影响Figure 2 The effect of rHSA/GCSF on peripheral WBC of mice after irradiated with60Coγ rays
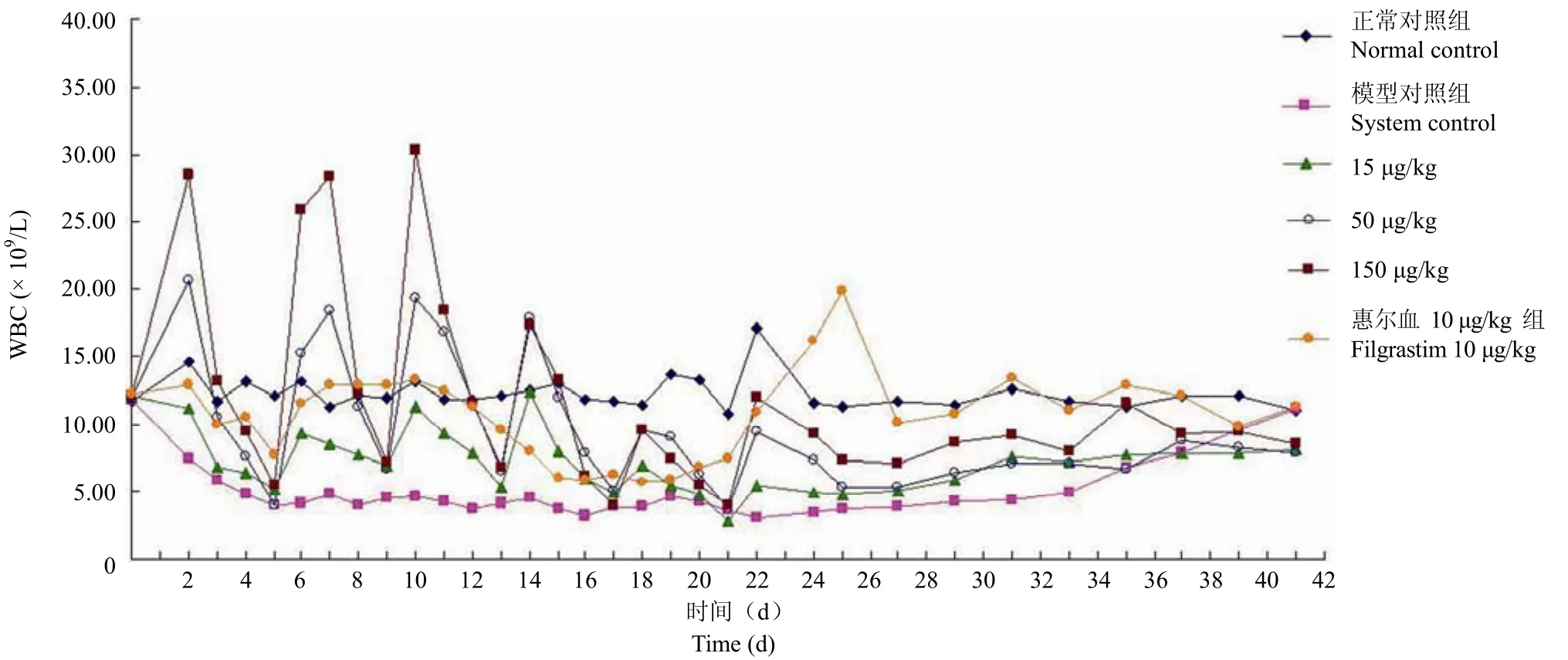
图3 rHSA/GCSF 对60Coγ 照射猴 WBC 数变化的影响Figure 3 The effect of rHSA/GCSF on peripheral WBC of monkey after irradiated with60Coγ rays
2.3 安全性评价
2.3.1急性毒性实验
2.3.1.1小鼠急性毒性实验 给药后就一般生理指标连续观察 4 h,所有动物未见异常反应;试验期间,动物精神状态良好,活动自如,呼吸平稳,被毛光滑,大便成型色正,未见异常表现。给药后7 d 和 13 d 分别测定了每笼中的剩余饲料,并计算每只动物平均每天的食量。结果显示给药组雌性和雄性动物的食量与同期对照组比较未见明显影响。皮下给药组雌雄性动物各给药组的平均体重在给药后 3、7、10 和 14 d 与同期对照组比较,均未见统计学差异。静脉注射给药组雄性动物的平均体重在给药后 3、7 和 10 d 与同期对照组比较体重降低(P< 0.05),体重增长减缓;而雌性动物体重在药后 3、7和 10 d 与同期对照组比较,未见统计学差异。上述情况可能与给药有关或与动物性别有关。观察期结束后对动物施行安乐死并进行大体解剖,均未见异常。试验确认重组人血清白蛋白/粒细胞刺激因子融合蛋白单次皮下和静脉注射给予小鼠的最大耐受量(MTD)≥ 37.5 mg/kg。试验中未见影响研究可靠性和造成研究工作偏离实验方案的其他异常情况。
2.3.1.2食蟹猴急性毒性实验 3 个给药剂量组的动物一般临床考察、体温、体重、食量、心电图均未见显著异常。3 个给药组给药后 WBC 明显升高,2.3 mg/kg 组和 5.2 mg/kg 组给药后 4 d 达最高值,11.6 mg/kg 组药后 5 d 达最高值,之后逐渐回落,至给药后 14 d 未恢复给药前水平;同时中性粒细胞数明显升高,淋巴细胞数也有小幅升高,2.3 mg/kg 和 5.2 mg/kg 组药后第 4 天,11.6 mg/kg组药后第 3 天达最高值。RBC、HGB 和 HCT 给药后 2 ~ 7 d 略有降低,药后 14 d 下降较明显。Ret 药后小幅升高至药后 4 d 逐渐回落,药后 14 d出现明显升高。PLT 药后 2 ~ 7 d 内逐渐降低,而药后 14 d 则明显升高。血生化指标显示给药剂量为 2.3 mg/kg,药后 7 d 和 14 d A/G 略有下降,血清 Alb 略有下降而 TP 略有增加;给药后 14 d TBil 略有升高。ALP 给药后 3 d 和 7 d 升高,给药后 14 d 基本恢复。GLU 给药后 7 d 略有升高。给药剂量为 5.2 mg/kg,给药后 1 d ALT 和 AST明显升高,给药后 3 d 略有恢复但仍高于药前值,给药后 7 d 基本恢复药前水平;A/G 给药后 7 d 和 14 d 略有下降,血清 Alb 略有下降而 TP 变化不大;TBil 给药后 3 d 升高。CK 给药后 1 d 升高,ALP 给药后 3 d 和 7 d 升高,给药后 14 d基本恢复。GLU 给药后 14 d 升高。给药剂量为11.6 mg/kg,给药后 3 d AST 升高,给药后 7 d 和14 d A/G 略有下降;TBil 给药后 7 d 略有增加。CK 给药后 3 d 升高,ALP 给药后 1、3 和 7 d 逐渐升高,给药后 7 d 达 3349 U/L,给药后 14 d 下降,但仍高于给药前值。尿液检查各组未见异常。3 个剂量组动物安乐死后,取胸骨骨髓涂片,镜下观察可见骨髓增生极度活跃。2.3 mg/kg 给药组的动物 MIE 为 1.59∶1,粒系增生活跃,占 47.0%,各阶段细胞形态未见明显异常;红系增生活跃,占29.5%,早期细胞少见,成熟红细胞大小、形态未见明显异常。淋巴细胞占 22.0%,细胞形态未见明显异常;巨核细胞易见,血小板易见。5.2 mg/kg给药组的动物 MIE 为 1.05∶1,粒系增生活跃,占46.0%,各阶段细胞比值、形态未见明显异常;红系增生明显活跃,占 43.5%,晚红细胞比值增多,占 30.0%,细胞基本形态正常,成熟红细胞大小、形态大致正常。淋巴细胞占 10.0%,细胞形态未见明显异常;巨核细胞易见,血小板易见。11.6 mg/kg给药组的动物 MIE 为 1.71∶1,粒系增生活跃,占55.0%,杆状核粒细胞比值偏高,占 30.0%,部分中、晚幼粒细胞可见浆中颗粒增多现象;红系增生活跃,占 32.0%,部分晚红细胞可见核畸变,成熟红细胞大小、形态未见明显异常。淋巴细胞占10.5%,细胞形态未见明显异常;巨核细胞易见,血小板易见。各剂量组的食蟹猴病理解剖未见由于给药产生的异常。在本试验条件下,rHSA/GCSF单次皮下注射给予食蟹猴的最大耐受剂量为11.6 mg/kg。
2.3.2长期毒性实验
2.3.2.1大鼠长期毒性实验 临床观察:试验期间无动物死亡。主要临床表现为第 7 ~ 16 次给药后给药组共有 7 只动物出现后肢肿胀,其中,高剂量组 3 只动物(均为雄性),最早出现在给药6 周左右,中剂量组 4 只动物(雄 3 只,雌1 只),最早出现在给药 3 ~ 4 周时,低剂量组未见类似症状出现。各给药组动物食量、体温、体重、体重增长量和体重增长率与同期对照组相比未见统计学差异。
血液学指标:血细胞计数,包括总白细胞计数、粒细胞计数、红细胞系、凝血功能、血液生化指标、尿液等,结果表明总白细胞计数、粒细胞计数有显著升高(图 4)。
抗体测定:给药 2 周时,各剂量组雌性动物均产生抗 GCSF 的抗体(每组均为 5/5),各剂量组雄性动物中部分动物产生了抗 GCSF 的抗体(每组均为 4/5)。给药 4 周时,各剂量组雌性动物均检测到抗 GCSF 的抗体(每组均为 5/5);高剂量组雄性动物均检测到抗GCSF的抗体,中、低剂量组雄性动物部分检测到了抗 GCSF 的抗体(低剂量 3/5,中剂量2/5,高剂量 5/5)。高剂量组动物抗体滴度有增强趋势,中、低剂量组抗体滴度未见明显增强。给药 8 周,各剂量组动物均检测到了抗 GCSF 的抗体(每组均为 10/10,雌雄各半)。末次给药后,抗体滴度未见明显增强,抗体滴度维持给药 8 周时水平或略有波动。恢复期结束时,各剂量组雌性动物抗体滴度明显减弱,雄性动物抗体滴度略有减弱。中和抗体结果显示,产生的抗体为中和抗体,可部分中和药物活性。

图4 rHSA/GCSF 反复皮下注射给大鼠 13 周对雄性(A)、雌性(B)大鼠外周血中性粒细胞计数的影响Figure 4 The effect of rHSA/GCSF on peripheral neutrophil counts of rats after 13 weeks’ repeated subcutaneous injections
骨髓涂片:给药 4 周安乐死的动物骨髓涂片结果显示,各给药组骨髓细胞形态未见明显异常,部分动物中晚粒细胞可见胞浆颗粒增多现象;在数值上,仅 1200 µg/kg 组雄性动物粒细胞系比例与同期对照组比增加(P< 0.05),其他给药组雌雄动物粒细胞系比例与同期对照组比较虽未见统计学差异,但均有增加趋势,其中以中性粒细胞增加为主,中性粒细胞中各阶段细胞均有增加趋势。各剂量组雄性动物红细胞系比例有下降趋势,雌性动物未见红细胞系比例有下降,但雌雄动物粒红比值均有增加。各剂量组雌雄动物淋巴细胞比例均有下降趋势。其他系统未见明显异常。末次给药后安乐死的动物骨髓涂片结果显示,各给药组骨髓细胞形态未见明显与异常,部分动物中晚粒细胞可见胞浆颗粒增多现象;在数值上,与同期对照组比较,仅1200 µg/kg 组雄性动物粒红比值下降(P < 0.01),其他给药组雌雄动物各系比例均未见明显异常。另有 5000 µg/kg 组个别雄性动物粒系比例和粒红比值明显升高,红细胞系增生减低。恢复期结束安乐死的动物骨髓涂片结果显示,各给药组骨髓细胞形态未见明显与异常,部分动物中晚粒细胞可见胞浆颗粒增多现象;在数值上,与同期对照组比较,各给药组雌雄动物各系细胞比例均未见明显异常。
脏器重量和脏器系数:给药 4 周时,与同期对照组相比较,雌性动物各剂量组未见明显异常;雄性动物 5000 µg/kg 组肾脏和睾丸重量增加(P <0.05),但脏器系数未见统计学差异。1200 µg/kg 组及 5000 µg/kg 组雌雄动物脾脏重量、脏体比和脏脑比与同期对照组比较虽未见统计学差异,但数值上有增加趋势。
末次给药后,与同期对照组相比较,雌性动物各剂量组未见明显异常;雄性动物 5000 µg/kg 组脾脏重量、脏体比和脏脑比增加(P < 0.01)。恢复期结束时,与同期对照组相比较,雌性动物各剂量组未见明显异常;5000 µg/kg 组雄性动物脾脏重量、脏体比和脏脑比增加(P < 0.01),1200 µg/kg 组脾脏重量和脏脑比增加(P < 0.05)。
组织病理学检查:生理盐水对照组在给药4 周、末次给药后 2 d 及停药 4 周后安乐死的动物中,少数可见肝脏、心脏、肺脏、肾脏等组织器官的大鼠常见自发病或背景性病理改变。颈背部给药局部皮下组织均未见明显异常改变。少数动物可见与对照组相似的病理改变,部分动物可见不同程度的脾脏和肝脏髓外造血,主要表现为脾脏红髓及小梁周围可见粒系造血细胞集落及成熟中性粒细胞,以晚幼粒细胞及杆状核细胞为主;肝脏小叶内或汇管区周围可见造血细胞集落,以晚幼粒细胞及杆状核细胞为主;肺脏肺泡壁内成熟中性粒细胞浸润;骨髓粒系造血细胞增多,并可见成熟中性粒细胞。给药组个别动物可见皮下组织水肿和跟骨、跖骨膜内成骨改变。给药局部可见不同程度的皮下灶状炎细胞浸润。上述表现停药后均可恢复。
开展长毒试验中无其他影响研究可靠性和造成研究工作偏离实验方案的异常情况。
2.3.2.2食蟹猴长期毒性实验 各剂量组临床一般观察、体重、食量、体温、心电图没有发现显著异常。血液学指标检查显示白细胞升高并与剂量有直接关系(图 5)。试验期间,各组动物在观察时未见明显的与给药相关的异常改变。给药动物体重、体温、摄食量及心电图指标未见明显异常。给予 rHSA/GCSF 后,各给药组可见白细胞和红系血细胞数的改变,表现为给药后外周血白细胞及中性粒细胞升高,末次给药后白细胞有降低趋势;HGB、RBC、HCT 降低,PLT 未见明显异常。停药观察4 周,各项血液学指标的改变可恢复。血凝指标PT、APTT 均在正常范围内波动,未见具有毒理意义的规律性改变。各组动物生化指标、尿常规指标和眼科检查未见异常。
给药后动物体内产生抗体的检测显示给药2 周,30、150、750 μg/kg 组均有部分动物(分别为 2/6、2/6、4/6)产生了抗 GCSF 抗体,抗体滴度最高达1∶1600。给药 4 周,750 μg/kg 组所有动物(6/6)均产生了抗 GCSF 抗体,30、150 μg/kg组仍有部分动物产生了抗体(分别为 2/6、4/6)。给药 6 周和 8 周,150、750 μg/kg组所有动物(6/6)均产生了抗 GCSF 抗体,30 μg/kg 组有4/6 只动物产生了抗体,抗体滴度最高达 1∶6400。停药后,抗体滴度均有显著下降趋势。给药期间监测的抗体情况显示动物体内产生了抗 GCSF 抗体,该抗体具有中和 rHSA/GCSF 活性的作用。
猴骨髓细胞学检查未见明显异常。病理改变主要为 150 μg/kg 和 750 μg/kg 组部分动物骨髓幼稚粒细胞增多和髓外造血。末次给药后及恢复期结束安乐死的所有动物尸检均未见明显与给药相关的异常改变。与同期对照组比较,末次给药后及恢复期结束各组动物的脏器重量及脏器系数未见具有毒理意义的变化。组织学检查未见显著与给药相关的组织器官和给药局部异常。
在本试验条件下,rHSA/GCSF 反复皮下注射给予食蟹猴,剂量为 30、150、750 μg/kg,每周给药 1 次,连续给药 8 周,可引起动物外周血白细胞升高,主要为中性粒细胞升高,RBC、HGB、HCT降低,病理组织学检查可见中、高剂量组部分动物骨髓幼稚粒细胞增多和髓外造血。停药后可恢复。30 μg/kg 组动物主要反应为白细胞和中性粒细胞升高,红细胞和血红蛋白轻度降低,未见其他毒性反应。所以 rHSA/GCSF 反复给予食蟹猴的安全剂量为 150 μg/kg。
rHSA/GCSF 反复给予食蟹猴,动物体内可产生抗体,抗体具有中和活性的作用,反复给药后可使血药浓度下降。rHSA/GCSF 反复给予食蟹猴可产生局部轻度刺激反应,停药后可恢复。
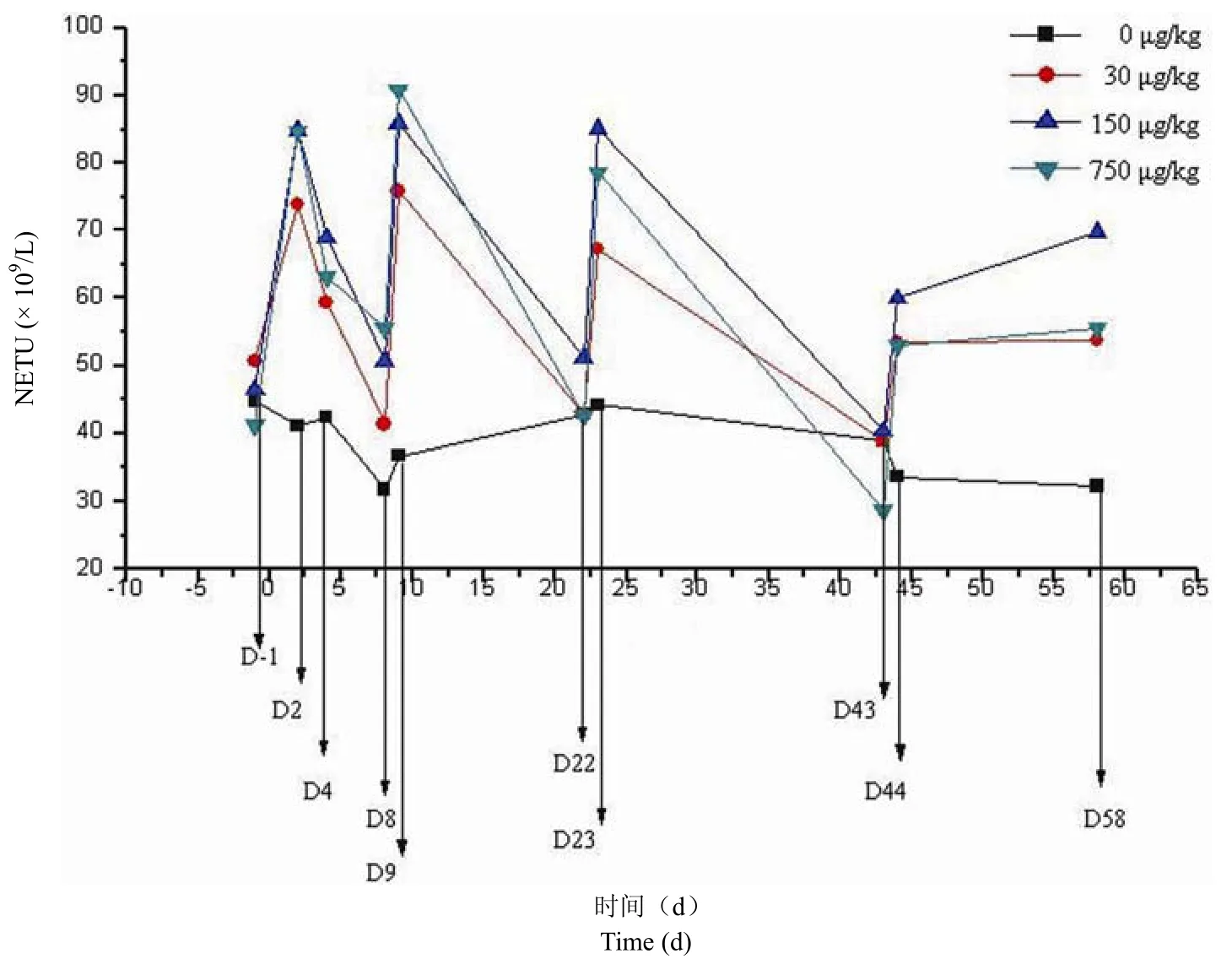
图5 rHSA/GCSF 反复皮下注射给予食蟹猴 8 周对外周血中性粒细胞计数的影响Figure 5 The effect of rHSA/GCSF on peripheral neutrophil counts of monkeys after 8 weeks’ repeated subcutaneous injections
2.4 药代/毒代评价
2.4.1药代动力学评价125I-rHSA/GCSF 的放化纯度结果显示达(95.43 ± 1.09)%。取配制后的125I-rHSA/ GCSF(60 μg/ml)2.0 μl,经 γ-Counter 测定其 cpm 值为 117303,经求算其平均比活度为23.27 Bq/ng。rHSA/GCSF 原液活性为:2.60E + 06 IU/ml,比活性为:1.88E + 07 IU/mg;125I-rHSA/ GCSF 活性为:1.67E + 06 IU/ml,比活性为:1.52E + 07 IU/mg。计算得出标记后蛋白比活性下降约为19.2%(为标记前的 81.8%),能够满足测定要求。检测方法的原理及特异性:经 10% TCA 酸沉淀后,125I-HSA/GCSF 原形主要在酸沉淀部分。方法灵敏度取决于125I-rHSA/GCSF 的比活度和放射性测量时间,对低放射性样品测量时间适当延长。本实验的灵敏度定为每克组织或者每毫升体液比本底放射性计数高 1 Bq,约为 2 Bq/g(或Bq/ml)组织湿重或体液,相当于 0.09 ng-当量/g(ml)组织湿重(体液)。实际测量精密度 < 20% 的 LOQ 约为 0.12 ng-当量/g(ml)。在 0.12 ~ 1200 ng-当量范围内,不同组织/体液中加入125I-HSA/GCSF,加入量与总放射性以及 TCA 沉淀放射性之间的线性关系良好,相关系数均大于 0.99,CV% 多数小于20%。不同组织/体液中加入125I-rHSA/GCSF 溶液,大部分组织/体液 TCA 可沉淀部分的放射性占总放射性的 90% 以上,提示在实验条件下125I-rHSA/ GCSF 原形主要在 TCA 沉淀部分。酸沉淀方法学确证表明,本方法基本满足分布试验要求。
组织分布:小鼠皮下注射125I-rHSA/GCSF 后,多数组织/多数时间点 TCA 沉淀放射性/总放射性的比值都较高,表明125I-rHSA/GCSF 大部分集中在TCA 沉淀中。尿的 TCA 沉淀放射性比例很小,说明尿液中为可溶性的小分子代谢物。125I-rHSA/GCSF在小鼠的不同组织/器官的分布见图 6。该药物主要经肾脏排泄,并且药物不易透过血-脑脊液屏障。方法学证明125I-rHSA/GCSF 大部分存在 TCA 沉淀部分,故沉淀部分放射性比总放射性更接近于原形药物的分布情况。
血清125I-rHSA/GCSF 放射性浓度:大鼠皮下注射、静脉注射125I-rHSA/GCSF 后,不同时间血清总放射性及 TCA 沉淀放射性见表 2。125I-rHSA/ GCSF 在食蟹猴体内的药动学参数125I-rHSA/ GCSF 总放射性和 TCA 沉淀放射性的代谢动力学参数见表 3。
静脉注射125I-rHSA/GCSF 后总放射性和TCA 沉淀放射性的末端t1/2分别为(32.38 ± 3.83)和(31.96 ± 3.80)h;Cmax分别为(7551.33 ± 2964.69)和(7517.14 ± 2940.13)ng-当量/ml,AUC(0-t)分别为(48.43 ± 15.93)和(45.57 ± 14.89)h*μg-当量/ml;AUCinf分别为(49.21 ± 16.06)和(46.30 ± 15.01)h*μg-当量/ml;Vd分别为(63.99 ± 27.66)和(67.39 ± 9.85)ml;Cl 分别为(1.35 ± 0.50)和(1.44 ± 0.56)ml/h;MRT 分别为(22.20 ± 3.75)和(22.66 ± 3.54)h。
尿、粪中放射性的排泄:大鼠皮下注射125I-rHSA/GCSF 后 9 d 内粪和尿放射性的排泄显示放射性主要经尿排泄,少量经粪排泄,9 d 后尿、粪分别排出注入放射性量的(84.63 ± 17.32)%和(3.76 ± 1.41)%,尿、粪合计排出注入放射性量的(88.40 ± 18.43)%。
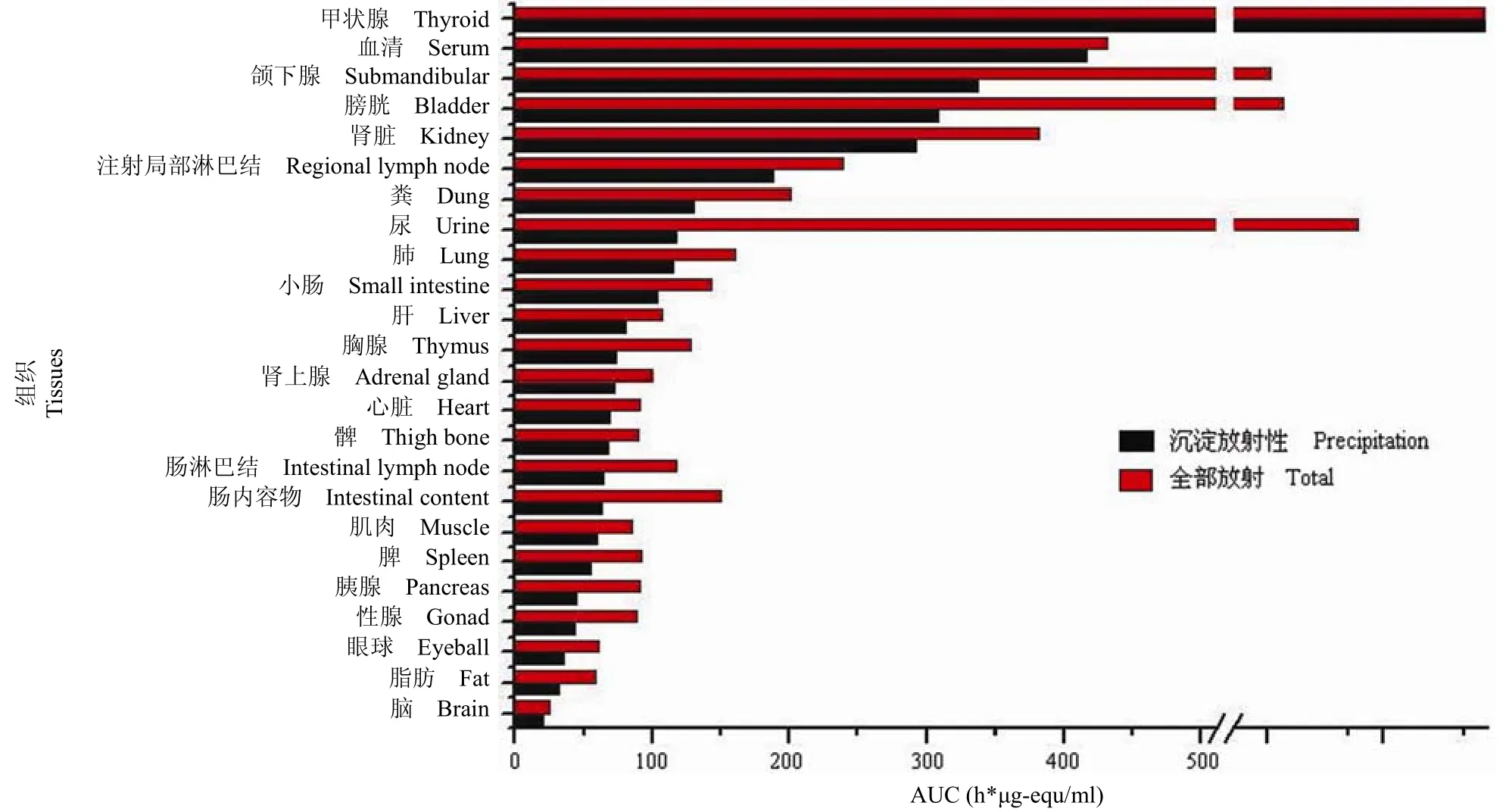
图6 小鼠皮下注射125I-HSA/GCSF 后组织分布图Figure 6 The tissues distribution of mice after subcutaneous injection of125I-HSA/GCSF
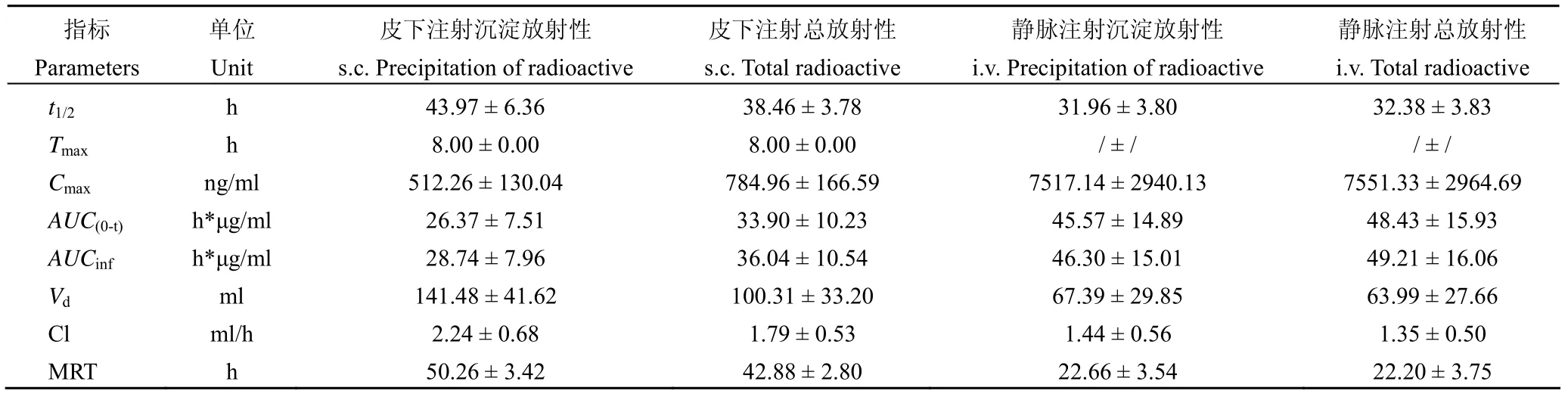
表2 125I-rHSA/GCSF 在大鼠体内代谢动力学参数比较Table 2 Metabolism kinetic parameters comparison of rats after subcutaneous/intravenous injection of125I-HSA/GCSF
胆汁放射性的排泄:大鼠皮下注射125I-rHSA/GCSF 后 8 h 内胆汁排泄放射性为(1.30 ± 0.48)%。
体外血浆蛋白结合:未发现125I-rHSA/GCSF与血浆蛋白结合。
部分血清、胆汁、尿液样品的 SEC-HPLC 分析:结果显示了胆汁及尿样中为小分子的125I-rHSA/GCSF 降解产物,无原形存在;血清中125I-rHSA/GCSF 的原形峰和降解产物峰并存,并且不同时间点,125I-rHSA/GCSF 原型峰强度随时间而变化。
2.4.2食蟹猴的药代/毒代动力学 首次 s.c. 注射不同剂量的 rHSA/GCSF,在食蟹猴体内的药动学参数见表 3。在毒代动力学分析中,rHSA/GCSF 在 3 个剂量水平(30、150 及 750 μg/kg)多次给予食蟹猴,结果发现,血浆药物浓度及代谢动力学参数(除高剂量组 MRT 外)在性别间均未见统计差异,Cmax、AUC随着剂量增加而升高,基本呈现线性动力学特征(表 4)。第 8 次给药后,大多数样品中 rHSA/GCSF 含量低于检测限。rHSA/GCSF连续给药后,在食蟹猴体内未见蓄积。
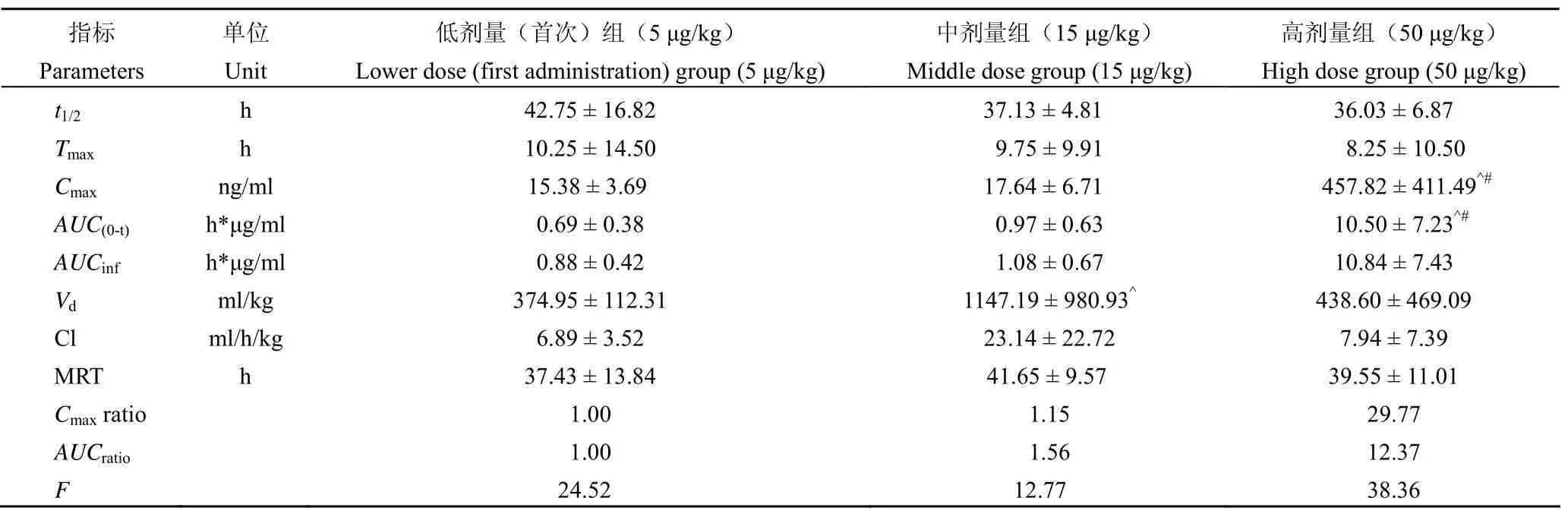
表3 皮下注射 rHSA/GCSF 后食蟹猴药代谢动力学参数(x±s,n = 4)Table 3 Pharmacokinetics parameters of monkeys after subcutaneous administration of rHSA/GCSF

表4 rHSA/GCSF 给予食蟹猴后毒代谢动力学参数Table 4 The toxicokinetics of monkeys after subcutaneous administration of rHSA/GCSF
3 讨论
药效学试验表明 rHSA/GCSF 可以使骨髓粒系增生活跃,骨髓粒系造血细胞及成熟中性粒细胞均明显增多,对白细胞低下,尤其是粒白细胞低下症有治疗作用。毒性试验考察了 rHSA/GCSF 对食蟹猴骨髓造血的影响。rHSA/GCSF 在 30 ~ 750 μg/kg 剂量下,皮下注射给予食蟹猴,可促使动物骨髓粒系造血活跃,主要表现为外周血白细胞及中性粒细胞明显增多,骨髓病理组织学观察中也可见 150 μg/kg 和 750 μg/kg 剂量组的部分动物骨髓粒系增生活跃,幼稚粒细胞增多。髓外造血也是考察的内容,在本试验中,在 750 μg/kg 剂量组的 1 只动物可见脾窦中性粒细胞数量增多现象,而在其他剂量下未见明显的髓外造血,在 rHSA/GCSF 的大鼠反复给药的毒性试验中,可见较明显的肝脾的髓外造血。需要讨论的是关于祖细胞耗竭的问题,重组人粒细胞集落刺激因子可促进骨髓中性粒细胞生成,并促使其成熟并释放至外周血中,在反复给药的毒性试验中,持续刺激骨髓向粒系祖细胞转化,同时关注能否导致骨髓祖细胞的耗竭。在本试验中,从骨髓涂片检查及骨髓病理组织学检查中均未发现红细胞系及其他细胞系的明显抑制。动物试验证明对食蟹猴外周血细胞数的影响,rHSA/GCSF 在30 ~ 750 μg/kg 剂量下给予食蟹猴,可明显提高动物外周血白细胞及中性粒细胞数,同时淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞也有不同程度的增加。出现外周血红细胞、血红蛋白和红细胞容积下降,有剂量关系,但下降幅度较小(≤ 同期对照组的 15%)。上述贫血现象在普通 GCSF 产品中也有发生,文献[5]报道可能是由于骨髓粒细胞加速增殖导致红细胞系造血受到轻度的抑制,具体机制还有待进一步研究。rHSA/GCSF 对外周血细胞计数的影响在停药后可恢复,是可逆性反应。食蟹猴毒性试验中部分动物外周血红细胞计数和血红蛋白含量下降,血小板计数给药后出现降低,药后 14 d 出现异常增高。文献中报道粒细胞集落刺激因子用于临床,对正常受试者外周血细胞计数的影响也有上述类似反应[6]。给药后,动物血清碱性磷酸酶显著增高,其中 2.3 mg/kg 和 5.2 mg/kg 组动物给药后 3 d 达最高值,11.6 mg/kg 组动物给药后 7 d 达最高值,并且碱性磷酸酶升高与给药剂量有关。ALP 在成熟中性粒细胞和单核细胞胞浆中可以检测到,有文献[7-8]报道应用普通的 GCSF 可以刺激中性粒细胞中 ALP 的合成,并且 ALP 很可能是通过损伤或死亡的中性粒细胞释放到血流中去的。Kato 等[9]在普通 GCS 给予大鼠的试验中也认为血清中 ALP 增高源于中性粒细胞。
融合蛋白的安全性主要考察的内容是 rHSA/ GCSF 作为药物使用是否会产生抗原性的问题。试验观察到给药 2 周、4 周,3 个剂量组均有部分动物产生了抗 GCSF 抗体,给药 6 周以后,150 μg/kg 和 750 μg/kg 剂量组所有动物均产生了抗 GCSF 抗体,30 μg/kg 剂量组仍只有 4/6 只动物产生了抗 GCSF 抗体,停药后,抗体滴度有下降趋势。抗 GCSF 抗体可见部分中和 GCSF 活性的作用。抗体产生后,再次给予 rHSA/GCSF,动物生物反应下降。考虑到血清白蛋白具有极为强烈的种属差异,受试动物注射给予异源白蛋白将产生结合抗体,这也使得 rHSA/GCSF 融合蛋白高剂量时在大鼠、食蟹猴反复给药中很快出现结合抗体,抗体具有中和抗体的表现是可以预期的。但是在人体中同源的人血清白蛋白,应该较不易产生结合抗体。在动物体内观察到的现象是否与在人体中相同,这也是需要开展临床试验的理由。另外,融合蛋白与抗体结合是否会同时影响融合蛋白中的细胞因子(例如:GCSF、EPO)与相应受体的结合?融合蛋白与抗体结合的复合体是如何在血液中清除?在清除过程中细胞因子获得释放仍然具有与其受体结合的能力和功能也是需要开展临床试验的理由。
本研究选择的依据是 rHSA/GCSF 是重组融合蛋白,其分子结构包含 HSA 和 GCSF 两个部分,这个设计是希望达到如下目的:
首先,保持 GCSF 的生物学活性,升高白细胞,治疗放疗和化疗引起的白细胞(中性粒细胞)减少症;其次,作用长效,常规 rhG-CSF 需要每天给药 1 次,以维持白细胞水平,希望 rHSA/ GCSF 的半衰期延长,给药 1 次,维持 3 ~ 7 d 的升白作用,但不希望过长,过长将会使得升白作用难以控制,而出现安全隐患;最后,在发挥长效治疗作用的同时,不带来新的安全隐患,就是说不出现常规 rhG-CSF 以外的毒性反应。
为评价 rHSA/GCSF 是否达到上述研制目标,我们开展了药理毒理动物试验研究,试验选择的考虑如下:
⑴升白作用和特点
CFU-GM 形成试验:该试验是考察 rHSA/ GCSF 是否和 rhG-CSF 一样,具有与 GCSF 受体结合而刺激粒系祖细胞增殖的作用,反应分子设计的合理性。试验结果验证了 rHSA/GCSF 可以与GCSF 受体结合,但其刺激集落形成的能力低于rhG-CSF,表明与 HSA 结合在体外降低 GCSF 活性,这与其他修饰蛋白的长效制剂(如 PEG-rhGCSF)一致。
小鼠和猴白细胞减少症试验:为观察 rHSA/ GCSF 在不同种动物的反应,我们开展了啮齿类和非人灵长类(NHP)试验,结果显示在两种动物上,都发挥出治疗作用,但在 NHP 作用更突出,有效剂量更低,更敏感;这说明开展 NHP 试验的价值。
化疗模型和放疗模型:为了解 rHSA/GCSF 对化疗和放疗引起的白细胞减少症的治疗作用,我们分别开展了两种模型的研究。由于放疗模型,可以获得长时间的白细胞减少症模型,便于观察疗效和发现治疗特点,这也是考虑放疗模型的原因之一。
⑵长效作用
认识其代谢特点、以及分子代谢与生物学作用之间的关系,对临床试验的方案制定具有重要意义。为此按照生物制品研究的常规要求,开展了小鼠和大鼠的药代动力学、组织分布、排泄消除和体外血浆蛋白结合试验,测定了食蟹猴体内的药代动力学参数和生物利用度,并观察了药效动力学。
⑶安全性评价
按照法规要求和 rHSA/GCSF 的动物敏感性特点开展了系统的安全性评价试验,获得了安全剂量、毒性反应特点、毒性靶器官。
对研究结果的分析和评价获得如下几点。
⑴有效性分析
升白作用:试验结果显示,rHSA/GCSF 在小鼠模型和猴模型都显示出显著的升白(升粒细胞)作用,且表现出一定的量效关系,在猴试验中量效关系良好,表明 rHSA/GCSF 具有 rhG-CSF 相似的生物学作用,在给药后次日白细胞出现明显升高,起效快。
有效剂量:在小鼠试验中 150 μg/kg、在猴试验中 15 μg/kg 显示出显著的升白作用,达到和超过 rhG-CSF 的治疗作用,也表明猴更敏感。
长效特征:小鼠和猴的药效试验都显示出相似的长效作用,给药 1 次,可维持白细胞水平高于模型组(最低点与阳性对照组相似)4 d;药代动力学研究显示,大鼠皮下注射的 t1/2为(43.97 ± 6.36)h;单次皮下注射给予食蟹猴 rHSA/GCSF 的t1/2分别为(42.75 ± 16.82)h(5 μg/kg)、(37.13 ± 4.81)h(15 μg/kg)和(36.03 ± 6.87)h(50 μg/kg);在啮齿类和 NHP 相似。这一结果也与 Halpern 等[3]报道在 Cynomolgus 猴中给药剂量为 100 ~1000 μg/kg 时的 t1/2、MRT 和 CL/F(清除率/蓄积因子)分别是 7.73 ~ 13.3 h、19.4 ~ 27.3 h 和 7.90 ~27.5 ml/h/kg 趋势相似,但 t1/2要长约 3 倍。
剂量与作用时间:小鼠和猴的药效试验都显示,较高的剂量可以使白细胞计数增加幅度大,但并不延长其升白作用时间;这与不同剂量的 t1/2相似,甚至高剂量的 t1/2更短有关。剂量增加,但生物作用时间不延长,可能与白细胞介导的 GCSF消除有关。
⑵安全性分析
rHSA/GCSF 的总体安全性好,在剂量高达11.6 mg/kg 时,猴没有出现严重的毒性反应。大鼠和猴反复给药的毒性试验结果显示,其安全剂量分别为 300 和 150 μg/kg,分别是猴有效剂量(15 μg/kg)的 20 和 10 倍。
主要毒性反应和毒性靶器官:包括肝功能异常,ALT、AST 和 CK 的一过性升高、后肢肿胀、骨结构异常、髓外造血、ALP 升高、白血病在组织中的浸润、轻度贫血、脾脏增大,这些变化停药后可恢复。其主要毒性靶器官是骨骼和过度刺激而引起的骨髓抑制。
毒性反应的主要指征:毒理学试验结果显示,临床试验中应注意监测白细胞计数、RBC(HGB、HCT、Ret)、ALT、AST、CK、ALP。
与 rhG-CSF 毒性反应的差别:毒理学研究结果显示,rHSA/GCSF 的毒性表现与常规 rhG-CSF产品相似,没有出现新的不良反应。
临床前研究结果显示,rHSA/GCSF 显示出与rhG-CSF 相似的生物学作用,可以用于治疗放疗和化疗引起的白细胞减少症,以及其他 rhG-CSF 的适应证。最敏感动物猴的药效试验显示,15 μg/kg(约 180 μg/m2)显示出显著的疗效,该剂量引起的白细胞升高,高于药前值。以该剂量为基础,推算人用起始剂量为 280 μg/人(约为 300 μg/人)。根据小鼠和猴的药效试验结果显示,4 d 给药 1 次,可以维持白细胞计高于模型组,并与阳性对照相当。猴反复给药的毒性试验结果显示,7 d 给药1 次,在第 4 天有升白作用,但第 7 天完全恢复正常,因此,rHSA/GCSF 的升白作用持续时间在4 ~ 7 d。小鼠和猴的生物反应相似,提示在人体的持续时间可能相近。
总之,注射用重组人血清白蛋白/粒细胞刺激因子融合蛋白对白细胞减少症有显著的治疗作用,表现出长效特征,总体安全性好,安全剂量范围大,为肿瘤患者化疗过程中粒细胞减少的防治提供了新的选择。
[1] Lieschke GJ, Burgess AW. Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor (1). N Engl J Med, 1992, 327(1):28-35.
[2] Lieschke GJ, Burgess AW. Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor (2). N Engl J Med, 1992, 327(2):99-106.
[3] Halpern W, Riccobene TA, Agostini H, et al. Albugranin, a recombinant human granulocyte colony stimulating factor (G-CSF) genetically fused to recombinant human albumin induces prolonged myelopoietic effects in mice and monkeys. Pharm Res, 2002, 19(11): 1720-1729.
[4] Fu Y, Han G, Fu YS, et al. Expression and physical and chemical characterization studies of recombinant human serum albumin/ granulocyte colony-stimulating Factor fusion protein with long-acting bio-function. Chin Med Biotechnol, 2011, 6(3):161-172. (in Chinese)富岩, 韩国, 富俞淞, 等. 具长效性重组人血清白蛋白/粒细胞刺激因子融合蛋白的理化特性研究. 中国医药生物技术, 2011, 6(3): 161-172.
[5] Okasaki K, Funato M, Kashima M, et al. Twenty-six-week repeat-dose toxicity study of a recombinant human granulocyte colonystimulating factor derivative (nartograstim) in cynomolgus monkeys. Toxicol Sci, 2002, 65(2):246-255.
[6] Stroncek DF, Clay ME, Smith J, et al. Changes in blood counts after the administration of granulocyte-colony-stimulating factor and the collection of peripheral blood stem cells from healthy donors. Transfusion, 1996, 36(7):596-600.
[7] Izumi M, Ishikawa J, Takeshita A, et al. Increased serum alkaline phosphatase activity originating from neutrophilic leukocytes. Clin Chem, 2005, 51(9):1751-1752.
[8] Fosså SD, Poulsen JP, Aaserud A. Alkaline phosphatase and lactate dehydrogenase changes during leucocytosis induced by G-CSF in testicular cancer. Lancet, 1992, 340(8834-8835):1544.
[9] Kato Y, Yamamoto M, Ikegami J, et al. A possible mechanism of increase in serum alkaline phosphatase activity in rats given granulocyte colony-stimulating factor. Exp Anim, 1996, 45(1):23-32.
Studies on pharmacodynamics, p harmacology, and toxicology of r ecombinant human serum albumin/granulocyte colony-stimulating factor fusion protein
FU Yan*, YIN Li-li*, GU Jing-liang, MA Xian-mei, ZUO Cong-lin, YU Zai-lin
ObjectiveTo examine the pharmacodynamics, pharmacology and toxicology of recombinant serum human albumin/granulocyte colony-stimulating factor fusion protein (rHSA/GCSF), and to obtain the pharmacokinetics and toxicokinetics data for directing the ongoing human clinical trials.MethodsThe rhesus monkey bone marrow cells were used for in vitro pharmacodynamics studies and the colony form unit-granulocyte macrophage (CFU-GM) numbers were counted to evaluate the influence of rHSA/GCSF. The therapeutic efficacy of rHSA/GCSF on leucopenia in mice and monkeys caused by radiation or injection of fluorouracil were evaluated. For pharmacologic study. The influence of rHSA/GCSF on central nervous system of mice and respiratory and cardiovascular systems of dogs were observed. Through acute and chronic toxicity studies, safety evaluation about rHSA/GCSF was performed in mice, rats and cynomolgus monkeys. The pharmacokinetics /toxicokinetics studies were performed to examine the PK parameters and the tissue distributions in above indicated animals.ResultsrHSA/GCSF stimulated the proliferation in granulocytic series of bone marrow and increased the neutrophile granulocytes. rHSA/GCSF had obvious effects on leucopenia in mice caused by fluorouracil. In the early stage of chemotherapy, it slowed down the reduction of white blood cells (WBC), and brought the peripheral neutrophils back the normal level. rHSA/GCSF reduced the duration of absolute neutrophil count (ANC) nadir in leucopenia model caused by radiation in mice and accelerated the recovery of the peripheral WBC. Meanwhile, it had less influence on red blood cell (RBC) and platelet (PLT). Results in mice and monkeys showed that rHSA/GCSF had long-lasting effect. PD/PK data showed that the half-life of rHSA/GCSF was approximately 38.6 hours; single dose of rHSA/GCSF (500, 1500 and 3000 μg/kg) had no effect on nervous system of mice and no synergistic effect with pentobarbital sodium. Furthermore, single dose of rHSA/GCSF (50 and 200 μg/kg) had no effect on respiratory and cardiovascular systems of dogs. In single-dose toxicity studies, the maximum tolerated dose (MTD) in mice was ≥ 37.5 mg/kg (i.v. or s.c.) and the MTD in monkeys was 11.6 mg/kg (s.c.). In repeated-dose toxicity studies, the basic safety dose in rats and monkeys was 300 μg/kg and ≥ 150 μg/kg, respectively.ConclusionSingle dose every 4 days of rHSA/GCSF administered subcutaneously (s.c.) to the leucopenia on monkeys and mice were caused by radiation, caused by chemical therapeutic on mice, has comparable effect to the merchant rhG-CSF administered a single dose once a day. The study shows that rHSA/GCSF has a long-acting therapeutic function in all of the tested animals. The data obtained from the studies on pharmacodynamics, pharmacokinetics, toxicity and toxicokinetics provide reference and guidance for ongoing clinical trials on cancer patients.
Serum albumin; Granulocyte colony-stimulating factor; Pharmacology; Toxicology; Fusion protein
s:YU Zai-lin, Email: zyu88@yahoo.com; ZUO Cong-lin, Email: zoucl@joinn-lab.com
10.3969/cmba.j.issn.1673-713X.2012.04.001
天津市科技支撑计划(09ZCKFSH09500);国家高技术研究发展计划(863 计划)(2007AA021604);“重大新药创制”科技重大专项(2009ZX09102-254)
300457 天津溥瀛生物技术有限公司(富岩、于在林);100871北京大学生命科学学院北大-未名生物技术联合研究室/中关村开放实验室(富岩、于在林);100176 北京昭衍新药研究中心有限公司(尹丽莉、顾静良、马宪梅、左从林)
于在林,Email:zyu88@yahoo.com;左从林,Email:zuocl@joinn-lab.com
2012-07-11
*富岩、尹丽莉对本文具同等贡献
方法①对 rHSA/GCSF 开展的药效学研究内容主要有:以恒河猴骨髓细胞为研究系统,在体外条件下培养骨髓粒细胞-巨噬细胞集落(CFU-GM),计数不同浓度的 rHSA/GCSF 对 CFU-GM 数的影响的体外药效学评价;以小鼠60Coγ照射、氟尿嘧啶注射液所致的鼠白细胞低下和对60Coγ 射线照射致食蟹猴白细胞低下的治疗作用。②药理学研究观察了 rHSA/GCSF 对小鼠中枢神经系统和狗呼吸及心血管系统功能的影响。③毒理学研究考察了 rHSA/GCSF 静脉和皮下给予小鼠、食蟹猴的急性毒性反应,以及长期和反复给药对大鼠和食蟹猴的安全性做出评价。④ rHSA/GCSF 的药代/毒代试验则是对125I-rHSA/GCSF 不同剂量单次皮下注射给予小鼠、大鼠后,rHSA/GCSF 在各器官的分布、总放射性和 TCA 沉淀放射性的动力学参数测定,以及对不同剂量 rHSA/GCSF 连续给药食蟹猴后的血浆药物浓度及代谢动力学参数开展了考察。
结果① rHSA/GCSF 可以使骨髓的粒白细胞系(粒系)增生活跃,骨髓粒系造血细胞及成熟中性粒细胞均明显增多;对氟尿嘧啶所致小鼠白细胞减少症有明显的治疗作用,在使用化疗药早期,可以减缓白细胞的降低,特别是可以使粒白细胞提前恢复到正常水平;rHSA/GCSF 可显著缩短食蟹猴白细胞减少症放疗模型产生的白细胞低下持续时间,使外周血白细胞加速恢复,尤其以中性粒细胞的增加为主,同时对红细胞和血小板的影响不大。②从获得的 PD/PK 数据t1/2来看:rHSA/GCSF 半衰期平均值约为 38.6 h;单次皮下注射 rHSA/GCSF,在 500、1500、3000 μg/kg 剂量范围内对小鼠中枢神经系统无影响,与戊巴比妥钠无协同作用;单次皮下注射 rHSA/GCSF 在 50、200 μg/kg 剂量范围内对狗呼吸和心血管系统无明显影响。实验表明 rHSA/GCSF单次皮下和静脉注射给予小鼠的最大耐受量(MTD)≥37.5 mg/kg,单次皮下注射给予食蟹猴的最大耐受剂量为 11.6 mg/kg;长期反复给药对大鼠的基本安全剂量为300 μg/kg,对食蟹猴则是 ≥ 150 μg/kg。
结论rHSA/GCSF 融合蛋白每 4 天给药 1 次,对放、化疗所致的动物外周血白细胞减少症具有治疗作用,与市售常规 rhGCSF 每天注射 1 次相比具有长效作用。所获得的大量药效学、药代动力学、毒理学、毒代动力学的试验数据可供正在开展的临床试验研究参考,并具有很好的指导意义。
Author Affiliations:Tianjin SinoBiotech Ltd., Tianjin 300457, China (FU Yan, YU Zai-lin); PKU-Bioway Biotech Laboratory/ Zhongguancun Science Park Lab, Peking University College of Life Science, Beijing 100871, China (FU Yan, YU Zai-lin); Beijing Joinn Laboratory Ltd., Beijing 100176, China (YIN Li-li, GU Jing-liang, MA Xian-mei, ZUO Cong-lin)
*FU Yan and YIN Li-li have equal contribution to this paper.
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(4):241-256
