蛋白表达的亚细胞定位影响基因免疫诱导的体液免疫应答水平的研究
2012-04-13杨军陈晓黎王一理司履生
杨军,陈晓黎,王一理,司履生
·论著·
蛋白表达的亚细胞定位影响基因免疫诱导的体液免疫应答水平的研究
杨军,陈晓黎,王一理,司履生
目的研究表达产物的不同亚细胞定位对基因免疫诱导的体液免疫应答水平的影响,为基因疫苗的设计提供参考。
抗体生成; 免疫疗法; 核定位信号; 基因免疫
www.cmbp.net.cn 中国医药生物技术, 2012, 7(4):270-275
基因免疫不仅能诱导细胞免疫应答的发生还能诱导机体产生一定程度的体液免疫反应,为包括病毒性疾病在内的传染病的免疫预防以及肿瘤的免疫治疗提供了一条新的途径[1-3]。然而,在某些病毒性感染的免疫预防中能否诱导机体高水平的体液免疫应答、产生高效价的保护性抗体是成功预防的关键,例如在人乳头瘤病毒(human papillomavirus,HPV)感染的预防中,针对 HPVL1 蛋白的体液免疫反应发挥重要作用。此外,基因免疫方法的出现无疑也为蛋白和肽类抗原抗体的制备提供了一种新的技术路线,但是,基因免疫虽能高效诱导功能性 CD8+CTL 应答,而诱导的体液免疫应答水平却通常有限[4],这成为严重制约基因疫苗在预防免疫中应用的最大障碍之一。因此,研究不同因素对基因免疫应答的影响,提高基因免疫诱导的体液免疫应答水平,无论是对基因疫苗能否成功用于感染性疾病的免疫预防还是通过基因免疫途径制备高效价抗体均具有十分重要的理论和现实意义。
提高基因疫苗的免疫效果一直是基因疫苗研究的重要内容之一[5-7]。众多学者试图通过采用基因枪、电穿孔等不同的免疫途径和免疫佐剂以及优化表达载体的调控元件,或者在表达产物上游加入分泌性前导序列等方式,以期提高基因免疫所诱发的体液免疫应答水平,获得高效价的特异性抗体。但是,表达产物本身在细胞内的不同定位对基因免疫诱发的体液免疫应答水平的影响却知之甚少。本研究通过构建能表达不同细胞定位的 EGFPHPV16L1 融合蛋白和 EGFP-HPV16L1△NLS 融合蛋白的重组 pcDNA-EGFP-HPV16L1 和 pcDNAEGFP-HPV16L1△NLS 真核表达载体,研究表达产物在细胞内的不同定位对基因免疫诱导的体液免疫应答水平的影响。
1 材料与方法
1.1 材料
1.1.1菌株、载体和引物 pcDNA3.1(+) 真核表达载体购自美国 Invitrogen 公司;DH5α 菌株、CHO 细胞株以及 Sf-9 细胞株均为本室保存;pFB-EGFP-HPV16L1、pFB-EGFP-HPV16L1△NLS辅助表达载体和重组 Bac/B-EGFP 杆状病毒由本室杨军博士构建并保存。EcoR V、XhoI 限制性内切酶购自宝生物(大连)公司;HRP-IgG 购自丹麦DAKO 公司;PCR beads 购自美国 Phamasia 公司;ProBondTMColumn 树脂购自美国 Invitrogen公司。PCR 引物(表 1)由上海博亚生物技术有限公司合成。
1.1.2实验动物 选择 6 ~ 8 周龄健康 SPF 级近交系雌性 BALB/c 小鼠 18 只,由西安交通大学医学院实验动物中心提供,实验动物生产许可证号SCXK(陕)2007-001,实验动物使用许可证 SYXK(陕)2001-003。在 SPF 级实验动物饲养室饲养。
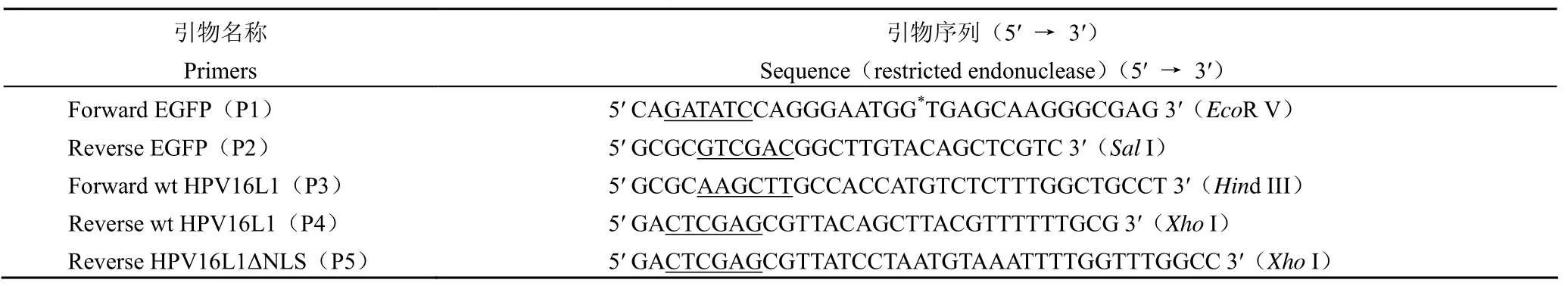
表1 PCR 引物Table 1 Sequences of oligonucleotide primers used in PCR experiments
1.2 方法
1.2.1重组 pcDNA 真核表达载体的构建 利用PCR 技术,用 P1 和 P4 引物从 pFB-EGFPHPV16L1 质粒中扩增 EGFP-HPV16L1 融合基因片段,用 P1 和 P5 引物从 pFB-EGFP-HPV16L1 △NLS 质粒中扩增截短型 EGFP-HPV16L1△NLS融合基因片段(删除编码 HPV16 L1 核定位序列的核苷酸片段 1447 ~ 1518 bp),并分别将其插入 pcDNA3.1(+) 真核表达载体多克隆酶切位点EcoR V 和XhoI 之间构建重组 pcDNA-EGFPHPV16L1 和 pcDNA-EGFP-HPV16L1△NLS 真核表达载体(图 1);以上重组载体经双酶切、PCR 及基因测序证实构建正确。用 Qiagen tip500 进行质粒的提取和纯化。紫外分光光度计测定质粒的A260和A280,进行 DNA 定量,终浓度调节至 100 μg/μl。同法制备 pcDNA3.1(+) 空质粒 DNA 作为对照。
1.2.2重组质粒转染 CHO 细胞 用含 10% 胎牛血清的 RP2MI1640 完全培养基培养 CHO 细胞。于转染前 18 h,将处于对数增长期的 CHO 细胞,以胰蛋白酶(2.5 g/L)消化传代。将 CHO 细胞均按每孔约为 2 × 105个细胞接种于 6 孔培养板中,至细胞密度大约为 60% 时,配置以下溶液:A 液(5 μl 重组的 pcDNA 质粒加入 95 μl 灭菌去离子水)与 B 液(6 μl Cellfectin 加入 94 μl 灭菌去离子水)轻轻混匀,室温放置 30 min;用无血清、无抗生素的 RPMI1640 培养基洗涤细胞 3 次后,逐滴加入 AB 混合液,培养 10 h 后更换完全培养基共培养 3 d,具体方法参照 Invitrogen 公司cellfectin 操作手册。倒置荧光显微镜下观察 EGFP标记的融合蛋白的表达。
1.2.3重组质粒免疫动物 BALB/c 小鼠随机分为 3 组,每组 6 只。分别为 I 组:pcDNA-EGFPHPV16L 重组表达载体免疫组;II 组:pcDNAEGFP-HPV16L1△NLS 重组表达载体免疫组;III组:pcDNA3.1 空质粒免疫组,进行双侧股四头肌肌肉注射免疫。用 0.25% 布比卡因(50 μl/只)行双侧股四头肌肌肉注射以提高肌肉摄取质粒 DNA的能力,72 h 后开始免疫,DNA 量为每侧肢体100 μg,每只鼠总量 200 μg。间隔 2 周免疫一次,共 3 次。每次免疫前尾静脉采血,末次免疫后第14 天眼球后取血并脱颈处死动物。
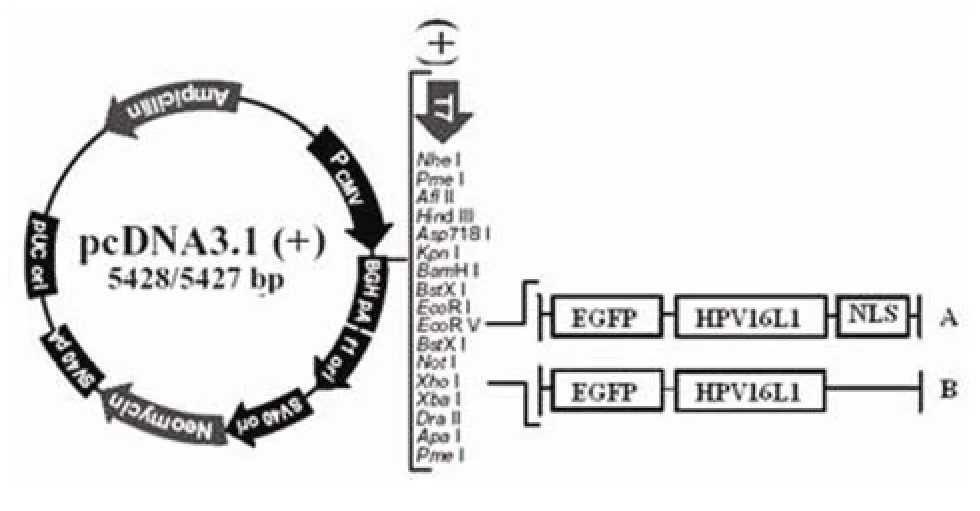
图1 重组 pcDNA 真核表达载体的构建Figure 1 Schematic map of pcDNA expression plasmids with various EGFP tagged insert of deletion mutants of HPV16L1
1.2.4ELISA 法检测血清抗体 在 35 mm 培养皿中 27 ℃ Grace′s 完全培养液培养 Sf-9 细胞至80% 融合时,更换含 2% 胎牛血清的 Grace′s 培养液,加入 400 μl 重组 EGFP 杆状病毒[8]共培养72 h 收集培养上清,倒置荧光显微镜观察 EGFP的表达,用 ProBondTMColumn 树脂非变性法纯化EGFP 蛋白并定量,具体方法参照 Gibco 公司Bac-to-Bac 杆状病毒表达系统操作手册。用纯化的EGFP 蛋白包被 96 孔酶标,每孔加 EGFP 蛋白0.1 μg,置湿盒中,37 ℃,孵育 1 h 后置 4 ℃ 过夜;5% 脱脂奶封闭,37 ℃,2 h;抗血清 1∶100 稀释倍后,100 μl/孔加入抗原孔,每份样品均设 3 个平行样,同时设空白组。37 ℃,孵育 2 h,TBST 洗板,3 × 5 min;加入 1∶5000 稀释的羊抗鼠二抗(IgG-HRP)100 μl,37 ℃ 孵育 1 h,TBST 洗板,3 × 5 min;加入底物液 100 μl 显色,1 mol/L H2SO4终止反应。酶标自动分析仪 450 nm 波长测其吸光度(A值),比较组间A值的差异。
1.3 统计学方法
应用 SPSS 10.0 统计学软件,采用t检验进行统计学分析。P< 0.05 为差异统计学意义。
2 结果
2.1 重组 pFast-Bac 辅助表达载体的构建
1% 琼脂糖电泳检测,重组 pcDNA-EGFPHPV16L1 和 pcDNA-EGFP-HPV16L1△NLS 真核表达载体,大小与理论值一致(图 2)。PCR 及双酶切鉴定发现重组 pcDNA3.1 表达载体构建成功。
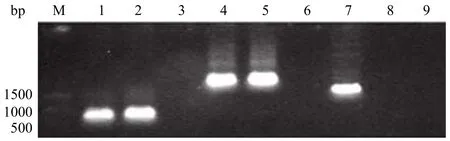
图2 PCR 法鉴定重组 pcDNA-EGFP-HPV16L1 和pcDNA-EGFP-HPV16L1△NLS 质粒中的融合基因Figure 2 Identification of recombinant pcDNA-EGFPHPV16L1 and pcDNA-EGFP-HPV16L1△NLS plasmids by PCR
2.2 重组质粒转染 CHO 细胞
用重组 pcDNA-EGFP-HPV16L1 和 pcDNAEGFP-HPV16L1NLS △真核表达载体转染 CHO细胞,倒置荧光显微镜下观察发现:在重组pcDNA-EGFP-HPV16L1 真核表达载体转染的CHO 细胞内,绿色荧光集中于细胞核内;而在重组 pcDNA-EGFP-HPV16L1NLS △真核表达载体转染的 CHO 细胞内,绿色荧光滞留于细胞质内,CHO 细胞核内无绿色荧光(图 3)。
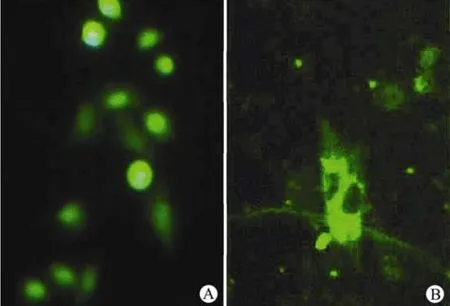
图3 重组 pcDNA-EGFP-HPV16L1 和 pcDNA-EGFPHPV16L1△NLS 真核表达载体在 CHO 细胞中的表达Figure 3 Photographic images of CHO cells transfected with indicated expression vectors pcDNA-EGFP-HPV16L1 or pcDNA-EGFP-HPV16L1△NLS for EGFP-HPV16L1 or truncated EGFP-HPV16L1△NLS protein expression, respectively
2.3 ELISA 法检测血清抗体
ELISA 结果发现,用重组 pcDNA3.1 真核表达载体免疫小鼠,能够诱导小鼠产生特异性 IgG抗体,且用酶标仪 450 nm 波长检测其抗体吸光度发现,随着免疫次数的增加,血清抗体吸光度随之升高,同时,免疫 3 次之后,重组 pcDNA-EGFPHPV16L1△NLS 真核表达载体免疫组小鼠血清IgG 吸光度显著高于重组 pcDNA-EGFP-HPV16L真核表达载体免疫组小鼠血清 IgG 吸光度(P<0.001)(图 4)。

图4 重组 ELISA 分析 pcDNA3.1 诱发的特异性 IgG抗体水平(5% 误差线)Figure 4 Anlalysis of specific IgG antibodies level in the sera from mice immunized with the recombinant pcDNA3.1 plasmids as indicated by ELISA (5% error line)
3 讨论
DNA 疫苗在宿主体内表达的过程与自然过程相似,以自然的形式被加工,并以天然构象提呈给宿主的免疫识别系统,这种蛋白的空间结构接近天然构型,抗原性强,且不存在抗原表位改变或丢失的情况以及蛋白纯化的问题,同时,DNA 疫苗具有免疫原的单一性,只有编码所需抗原的基因被导入细胞得到表达,才能增强特异性免疫应答,在很大程度上降低了非特异性免疫应答的发生。此外,DNA 疫苗具有能长时间诱导机体的免疫应答的优点。此前认为,虽然 DNA 疫苗能高效诱导或产生功能性 CD8+CTL应答,但通常只能诱导微弱的体液免疫应答。因此,提高 DNA 免疫诱导的体液免疫水平具有重要意义。
人乳头瘤病毒 16 型 L1 蛋白(human papillomavirus 16 type L1 protein,HPV16 L1)是HPV16衣壳的主要结构蛋白,其羧基端具有 2 个经典的 NLS:单组分 NLS(499KRKKRK)和包含单组分NLS 的双组分 NLS(484KRKatpttsststta499K RKKRK)[9],在 HPV 生命周期中 L1 蛋白先后两次被转运入细胞核内参与病毒的成功感染和子代病毒的顺利组装[10-11],其所诱导的中和抗体对HPV16 感染具有保护作用。因此,研究 L1 蛋白对 DNA 疫苗所诱发的体液免疫应答水平的影响、制备抗 L1 蛋白的特异性抗体对于预防 HPV 感染具有重要意义。
本研究利用分子生物学技术和荧光标记技术,分别获得增强型绿色荧光蛋白(enhance green flurenscent protein, EGFP)基因[12-14]标记的全长HPV16L1 基因(包含 HPV16L1 NLS)和删除HPV16L1基因 3′ 端 NLS(1447-1518 bp)的截短型 HPV16L1△NLS 基因,并将其重组入 pcDNA3.1真核表达载体,获得 pcDNA-EGFP-HPV16L1 和pcDNA-EGFP-HPV16L1△NLS 重组真核表达载体。在本研究组前期研究 HPV16L1 核浆运输的动力学过程中业已证实位于 HPV16L1 蛋白羧基端NLS 的 23 个氨基酸(484GKRKATPTTSSTSTTAK RKKRKL506)具有完全核定位作用,能引导 HPV16 L1 蛋白和 EGFP 突破核膜屏障进入 Sf-9 昆虫细胞核内,而无 NLS 标记的 EGFP 的绿色荧光均匀分布于 Sf-9 细胞质和细胞核内,而 EGFPHPV16L1△NLS 蛋白的绿色荧光局限于 Sf-9 细胞质内。在此基础上,在本研究中发现重组pcDNA-EGFP-HPV16L1 真核表达载体表达的携带HPV16L1 NLS 的 EGFP-HPV16L1 融合蛋白能在被表达之后顺利转运入 CHO 细胞核内,而由重组pcDNA-EGFP-HPV16L1△NLS 真核表达载体表达的删除 HPV16L1 NLS 的截短型 EGFPHPV16L1△NLS 融合蛋白在被表达之后却一直滞留于 CHO 细胞质内,说明 HPV16L1 NLS 具有核定位功能,且 NLS 决定了表达产物的最终亚细胞定位(图 3)。
本研究采用肌肉注射方式分别将 pcDNAEGFP-HPV16L1 和 pcDNA-EGFP-HPV16L1△NLS重组真核表达载体注射入小鼠股四头肌内,并用昆虫杆状病毒表达系统表达的 EGFP 蛋白作为抗原包被酶标板,通过 ELISA 方法检测 IgG 抗体A450,结果发现,虽然上述两种重组真核表达载体均可诱发机体体液应答反应,产生相应的抗-EGFP抗体,但是重组 pcDNA-EGFP-HPV16L1△NLS 真核表达载体所诱发的体液免疫应答水平显著高于重组 pcDNA-EGFP-HPV16L1 真核表达载体所诱发的体液免疫应答水平(P< 0.01)。可见,具有相似氨基酸组成和蛋白结构的蛋白产物,由于表达后蛋白产物的不同亚细胞定位可对基因免疫诱导的体液免疫应答水平产生显著影响,删除 NLS 的蛋白由于滞留于宿主细胞质内而诱发更强的体液免疫反应,这可能与细胞质内蛋白分子较细胞核内蛋白分子更容易被释放到组织间隙而被抗原提呈细胞捕获、加工并提呈给 CD4+T 细胞,诱发特异性体液免疫应答反应的缘故。
此前,Fan 等[15]研究已证实分泌性蛋白较膜锚定蛋白、细胞质内蛋白和核定位蛋白而言,能诱发更强的体液免疫反应。虽然本研究只观察了细胞质内蛋白和核定位蛋白对体液免疫反应的影响,但也证实细胞质内蛋白较核定位蛋白更易诱发强的体液免疫反应。可见,表达产物的细胞内定位对于基因免疫诱发的体液免疫反应具有显著影响。因此,在设计以诱发体液免疫为目的的基因免疫载体时,应考虑到表达产物在宿主细胞内的亚细胞定位,对其进行适当改造,使其易于暴露并被机体免疫系统识别,将有利于诱发高水平体液免疫应答反应,这对于基因疫苗的研制和基于基因免疫的特异性抗体的制备具有一定的指导作用。
[1] Soleimanjahi H, Roostaee MH, Rasaee MJ, et al. The effect of DNA priming-protein boosting on enhancing humoral immunity and protecting mice against lethal HSV infections. FEMS Immunol Med Microbiol, 2006, 46(1):100-106.
[2] Doria-Rose NA, Haigwood NL. DNA vaccine strategies: candidates for immune modulation and immunization regimens. Methods, 2003, 31(3):207-216.
[3] Ferraro B, Morrow MP, Hutnick NA, et al. Clinical applications of DNA vaccines: current progress. Clin Infect Dis, 2011, 53(3):296-302.
[4] Han R, Reed CA, Cladel NM, et al. Intramuscular injection of plasmid DNA encoding cottontail rabbit papillomavirus E1, E2, E6 and E7 induces T cell-mediated but not humoral immune responses in rabbits. Vaccine, 1999, 17(11-12): 1558-1566.
[5] Connolly RJ, Rey JI, Lambert VM, et al. Enhancement of antigen specific humoral immune responses after delivery of a DNA plasmid based vaccine through a contact-independent helium plasma. Vaccine, 2011, 29(39):6781-6784.
[6] Gorres JP, Lager KM, Kong WP, et al. DNA vaccination elicits protective immune responses against pandemic and classic swine influenza viruses in pigs. Clin Vaccine Immunol, 2011, 18(11):1987-1995.
[7] Gravekamp C. The impact of aging on cancer vaccination. Curr Opin Immunol, 2011, 23(4):555-560.
[8] Yang J, Wang YL, Si LS. The dynamic process of of HPV16L1 nucleocytoplasmic transport. Acta Microbiol Sinica, 2006, 46(6):917-921. (in Chinese)杨军, 王一理, 司履生. HPV16L1核浆运输的动力学过程. 微生物学报, 2006, 46(6):917-921.
[9] Touzé A, Mahé D, El Mehdaoui S, et al. The nine C-terminal amino acids of the major capsid protein of the human papillomavirus type 16 are essential for DNA binding and gene transfer capacity. FEMS Microbiol Lett, 2000, 189(1):121-127.
[10] Nelson LM, Rose RC, Moroianu J. Nuclear import strategies of high risk HPV16 L1 major capsid protein. J Biol Chem, 2002, 277(26): 23958-23964.
[11] Schäfer F, Florin L, Sapp M. DNA binding of L1 is required for human papillomavirus morphogenesis in vivo. Virology, 2002, 295(1): 172-181.
[12] Yang F, Moss LG, Phillips GN Jr, et al. The molecular structure of green fluorescent protein. Nat Biotechnol, 1996, 14(10):1246-1251.
[13] Chalfie M, Tu Y, Euskiechen G, et al. Green fluorescent protein as a marker for gene expression. Science, 1994, 263(5148):802-805.
[14] Skosyrev VS, Rudenko NV, Yakhnin AV, et al. EGFP as a fusion partner for the expression and organic extraction of small polypeptides. Protein Expr Purif, 2003, 27(1):55-62.
[15] Fan H, Xiao S, Tong T, et al. Immunogenicity of porcine circovirus type 2 capsid protein targeting to different subcellular compartments. Mol Immunol, 2008, 45(3):653-660.
Effects o f intrace llular localiz ation of pr oteins expr essed by DNA vaccines on humoral immunity response upon DNA immunization
YANG Jun, CHEN Xiao-li, WANG Yi-li, SI Lü-sheng
ObjectiveTo analyze whether different intracellular location of expressed proteins may affect humoral immunity response upon DNA immunization.MethodsEGFP-HPV16 L1 and EGFP-HPV16L1△NLS fusion genes were amplified from pFB-EGFP-HPV16L1 and pFB-EGFP-HPV16L1△NLS plasmid, respectively, then were recombined into pcDNA3.1(+) vector to generate recombinant pcDNA-EGFP-HPV16L1 and pcDNA -EGFP-HPV16L1△NLS plasmid, respectively. The recombinant plasmids were transfected into CHO cells and fluorescences of EGFP tagged fusion proteins were observed under fluorescent microscope. The recombinant plasmids were subsequently injected into the tibial muscles to immunize BALB/c mices and titers of the antisera were determined using ELISA.ResultsThe EGFP-HPV16 L1 and EGFP-HPV16L1△NLS were correctly inserted into pcDNA3.1 (+) vectors. EGFP-HPV16 L1 fusion protein could be detected in the nucleus of CHO cells, while the EGFP-HPV16L1△NLS fusion protein was located in the cytoplasm of CHO cells. The two recombinant plasmids could induce humoral immunity response in BALB/c mices. After three times of immunization, the A450values of antisera of pcDNA -EGFP-HPV16L1△NLS plasmid immunized mices group were higher than that of recombinant pcDNA-EGFP-HPV16L1immunized mices group (P < 0.001).ConclusionIntracellular localization of the proteins expressed by DNA vaccines could affect humoral immunity response upon DNA immunization. Proteins localized in the cytoplasm could induce stronger humoral immunity response compared with proteins localized in the nucleus upon DNA immunization. The conclusion is very useful to design DNA vaccine to induce stronger humoral immunity response or to produce antibody upon DNA immunization.
Antibody formation; Immunotherapy; Nuclear location signal; DNA immunization
YANG Jun, Email: yangjundr@yahoo.com.cn
10.3969/cmba.j.issn.1673-713X.2012.04.004
国家自然科学基金(30300305);教育部“新世纪优秀人才支持计划”(NCET-10-0647);教育部博士点新教师基金(2007-0698106)
710004 西安交通大学医学院第二附属医院病理科(杨军、陈晓黎);710061 西安交通大学生命科学与技术学院癌症研究所,生物医学信息工程教育部重点实验室(王一理、司履生)
杨军,Email:yangjundr@yahoo.com.cn
2012-03-12
方法利用分子克隆技术,分别构建能表达不同细胞定位的EGFP-HPV16L1 融合蛋白和截短型 EGFP-HPV16L1△NLS融合蛋白的重组 pcDNA-EGFP-HPV16L1 和 pcDNA-EGFPHPV16L1△NLS 真核表达载体;通过转染 CHO 细胞,并在倒置荧光显微镜下观察表达产物的细胞定位;用重组pcDNA 载体免疫 BALB/c 小鼠;EGFP 作为抗原,ELISA法检测血清抗体吸光度。
结果①重组 pcDNA-EGFP-HPV16L1 转染的CHO细胞核内可见到绿色荧光,pcDNA-EGFP-HPV16L1△NLS 真核表达载体转染的 CHO 细胞质内可见到绿色荧光;②两种不同的重组 pcDNA 载体均可诱导 BALB/c 小鼠体液免疫反应,但重组 pcDNA-EGFP-HPV16L1△NLS 真核表达载体免疫组小鼠 IgG 抗体 A450值显著高于重组pcDNAEGFP-HPV16L1 真核表达载体免疫组小鼠 IgG 抗体 A450值(P < 0.001)。
结论表达产物的不同细胞定位可影响基因免疫诱发的体液免疫应答水平,定位于细胞质内的蛋白分子较定位于细胞核的蛋白分子能诱导机体更强的体液免疫反应,这为以增强体液免疫反应为目的的基因疫苗的设计提供了参考。
Author Affiliations:The Second Hospital, College of Medicine, Xi′an Jiaotong University, Xi′an 710004, China (YANG Jun, CHEN Xiao-li,); The Key Laboratory of Biomedical Information Engineering of Ministry of Education, Institute for Cancer Research, School of Life Science & Technology, Xi′an Jiaotong University, Xi′an 710061, China (WANG Yi-li, SI Lü-sheng)
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(4):270-275
