蠕虫NADH-延胡索酸还原酶模型优化及沃特曼内酯F的活性评价
2012-04-13李原刘文财孙文龙董悦生阎浩林
李原,刘文财,孙文龙,董悦生,阎浩林
·论著·
蠕虫NADH-延胡索酸还原酶模型优化及沃特曼内酯F的活性评价
李原,刘文财,孙文龙,董悦生,阎浩林
目的优化蠕虫 NADH-延胡索酸还原酶及哺乳动物NADH 氧化酶的高通量筛选模型,评价沃特曼内酯 F 的活性及选择性。
抗蠕虫药; 电子传递复合物 I; NADH 氧化酶; 沃特曼内酯 F
www.cmbp.net.cn 中国医药生物技术, 2012, 7(4):276-280
蠕虫和哺乳动物的呼吸能量代谢系统的差异是发现新的抗蠕虫药物的热点[1]。蠕虫线粒体呼吸链电子传递系统的 NADH-延胡索酸还原酶(NFRD,EC 1.3.1.6),由 complex I 和 complex II组成[2]。该酶系将电子传递给complex I,并经过深红醌传递给complex II,同时催化延胡索酸生成琥珀酸。而哺乳动物不含该酶系,相对应的酶系为NADH-氧化酶(EC 1.6.99.3),由 complex I、III 和IV 组成。目前已经发现的 NFRD 抑制剂有nafuredin[3],ukulactone A、B[4]等,但对蠕虫 NFRD和哺乳动物 NADH-氧化酶模型的条件优化未见报道。沃特曼内酯是本课题组从邬氏黄丝曲霉(Talaromyces. wortmannii)F01Z0195 中分离得到一类新化合物[5-6],与 ukulactone 类化合物结构相近,本研究旨在优化蠕虫 NFRD 评价模型并评价沃特曼内酯 F 的选择性抑制活性。
1 材料与方法
1.1 材料
1.1.1试剂 猪蛔虫和猪心均采自大连肉联厂;沃特曼内酯 F 本实验室自制;NaH2PO4、葡萄糖购自天津大茂化学试剂厂;NaCl、Na2HPO4·12H2O 购自国药集团化学试剂有限公司;Tris-HCl、EDTA-2Na、NADH·2Na 购自中国北京Solarbio 公司;蔗糖购自天津市福晨化学试剂厂。
1.1.2仪器 全波长扫描荧光酶标仪 Varioscan Flash IX71/IX51 为美国 Thermo Fisher Scientific公司产品;离心机 SORVALL 为德国 Biofuge Stratos 产品;榨汁机 MSL-2008A 为成都每时乐电器有限公司产品;PB-10 型 pH 计为德国 Sartotius公司产品。
1.2 方法
1.2.1线粒体提取 首先线粒体提取均在冰浴中进行,446.3 g 猪蛔虫用 0.15 mol/L 的 KCl 溶液浸泡,除去内脏后的质量为 337.8 g,用 500 ml的冰冻匀浆介质(pH 7.40,0.01 mol/L Tris-HCl,0.0001 mmol/L EDTA-2Na,0.01 mol/L 蔗糖,0.8% NaCl 溶液)浸泡并用榨汁机榨汁成浆状,再加入1500 ml 的冰冻匀浆介质搅拌均匀。纱布过滤除去膜状物质,在 3588.8 × g、4 ℃ 条件下离心 15 min,弃去沉淀;上清液在 17944 × g、4 ℃ 条件下离心15 min,收集沉淀物弃去上清液。沉淀物即线粒体,用时加入 0.12 mol/L 的磷酸钠溶液(pH 7.0)配制成不同浓度的线粒体。
猪心用 0.15 mol/L 的 KCl 溶液浸泡,除去结缔组织,得 145.9 g 猪心肌肉,线粒体提取方法同猪蛔虫线粒体。
1.2.2最佳反应条件确定 蠕虫 NFRD 最佳反应温度的考察实验,按照如下方法进行:170 μl 磷酸盐缓冲液(0.12 mol/L,pH 7.0)包含 0.35 mmol NADH,7.2 mmol 延胡索酸二钠,加入 10 μl DMSO溶液,放入 96 孔板中振荡 3 min,反应以加入20 μl 0.125 g/ml 的线粒体液开始。分别在 34、37、40 ℃,保温 3 min 后,在相应温度下,在 340 nm处每 15 秒测定一次吸光值,共 10 min。以吸光值-时间直线回归的斜率反应 NADH 变化率。
反应最佳 pH 值的考察实验在反应温度为37 ℃ 下进行,缓冲液 pH 值为 6.0、6.5、7.0、7.5、8.0,其余方法同上。
最适 NADH 浓度考察实验在 37 ℃ 下进行,NADH 终浓度为 0.09、0.13、0.18、0.26、0.35 mmol/L,其余方法同最佳温度考察实验。
最适线粒体浓度的考察实验在 37 ℃ 下进行,线粒体的终浓度为 0.003、0.006、0.013、0.025、0.038、0.050 g/L,其余方法同最佳温度考察实验。
猪心 NADH 氧化酶模型的优化的参数同猪蛔虫 NFRD 模型,也为温度、pH、NADH 及线粒体浓度优化参数。
1.3 活性测定
1.3.1猪蛔虫 NADH 延胡索酸还原酶活性测定 在优化的条件下进行,在 37 ℃ 下,120 μl磷酸盐缓冲液(0.12 mol/L,pH 6.5)包含由DMSO 溶解的沃特曼内酯 F 10 μl(终浓度依次为6244.30、1248.82、249.76、49.95、9.99、2.00,0.40 和 0.08 nmol/L),0.35 mmol/L NADH 10 μl 和72 mmol/L 溶于磷酸盐缓冲液(0.12 mol/L,pH 6.5)延胡索酸二钠 20 μl,加入溶于 40 μl 0.125 g/ml 的猪蛔虫线粒体液开始,在 340 nm 处每 15 秒测定吸光值,共 10 min。对照组不加入沃特曼内酯 F 样品,加入 10 μl DMSO 溶液;空白组不加入线粒体溶液,补以 40 μl 缓冲液。每个样品做 4 个平行。
抑制率的计算公式[4]为:
抑制率(%)= [1 -(A样品孔slope -A未加酶孔slope)/(A对照孔slope -A未加酶孔slope)] × 100,其中Aslope 为 340 nm 处吸光值的变化曲线斜率。
1.3.2猪心 NADH 氧化酶活性测定 140 μl 磷酸盐缓冲液(0.12 mol/L,pH 6.5)包含 0.35 mmol/L NADH 10 μl,加入 10 μl DMSO 溶解的沃特曼内酯,放入 96 孔板中振荡 3 min,反应以加入 40 μl 0.125 g/ml 的猪心线粒体液起始。37 ℃,340 nm 处每隔 15 秒测定一次吸光度值,共 10 min。沃特曼内酯 F 浓度同1.3.1。对照组不加入沃特曼内酯 F样品,加入 10 μl DMSO 溶液;空白组不加线粒体,补以 40 μl 缓冲液。每个样品做 4 个平行。抑制率计算方法同上。
2 结果
2.1 反应最适温度的确定
反应温度对猪蛔虫 NFRD和猪心 NADH 氧化酶模型均有影响,其中对猪蛔虫 NFRD 模型影响更大一些,37 ℃,340 nm 的OD变化量最大(见图 1),表明在该温度下猪蛔虫 NFRD 和猪心NADH 氧化酶的活性最高,并按照 34 ℃、40 ℃ 依次降低,提示 37 ℃ 为猪蛔虫 NFRD 和猪心NADH 氧化酶模型最适温度,条件优化均在 37 ℃下进行。

图1 反应温度对猪蛔虫 NFRD 和猪心 NADH 氧化酶模型的影响Figure 1 The influence of the temperature onAscaris suumNFRD and pig heart NADH oxidase model
2.2 猪蛔虫 NFRD 模型的条件优化
2.2.1pH 影响 pH 值对猪蛔虫 NFRD 模型影响比较明显(图 2),pH 6.0 是 340 nm处OD变化量只有 0.005 OD/s,表明在该 pH 下,酶活性降低。随着 pH 值提高,单位时间内OD变化量明显提高,其中 pH 6.5 时,OD变化达到了最大值0.02 OD/s。提示在该 pH 下酶活力最高,随着 pH进一步升高,在 pH 7.0、7.5、8.0 条件下,单位时间内OD变化值依次下降,因此 pH 6.5 为反应最适 pH 值。
2.2.2NADH 浓度影响 随着 NADH 浓度的增加,单位时间内OD值变化量有逐渐增大的趋势(图 3),在 NADH 浓度达到 0.18 mmol/L 时,OD变化值可以达到 0.02 OD/s以上,继续增加NADH 添加量虽然可以提高OD值变化量,但此时体系OD值也增加到了 1.4 以上,易使测定产生偏差。为了测定的准确性,并保持本模型和猪心NADH 氧化酶活性测定中的主要条件一致性,本模型选择 0.18 mmol/L 为最优 NADH 浓度。
2.2.3线粒体浓度影响 随着线粒体浓度的增加,OD值变化量也显示逐渐增大趋势(图 4),但同时活性测定体系中的OD值也有逐渐增加的趋势,线粒体浓度为 0.025 g/L 时,能同时保证较大的OD变化量和较低OD值,综合考虑猪蛔虫 NFRD 和猪心 NADH 氧化酶的结果,确定0.025 g/L 为最佳线粒体浓度。

图2 pH 值对猪蛔虫 NFRD 模型的影响Figure 2 The influence of pH onAscaris suumNFRD model
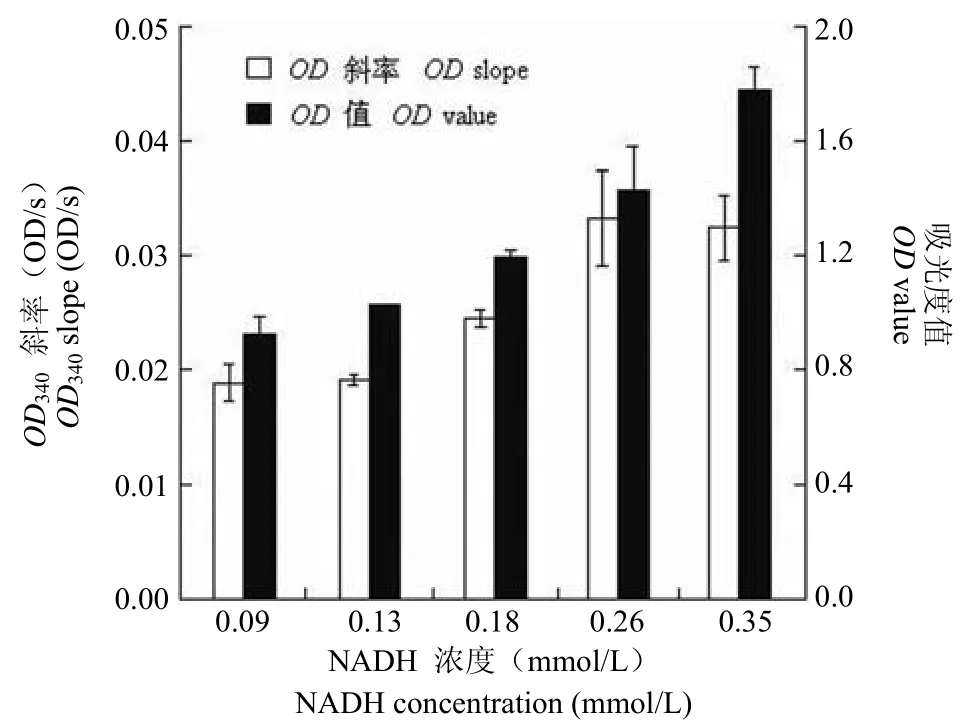
图3 NADH 浓度对猪蛔虫 NFRD 模型的影响Figure 3 The influence of NADH concentration onAscaris suumNFRD model

图4 线粒体浓度对猪蛔虫 NFRD 模型的影响Figure 4 The influence of mitochondrial concentration onAscaris suumNFRD model
2.3 猪心 NADH 氧化酶模型的条件优化
2.3.1pH 影响 pH 值对猪心 NADH 氧化酶模型影响也比较明显(图 5),pH 6.0 时,340 nm处单位时间内OD值变化量为 0.02 OD/s,酶活力最低;pH 6.5 时,OD值变化量达到了最大值0.035 OD/s,酶活力最高;随着 pH 进一步升高,在 pH 7.0、pH 7.5、pH 8.0 条件下,酶活力又有所下降,但仍高于 pH 6.0 时的酶活力。因此,pH 6.5为反应最适 pH 值。
2.3.2NADH 浓度影响 随着 NADH 浓度的增加,单位时间内OD值变化量有逐渐增大的趋势(图 6),但当浓度达到 0.26 mmol/L 后,OD值变化又降低。在 NADH 浓度达到 0.18 mmol/L时,OD变化值可以到达 0.025 OD/s,为最高值,因此本模型选择 0.18 mmol/L 为最优 NADH 浓度。
2.3.3线粒体浓度影响 随着线粒体浓度的增加OD值变化量也显示逐渐增大趋势(图 7),但同时活性测定体系中的OD值也有逐渐增加的趋势,线粒体浓度为 0.025 g/L 时,能同时保证较大的OD变化量和较低OD值,确定 0.025 g/L 为最佳线粒体浓度。
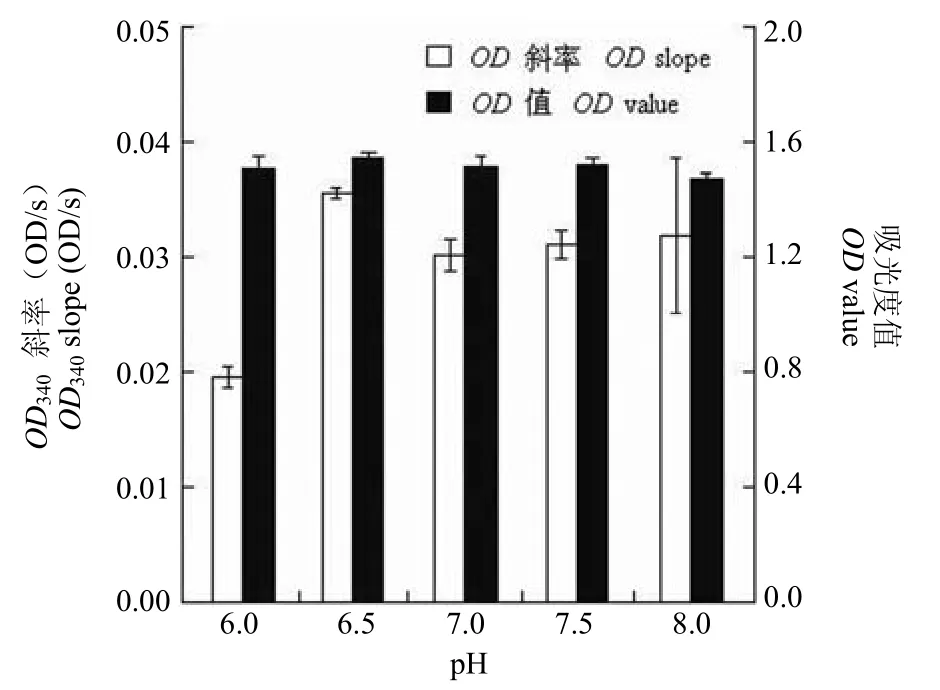
图5 pH 值对猪心 NADH 氧化酶模型的影响Figure 5 The influence of pH on pig heart NADH oxidase model
2.4 沃特曼内酯 F 对猪蛔虫 NFRD 和猪心 NADH氧化酶抑制活性评价
采用优化的反应条件分别测定了沃特曼内酯 F 对猪蛔虫 NFRD 和猪心NADH 氧化酶的抑制活性,在 37 ℃,pH 6.5,NADH 浓度为0.175 mmol/L,线粒体浓度为 0.025 g/L 条件下,沃特曼内酯 F 对 NFRD 的 IC50为 5.0 nmol/L(图 8),而对于猪心 NADH 氧化酶在 6.2 μmol/L浓度下,抑制活性尚低于 50%。以上结果表明沃特曼内酯 F 和 Ukulactone A 具有相当的抑制活性(图 9),均到了 nmol/L 级,而对哺乳动物相对应的 NADH 氧化酶活性较低,是一个高活性、高选择性的蠕虫 NFRD 抑制剂。

图6 NADH 浓度对猪心 NADH 氧化酶模型的影响Figure 6 The influence of NADH concentration on pig heart NADH oxidase model

图7 线粒体浓度对猪心 NADH 氧化酶模型的影响Figure 7 The influence of mitochondrial concentration on pig heart NADH oxidase model

图8 沃特曼内酯 F 对 NADH-延胡索酸还原酶的抑制率Figure 8 The inhibition of wortmaniilactone F on NADH-fumarate reductase
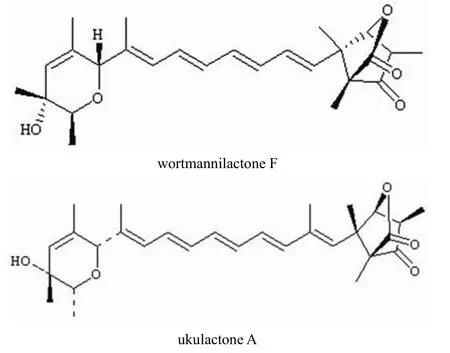
图9 沃特曼内酯 F 和 ukulactone A 的结构比较Figure 9 The comparison of wortmannilactone F and ukulactone A
3 讨论
蠕虫的厌氧呼吸过程和哺乳动物的有氧呼吸过程有明显的区别,同为呼吸链重要组成酶的complex I 和 II 在蠕虫和哺乳动物中所起的作用有明显的不同,在蠕虫的厌氧呼吸过程中 NADH失去电子后成为 NAD+,产生的电子由 complex I传递给深红醌,再由深红醌经 complex II 传递给延胡索酸,延胡索酸转化为琥珀酸,进而转化为挥发酸类,在此过程中 complex I 为 NADH-深红醌还原酶(NADH-rhodoquinone reductase),而 complex II 为深红醌-延胡索酸还原酶(rhodoquinonefumarate reductase)。而在哺乳动物的有氧呼吸过程中,主要通过三羧酸循环将琥珀酸转化为延胡索酸,电子经 complex II 传递给泛醌。同时 NADH失去电子后成为 NAD+,电子也通过 complex I (NADH-ubiquinone reductase)传递给泛醌,此过程中 complex I 为 NADH-泛醌还原酶(NADH-ubiquinone reductase),而 complex II 为琥珀酸-泛醌还原酶(succinate-ubiquinone reductase reductase)。接收了电子的泛醌再将电子经 complex III (ubiquinone-cytochorome c reductase)传递给细胞色素 C,细胞色素 C 再经 complex IV(cytochorome c oxidase)传递给 O2,O2转化为水;ADP 转化为 ATP,由 complex I、III、IV 组成的酶系被称为NADH 氧化酶[4]。本研究通过比较猪蛔虫 NFRD活性和猪心 NADH 氧化酶活性,可以反映出沃特曼内酯 F 组分对于蠕虫及其宿主氧化呼吸链中关键酶的选择性,这种选择性也是高效抗蠕虫药物的要求。
沃特曼内酯 F 与 ukulactone A 都含有较为新颖的母核二氢吡喃环和氧杂二环[2.2.1],同时两个基团有长链共轭烯键[5]。但研究表明 ukulactone 的两个已知组分 A 和 B,虽然只是在 2 位羟基构型有差别,活性则相差了 470 倍[1],沃特曼内酯 F 组分 2 位羟基构型和ukulactone A 相同,以上结果表明 2 位羟基对于该类化合物的抑制蠕虫 NFRD活性影响巨大,也为抗蠕虫药物的设计和开发提供了依据。沃特曼内酯类化合物具有高活性、高选择性的优点,具有开发成为新型抗蠕虫药物的潜能,其毒性评价、体内活性还需进一步研究。
[1] Masuma R, Shiomi K, Ōmura S, et al. Physiology and genetics. 1st ed. Berlin Heidelberg: Springer-Verlag, 2009:247-271.
[2] Kita K, Miyadera H, Saruta F, et al. Parasite mitochondria as a target for chemotherapy. J Health Sci, 2001, 47(3):219-239.
[3] Omura S, Miyadera H, Ui H, et al. An anthelmintic compound, nafuredin, shows selective inhibition of complex I in helminth mitochondria. Proc Natl Acad Sci U S A, 2001, 98(1):60-62.
[4] Mori M, Morimoto H, Kim YP, et al. Ukulactones A and B, new NADH-fumarate reductase inhibitors produced by Penicillium sp. FKI-3389. Tetrahedron, 2011, 67(35):6582-6586.
[5] Dong Y, Lin J, Lu X, et al. Cathepsin B inhibitory tetraene lactones from the fugus talaromyces wortmannii. Helv Chim Acta, 2009, 92(3):567-573.
[6] Yin ZY, Dong YS, Lu XH, et al. Optimization of cultural conditions of wortmannilactone F producing strain Talaromyces wortmannii F01Z0195. Chin J Antibiot, 2010, 35(12):903-910. (in Chinese)尹哲媛, 董悦生, 路新华, 等. Wortmannilactone F 产生菌邬氏黄丝曲霉 F01Z0195 的培养条件优化. 中国抗生素杂志, 2010, 35(12):903-910.
The optimization of helminth NADH-fumarate reductase model and the activity evaluation of wortmannilactone F
LI Yuan, LIU Wen-cai, SUN Wen-long, DONG Yue-sheng, YAN Hao-lin
ObjectiveTo optimize high throughput screening model of ascaris suum NADH-fumarate reductase and mammal NADH oxidase, and to evaluate the activity and the selectivity of wortmannilactone F using the two models.MethodAscaris suum and pig heart mitochondria were extracted, and then the parameters of the model, such as, temperature, pH, NADH concentration, mitochondrial concentration were optimized. The inhibititory activities of wortmannilactone F against ascaris suum NADH-fumarate reductase and pig heart NADH oxidase were also investigated under these optimum conditions.ResultsThese optimum conditions in ascaris suum NADH-fumarate reductase, such as, reaction temperature, pH, the NADH and mitochondrial concentration were 37 ℃, pH 6.5, 0.180 mmol/L and 0.025 g/L, respectively. The IC50of wortmannilactone F against ascaris suum NADH-fumarate reductase was 5.0 nmol/L, while the IC50against pig heart NADH oxidase was over 6.2 μmol/L.ConclusionWortmannilactone F shows selective inhibitory effect against ascaris suum NADH-fumarate reductase with IC50at nmol level and could be expected as a potential anti-helmintic compound.
Anthelmintics; Electron transport complex I; NADH oxidase; Wortmannilactone F
s:DONG Yue-sheng, Email: yshdong@dlut.edu.cn; YAN Hao-lin, Email: haolin-yan@163.com
10.3969/cmba.j.issn.1673-713X.2012.04.005
国家自然科学基金(81172966);微生物药物技术创新与新药创制产学研联盟(2010ZX09401-403)
110016 沈阳药科大学生命科学与生物制药学院(李原、阎浩林);116024 大连理工大学生命科学与生物技术学院(刘文财、孙文龙、董悦生)
董悦生,Email:yshdong@dlut.edu.cn;阎浩林,Email:haolin-yan@163.com
2012-04-01
方法提取猪蛔虫和猪心线粒体,对温度、pH、NADH 浓度和线粒体浓度等参数进行优化,确定最适宜反应条件。在最佳反应条件下测定沃特曼内酯 F对猪蛔虫 NADH-延胡索酸还原酶和猪心 NADH 氧化酶的抑制活性。
结果猪蛔虫 NADH-延胡索酸还原酶最佳反应条件为37 ℃,pH 6.5,NADH 浓度为 0.18 mmol/L,线粒体浓度为0.025 g/L。沃特曼内酯 F 的 IC50为 5.0 nmol/L;对于猪心NADH 氧化酶的 IC50大于 6.2 μmol/L。
结论沃特曼内酯 F 是一种选择性猪蛔虫 NADH-延胡索酸还原酶的抑制剂,抑制活性达到了 nmol/L 级,具有成为新型抗蠕虫药物的潜力。
Author Affiliations:School of Life Science and Biopharmaceutics, Shenyang Pharmaceutical University, Shenyang 110016, China (LI Yuan, YAN Hao-lin); School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, China (LIU Wen-cai, SUN Wen-long, DONG Yue-sheng)
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(4):276-280
