利用乙醇水溶液从含铁硫酸铝中除铁
2012-04-05吴成友余红发
吴成友,余红发
(1.中国科学院青海盐湖研究所,青海西宁810008;2.南京航空航天大学土木工程系;3.中国科学院研究生院)
利用乙醇水溶液从含铁硫酸铝中除铁
吴成友1,3,余红发1,2
(1.中国科学院青海盐湖研究所,青海西宁810008;2.南京航空航天大学土木工程系;3.中国科学院研究生院)
为了从硫酸铝中除铁,提出了利用乙醇水溶液对含铁硫酸铝进行除铁的工艺方法。研究了乙醇水溶液的pH、温度、振荡时间对除铁率的影响以及乙醇回收并循环使用的工艺方法。通过实验确定了最佳的工艺参数:乙醇水溶液的pH≤1,温度为25℃,振荡时间为2.5 h。经4级逆流除铁,硫酸铝的含铁质量分数可由0.98%降至0.005%以下。负载在乙醇水溶液中的铁经双氧水氧化、氨水沉淀、过滤并蒸馏至干后,乙醇回收率可达99.5%以上。本工艺具有操作简单、无污染、成本低等优点。
乙醇水溶液;除铁率;含铁硫酸铝
目前,中国硫酸铝生产大都采用硫酸浸出铝土矿的方法[1](少部分地区使用煤矸石[2]和高岭土[3]等)。由于铝土矿中含铁量很高,生产中也一般不会有专门的除铁工序,导致生产的硫酸铝含Fe量无法达到工业硫酸铝Ⅱ型的标准,而无法满足高档纸、食品添加剂的使用要求。硫酸铝除铁的主要方法有:重结晶[4]、有机萃取[5]、沉淀法[6]。笔者根据Al2(SO4)3、Fe2(SO4)3、FeSO4在不同浓度的乙醇水溶液中的溶解度差异,对由酸浸粉煤灰生产出的粗制硫酸铝进行除铁。
1 实验部分
1.1 试剂和原料
乙醇 (AR)、20%氨水 (工业级)、27.5%双氧水(工业级)、硫酸(AR)、EDTA标准溶液、邻菲啰啉(AR)、硫酸铜标准溶液(AR);自制含铁硫酸铝:w(Al2O3)=14.58%,w(Fe)=0.98%,pH(1%水溶液)为1.85,制备方法见文献[7]。
1.2 实验仪器和设备
国华SHA-C恒温振荡器、TGL-16M高速台式冷冻离心机、722可见分光光度计、GBC-908AA原子吸收光谱仪、X-pert PRO X射线衍射能谱仪。
1.3 实验方法
1.3.1 Al2(SO4)3、Fe2(SO4)3和FeSO4在乙醇水溶液中的溶解度测定
分别称取一定量分析纯的Al2(SO4)3、Fe2(SO4)3、FeSO4与确定体积的质量分数为0~80%的乙醇水溶液混合,放入振荡器中振荡48 h,固液分离后检测液相中的Al2O3、Fe2O3含量,最后计算出Al2(SO4)3、Fe2(SO4)3、FeSO4溶解度。
1.3.2 粗制硫酸铝的除铁实验
为了增大除铁时固液接触的面积,将自制的含铁硫酸铝研磨至150~250 μm,称取一定量的粗制硫酸铝与一定质量确定浓度的乙醇溶液混合,之后置于离心管中,放入振荡器中振荡0~5 h后离心分离。考察乙醇溶液的pH(采用1 mol/L硫酸调节)、温度、振荡时间对除铁率的影响。将固相烘干后测定其物相和成分。为了提高除铁率,采用4级逆流除铁方法。除铁率的计算公式为:
除铁率=mFe(aq)/mFe(total)×100
式中:mFe(aq)表示除铁后乙醇水溶液中的铁质量,g;
mFe(total)为粗制硫酸铝中的铁质量,g。
1.3.3 乙醇水溶液的回收实验
将第一级的除铁液体加入双氧水和氨水调节pH为4~7,过滤除去沉淀出的Fe(OH)3和Al(OH)3固体,将固相粘附的少量乙醇水溶液转移至烧瓶中,在75~90℃下蒸馏,将滤液和蒸馏出的馏分混合并循环使用。根据回收乙醇水溶液的密度值查阅手册计算出其质量分数。乙醇回收率计算公式为:
R=w2×m2/(w1×m1)×100
式中:R表示乙醇回收率,%;w1、w2分别表示除铁前后乙醇水溶液中乙醇的质量分数,%;m1、m2为除铁前后乙醇水溶液的质量,g。
1.3.4 Fe、Al2O3含量分析方法
Fe含量的分析采用分光光度法[8]测定,选择波长为510 nm;Al2O3采用铜盐返滴定法分析。
2 结果与讨论
2.1 Al2(SO4)3、Fe2(SO4)3和FeSO4在乙醇水溶液中的溶解度
测定振荡48h后Al2(SO4)3、Fe2(SO4)3和FeSO4的溶解度,结果见图1。由图1可见,Al2(SO4)3、Fe2(SO4)3和FeSO4在乙醇水溶液中的溶解度均随着乙醇浓度增加而减小。当乙醇质量分数高于10%时,Fe2(SO4)3和FeSO4的溶解度均比Al2(SO4)3大,加之粗制硫酸铝中Al2(SO4)3占主要成分,因此在选择乙醇浓度时,尽量选择Al3+溶解度较小时所对应的乙醇浓度。在乙醇质量分数为50%时,Al3+溶解度仅为0.3 g/L左右,Fe2+和Fe3+均高于5 g/L,因此,可以选择乙醇质量分数为50%的乙醇水溶液进行除铁。

图1 Al2(SO4)3、Fe2(SO4)3、FeSO4在不同乙醇水溶液中溶解度
2.2 粗制硫酸铝中单级除铁的影响因素
实验中为了增加固液接触面积,采用的50%乙醇水溶液的体积不宜过小,确定固液质量比为1∶2。
2.2.1 振荡时间对除铁率的影响
图2为振荡时间对硫酸铝除铁率的影响。结果表明,随振荡时间的延长,除铁率逐渐增加,当振荡时间为120 min时,除铁率为80.31%,继续延长时间除铁率增加很少,除铁率难以达到90%以上,这是由于实际操作中振荡时间不可能足够长,以及固相和液相不可能彻底分离。因此,可以将振荡时间定为120 min。
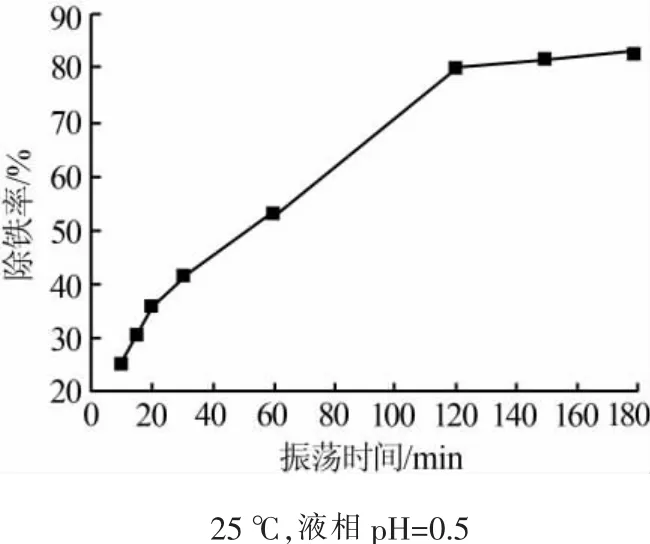
图2 振荡时间对除铁率的影响
2.2.2 液相pH对除铁率的影响
图3是液相pH对除铁率的影响。结果表明,随液相pH的逐渐减小,除铁率逐渐增加,当pH较高时(pH=4),除铁率偏小,原因是Fe在较高的pH下容易水解为不溶于乙醇水溶液的Fe(OH)3或者Fe(OH)2沉淀。因此,实际除铁工艺中建议液相pH≤1。
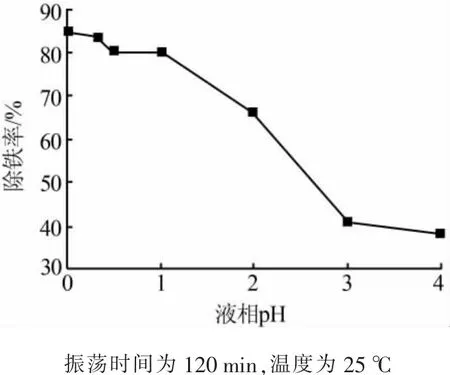
图3 液相pH对除铁率的影响
2.2.3 温度对除铁率影响
图4是温度对除铁率的影响。由图4可见,随着温度升高,除铁率呈现先增加后基本恒定的趋势,当温度为25℃时除铁率已经达到81%,温度至30℃时除铁率仅增加到83%,继续升高温度除铁率基本保持不变,因此,选择温度为25℃即可。
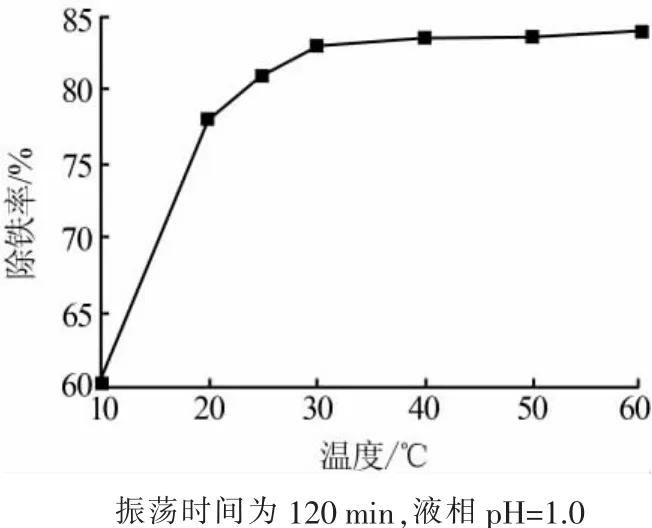
图4 温度对除铁率的影响
2.3 多级除铁制备无铁硫酸铝
为了得到低铁硫酸铝,根据单级除铁的影响因素,选定工艺条件为:振荡时间为2 h,液相pH=1.0,温度为25℃,对粗制硫酸铝进行4级逆流除铁。表1为实验结果。经过4级逆流除铁,硫酸铝中铁质量分数由0.98%降为0.0042%,Al2O3损失4.76%。
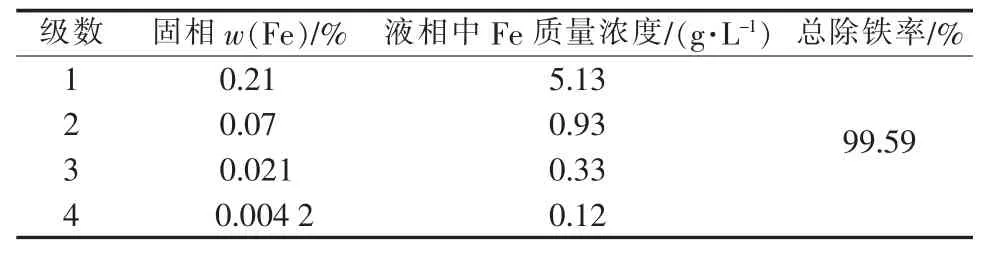
表1 多级除铁实验结果
2.4 低铁硫酸铝产品的XRD谱图和成分分析
图5为硫酸铝除铁后所得产品的XRD谱图,对照PDF卡片证实为Al2(SO4)3·12H2O的峰,且无其他杂质峰出现,证明其纯度较高。表2是其原子吸收成分分析结果,表明其组成完全符合低铁硫酸铝工业标准。

图5 低铁硫酸铝产品的XRD谱图

表2 固体原子吸收结果
2.5 乙醇回收
回收乙醇时,只回收第一级除铁后的乙醇水溶液。对于乙醇回收最直接的方式是蒸馏。但由于乙醇用量较多,如果直接蒸馏,不仅能耗较高,而且乙醇很难彻底回收。多级除铁实验结果表明,第一级除铁后的乙醇水溶液中Fe质量浓度仅为5.13 g/L,因此可以直接加入碱将Fe完全沉淀。Fe3+完全沉淀的pH为3.2,而Fe2+沉淀的溶液pH接近7。因此,可以采用加入氧化剂将Fe2+氧化为Fe3+,然后加入碱液将铁沉淀分离除去。为了不引入其他金属离子,碱液可以采用工业氨水,氧化剂可采用工业级双氧水。本工艺经过多次反复实验证明,27.5%双氧水的加入量为1~ 1.5 g/L,20%氨水加入量为1 g/L,沉淀乙醇水溶液中的Fe,固液分离后液相直接进入循环体系,粘附在沉淀中的少量乙醇水溶液直接采用加热蒸馏的方法回收,最终计算出的乙醇回收率可达99.5%以上。
3 结论
1)利用乙醇水溶液对粗制硫酸铝进行除铁研究,确定最佳工艺条件为:振荡时间为2 h,液相pH≤1,温度为25℃。2)粗制硫酸铝经4级逆流除铁工序,最终得到Fe质量分数为0.004 2%的低铁硫酸铝。3)提出了低能耗回收乙醇的方法:在除铁后的乙醇水溶液中加入双氧水和氨水沉淀其中的Fe,固液分离后液相直接进入循环体系,固相粘附的少量乙醇直接蒸馏后进入除铁的循环体系。
[1] 赵鸿斌,何超美,阮湘元.低品位铝土矿生产硫酸铝研究[J].无机盐工业,1995(4):11-12.
[2] 崔树军,张庆甫,张建云,等.煤矸石中提取铝的工艺探讨[J].非金属矿,2010,33(3):25-27.
[3] 崔勇,邱海林,李玉华.一种利用高岭土制备硫酸铝和含铝氧化硅的工艺方法:中国,101209850[P].2007-11-23.
[4] 贺敬明,白殿涛.工业硫酸铝重结晶除铁[J].山西化工,1989(2):21-24.
[5] Li Mingyu,He Zhimei,Zhou Li.Removal of iron from industrial grade aluminum sulfate by primary amine extraction system[J].Hydrometallurgy,2011,106(3/4):170-174.
[6] 吴健宁,蔡会武,郭永梅.从含铁硫酸铝中除铁[J].湿法冶金,2005,24(3):155-158.
[7] 余红发,武金永,吴成友,等.一种粉煤灰生产工业硫酸铝及其综合利用的工艺方法:中国,102101688[P].2010-12-23.
[8] GB3049—1986 化工产品中铁含量测定的通用方法 邻菲啰啉分光光度法[S].
联系方式:wuchengyou86@163.com
Removal of iron from ferrous aluminum sulfate by ethanol solution
Wu Chengyou1,3,Yu Hongfa1,2
(1.Qinghai Institute of Salt Lake,Chinese Academic of Sciences,Xining 810008,China;2.Department of Civil Engineering,Nanjing University of Aeronautics;3.Graduate University,Chinese Academy of Sciences)
In order to remove iron from ferrous aluminum sulfate,a new technique for removing iron with ethanol solution was advanced.Effects of pH of ethanol solution,temperature,and oscillation time on iron extraction efficiency and the technique of the recovery of ethanol were studied.Optimum process parameters were determined through experiments,which were as follows:ethanol solution pH≤1,temperature was 25℃,and oscillation time was 2.5 h.Content of Fe could be decreased to less than 0.005%from 0.98%after four-stage continuous countercurrent iron removal.Recovery efficiency of ethanol could reach more than 99.5%,after the iron in ethanol solution was oxidized by hydrogen peroxide,deposited by ammonia,filtrated and distilled to dryness.The technique is simple to operate,free-pollution,and low-cost.
ethanol solution;iron extraction efficiency;ferrous aluminum sulfate
TQ138.11
:A
:1006-4990(2012)07-0028-03
2012-01-10
吴成友(1986— ),男,硕士研究生,主要从事粉煤灰综合利用技术研究,已发表论文5篇,申请国家专利10多项。
