酶解猪血红蛋白制备降血压肽工艺参数优化
2012-04-01郭奇亮陈代文邹沫君
李 诚,郭奇亮,2,付 刚,陈代文,邹沫君
(1.四川农业大学食品学院,四川 雅安 625000;2.成都市农林科学院,四川 成都 611130)
酶解猪血红蛋白制备降血压肽工艺参数优化
李 诚1,郭奇亮1,2,付 刚1,陈代文1,邹沫君1
(1.四川农业大学食品学院,四川 雅安 625000;2.成都市农林科学院,四川 成都 611130)
为获得具有较高降血压活性的降血压肽,选用胰蛋白酶对猪血红蛋白进行水解。以水解物对血管紧张素转化酶(ACE)抑制率为指标,先进行单因素试验,确定底物质量浓度、水解温度、pH值、酶用量及水解时间5个因素的最适水平范围,再通过正交试验对酶解工艺参数进行优化。结果表明胰蛋白酶水解猪血红蛋白制备降血压肽的最佳酶解条件为:底物质量浓度10g/100mL、水解温度45℃、pH8.0、水解时间8h、酶用量2000U/g,此时酶解产物对血管紧张素转化酶的抑制率为68.74%。
降血压肽;猪血红蛋白;胰蛋白酶;酶解工艺
高血压病是一种常见的多发病。据估计,目前世界1/4的成年人患有高血压,这一数据预计到2025年会增加到30%[1]。全球范围内约有760万人由于高血压病早逝,约占全球病死率13.5%;由高血压引起的脑卒中和缺血性心脏病分别达54%和47%[2]。药物治疗高血压病虽然可以起到一定的作用,但是药物具有强烈的副作用,严重影响着人们的身心健康。人们迫切希望找到一种可以代替药物的食源性降血压产品。
血管紧张素转化酶抑制肽(angiotensin converting enzyme inhibitory peptides,ACEIP)又称ACE抑制肽,是一类具有降血压作用的多肽的总称。ACEIP的突出优点是能有效降低原发性高血压患者的血压,而对正常人却没有降血压作用,也不会产生其他副作用。早在1965年,国外学者Ferreira[3]首次从巴西蝮蛇蛇毒中分离出具有ACE抑制活性的多肽,1982年,Maruyama等[4]发现利用胰蛋白酶酶解酪蛋白之后的产物具有体外ACE抑制活性。随后,越来越多的研究人员分别从不同的食物蛋白酶解产物中分离得到具有降血压活性的多肽,报道的食物有螃蟹、牛肉、蛋黄、玉米等[5-8]。猪血红蛋白经酶解制备的多肽不仅具有易溶解、低黏度、抗凝胶形成等良好的功能特性,而且具有降血压、降血脂、抗衰老、提高免疫力、缓解心血管疾病以及肥胖症等重要的生理活性[9]。Mito等[10]等用胃蛋白酶酶解猪血红蛋白得到了抗高血压肽;Man Jin等[11]依次用外肽酶Flvourzyme和内肽酶Esperase水解猪的血红蛋白得到富含亚铁血红素的低分子质量的小肽;有研究表明猪血经胰蛋白酶水解得到可增强机体免疫活性的多肽[12]。酶解制备降血压肽的研究报道比较多,但各研究所用酶的种类、酶解参数(特别是酶的用量)及酶解效果差异比较大。
本研究采用胰蛋白酶对猪血红蛋白进行水解,对降血压肽制备工艺参数进行优化,以期在较少酶用量情况下获得具有较高降血压活性的降压肽,为利用猪血红蛋白制备、开发降血压肽提供理论依据和实验依据。
1 材料与方法
1.1 材料与试剂
新鲜猪血 雅安市大兴屠宰场。
胰蛋白酶(Trypsin,酶活力1:250) 美国Amresco公司;血管紧张素转化酶(ACE)、马尿酸-组氨酸-亮氨酸(HHL) 美国Sigma公司。
1.2 仪器与设备
BR4i型多功能冷冻离心机 美国Thermo公司;UV-2102 PCS型紫外-可见分光光度计 美国Unico公司;BT-12S电子天平 德国Sartorius公司;PHS-3C酸度计方舟科技公司。
1.3 方法
1.3.1 猪血红蛋白的制备
本实验改良Zhao Qiuyu等[13]的方法。在屠宰过程中采集血液(按3g/L加入柠檬酸钠抗凝),于低温条件下(冰块降温)运回实验室冷藏。在4℃条件下将血液9000×g高速冷冻离心10min,得到上层血浆和下层血细胞。弃去血浆,将血细胞加入同等体积的生理盐水冲洗并离心两次后加入等体积去离子水,在不断搅拌下超声波处理20min辅助溶血,之后4℃条件下4000×g冷冻离心10min,得到上清血红蛋白液于4℃冰箱保存备用。
1.3.2 酶解条件优化
胰蛋白酶水解猪血红蛋白制备降血压肽基本过程:按设定的底物质量浓度取猪血红蛋白液,根据不同的反应条件调节温度、pH值和酶加入量,水解至设定的时间,最后沸水浴10min灭酶。在4℃、10000×g离心5min,收集滤液备用。另取猪血红蛋白用去离子水溶解,作为非酶解对照液。
1.3.2.1 酶解条件单因素试验
分别考察底物质量浓度、水解温度、pH值、酶用量、水解时间5个因素对猪血红蛋白酶解产物ACE抑制率和水解度的影响。底物质量浓度的影响:设定猪血红蛋白质量浓度4、6、8、10、12g/100mL,其他条件为温度45℃、pH8.0、酶用量6000U/g、水解时间6h。水解温度的影响:设定水解温度35、40、45、50、55℃,其他水解条件为底物质量浓度5g/100mL、pH8.0、酶用量6000U/g、水解时间6h。pH值的影响:设定pH值为6.0、7.0、8.0、9.0、10.0,其他水解条件为底物质量浓度5g/100mL、水解温度45℃、酶用量6000U/g、水解时间6 h。酶用量的影响:设定酶用量:2 00 0、4000、6000、8000、10000U/g,其他水解条件为底物质量浓度5g/100mL、水解温度45℃、pH8.0、水解时间6h。水解时间的影响:设定水解时间2、4、6、8、10h,其他水解条件为底物质量浓度5g/100mL、水解温度45℃、pH8.0、酶用量6000U/g。
1.3.2.2 正交试验优化酶解条件
在单因素试验结果基础上,按五因素四水平L16(45)设计正交试验,以蛋白质水解物ACE抑制率为指标,研究最佳酶解条件。
1.3.3 指标测定
1.3.3.1 猪血红蛋白液的蛋白质含量测定
参照GB/T 5009.5—2003《食品中蛋白质的测定》方法测定。
1.3.3.2 蛋白酶活力测定
参照SB/T 10317—1999《蛋白酶活力测定法》中的福林法测定,根据蛋白酶活力确定加酶量。
1.3.3.3 ACE抑制率测定
参照Cushman等[14]的方法。
1.3.3.4 蛋白质水解度测定
采用甲醛滴定法[15]。
1.3.4 数据统计分析
采用SPSS12.0软件对结果进行数据分析,对单因素试验结果的ACE抑制率和水解度采用二变量Pearson相关系数分析相关性。对正交试验结果,根据极差分析各个酶解参数水平变化对酶解产物ACE抑制率影响的主次顺序;用方差分析各个因素对胰蛋白酶水解猪血红蛋白产物的ACE抑制率影响的显著性;采用处理间多重比较法(LSD法)分析各个因素间的相互作用,确定最佳酶解因素水平组合。
2 结果与分析
2.1 底物质量浓度的影响

图1 底物质量浓度对胰蛋白酶酶解猪血红蛋白水解度及产物ACE抑制率的影响Fig.1 Effect of substrate concentration on hydrolysis degree and ACE inhibitory rate of porcine hemoglobin
由图1可知,随着底物质量浓度的增加,胰蛋白酶酶解猪血红蛋白的水解度和水解产物的ACE抑制率都上升。底物质量浓度从4~12g/100mL,质量浓度每增加2g/100mL,水解度分别增加2.43%、0.75%、0.79%和0.62%,产物ACE抑制率的增长分别为4.14%、3.57%、2.88%和1.27%。随着底物质量浓度增加,虽然水解度和产物ACE抑制率都有增加,但是增加的幅度越来越小。底物质量浓度从10g/100mL增加到12g/100mL时,其水解度及产物ACE抑制率的增加幅度最小,因此确定10g/100mL及以下为最适宜的底物质量浓度。
2.2 水解温度的影响

图2 水解温度对胰蛋白酶酶解猪血红蛋白水解度及产物ACE抑制率的影响Fig.2 Effect of temperature on hydrolysis degree and ACE inhibitory rate of porcine hemoglobin
由图2可知,水解度与产物ACE抑制率都是先上升后下降,并且都是在温度为40~45℃间达到峰值,40~45℃为最适宜温度。当温度达到55℃时,水解度和产物ACE抑制率已经大幅下降。因此选择35、40、45℃和50℃为适宜的水解温度。
2.3 pH值的影响

图3 pH值对胰蛋白酶酶解猪血红蛋白水解度及产物ACE抑制率的影响Fig.3 Effect of pH on hydrolysis degree and ACE inhibitory rate of porcine hemoglobin
由图3可知,在pH8.0时酶解水解度和产物的ACE抑制率都达到峰值。而pH6.0时,水解度和产物ACE抑制率是所有条件下最低的,故选择pH值为7.0、8.0、9.0和10.0为适宜的酶解条件。
2.4 酶用量的影响

图4 酶用量对胰蛋白酶酶解猪血红蛋白水解度及产物ACE抑制率的影响Fig.4 Effect of enzyme dosage on hydrolysis degree and ACE inhibitory rate of porcine hemoglobin
由图4可知,随着酶用量的增加,胰蛋白酶酶解猪血红蛋白的水解度和产物的ACE抑制率都上升。随着酶用量的继续增加,水解度的增加比较平缓,而产物ACE抑制率一直保持着较高增长率。考虑酶用量的增加导致成本增加,因此选择2000、4000、6000U/g和8000U/g为适宜的酶用量。
2.5 水解时间的影响

图5 水解时间对胰蛋白酶酶解猪血红蛋白水解度及产物ACE抑制率的影响Fig.5 Effect of hydrolysis time on hydrolysis degree and ACE inhibitory rate of porcine hemoglobin
由图5可知,在酶解前期,酶解水解度和产物的ACE抑制率都快速上升,而从6h开始,水解度和产物的ACE抑制率增长速度趋于平缓,8h后增长幅度不大。因此选择2、4、6h和8h为适宜的水解时间。
2.6 酶解条件优化试验结果
2.6.1 正交试验设计及结果
酶解条件优化正交试验设计及结果与分析分别见表1~3。

表1 正交试验因素水平表Table1 Coded values and corresponding real values of the optimization parameters tested in orthogonal array design
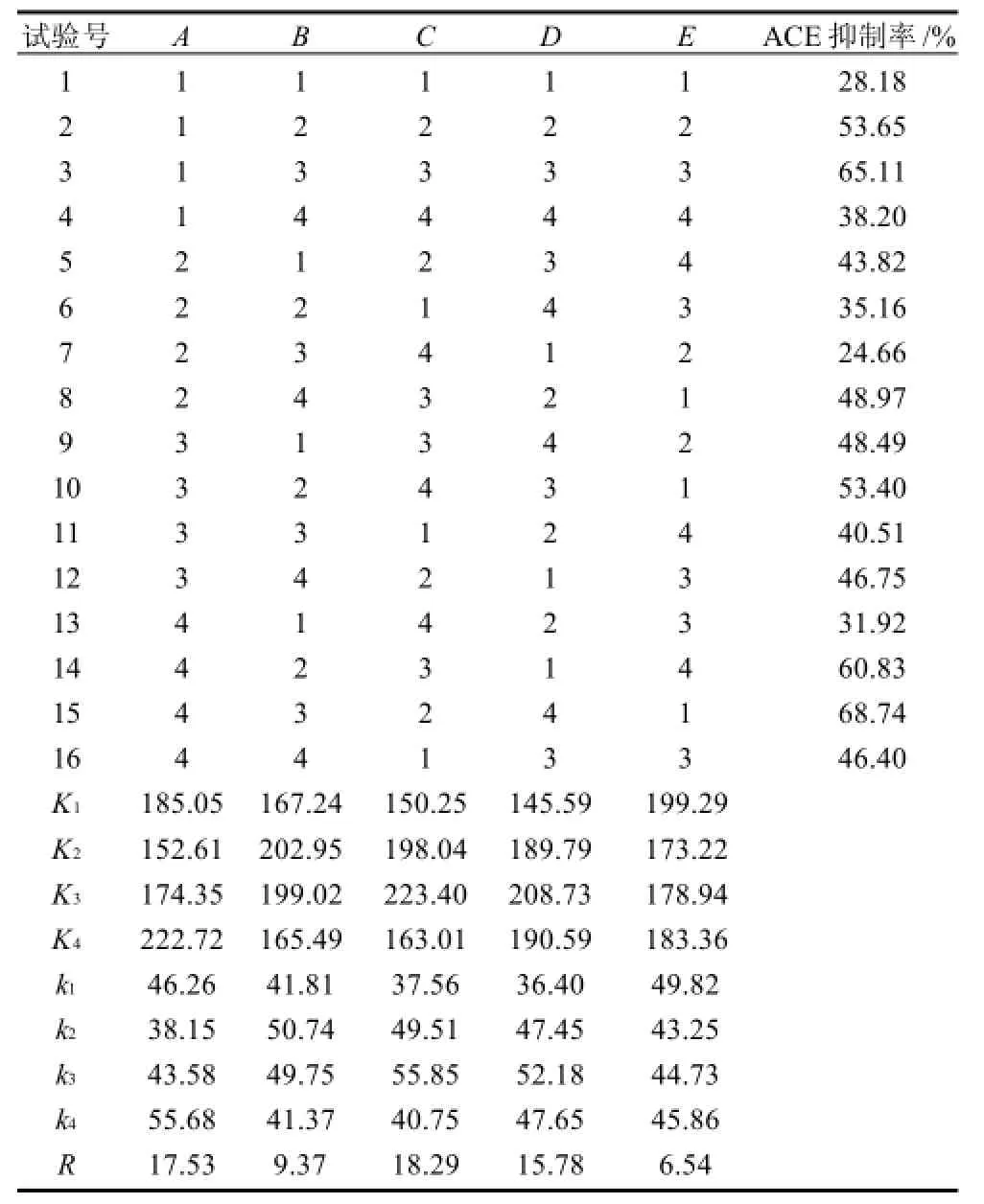
表2 正交试验设计及结果Table2 Orthogonal array design and results

表3 正交试验结果方差分析Table3 Variance analysis for the experimental results of orthogonal array design
根据表2极差分析,各因素对酶解产物ACE抑制率影响的主次顺序依次为C>A>D>B>E,即pH值>底物质量浓度>水解时间>水解温度>酶用量。从表3的方差分析可以看出,底物质量浓度、水解温度、pH值、水解时间4个因素对胰蛋白酶酶解猪血红蛋白产物的ACE抑制率的大小均有极显著的影响,酶用量对胰蛋白酶酶解猪血红蛋白产物的ACE抑制率的大小无显著影响,区组间影响差异不显著。
2.6.2 各试验处理平均数多重比较(LSD法)
表3结果显示,除酶用量对酶解产物ACE抑制率无显著影响外,其他4个因素都有极显著影响。因此有必要进行各个试验处理间的多重比较以确定最优水平组合。根据最小显著差数法计算各处理每两组间的差值和最小显著差数LSDα:LSD0.05=2.84,LSD0.01=3.91。
多重比较结果表明,除几个试验组间(包括试验组11号与4号,试验组16号与5号、8号、9号、13号,试验组13号与8号、9号,试验组8号与9号,试验组2号与10号)差异不显著外,其余各试验处理组间差异都是显著或极显著,说明该正交试验可以筛选确定出最优组合。其中,15号试验处理组与其他处理间差异都为显著或极显著。结合极差分析和方差分析,酶用量是最为次要的影响因素。从降低成本考虑,选择最小的酶用量,可以确定15号处理组为最优水平组。因此确定胰蛋白酶水解猪血红蛋白的最佳工艺参数组合为A4B3C2D4E1,即pH8.0,底物质量浓度10g/100mL,水解时间8h,水解温度45℃,酶用量2000U/g。
3 结 论
采用胰蛋白酶酶解猪血红蛋白制备降血压肽的单因素试验表明胰蛋白酶酶解猪血红蛋白的水解度与水解产物的ACE抑制率相关性显著,ACE抑制率随着水解度的增减而增减。正交试验表明,酶用量对酶解产物ACE抑制率的影响最小,各种酶解参数对酶解产物ACE抑制率的影响大小顺序为:pH值>底物质量浓度>水解时间>水解温度>酶用量;酶用量对胰蛋白酶酶解猪血红蛋白产物的ACE抑制率无显著影响;胰蛋白酶水解猪血红蛋白制备降血压肽的最佳酶解条件为底物质量浓度10g/100mL,水解温度45℃,pH8.0,水解时间8h,酶用量2000U/g,在此条件下水解产物的ACE抑制率为68.74%。
本研究对采用胰蛋白酶水解猪血红蛋白制备降血压肽的工艺参数进行优化,在较少酶用量情况下获得了具有较高降血压活性的降压肽,不仅原料便宜,而且酶用量很少。这为低成本开发降血压肽提供了重要的理论依据和实验依据。
参考文献:
[1]FERNANDEZ-MUSOLES R, LOPEZ-DIEZ J J, TORREGROSA G, et al. Lactoferricin B-derived peptides with inhibitory effects on ECE-dependent vasoconstriction[J]. Peptides, 2010, 31(10): 1926-1933.
[2]陈玲, 邹栩. 全球心血管药物研发动态[J]. 中国新药杂志, 2010, 19 (1): 8-16.
[3]FERREIRA S H, ROCHA e SILVA M. Potentiation of bradykinin and eledoisin by BPF (bradykinin potentiaitng factor) from Bothrops jararaca venom[J]. Experientia, 1965, 21(6): 347-349.
[4]MARUYAMA S, SUZUKI H A. Peptide inhibitor of angiotensin I-converting enzyme in the tryptic hydrolysates of casein[J]. Agric Biol Chem, 1982, 46(5): 1393-1394.
[5]CHEUNG H S, WANG F L, ONDETTI M A, et al. Binding of peptide substrates and inhibitors of angiotensin-converting enzyme. Importance of the COOH-terminal dipeptide sequence[J]. J Biol Chem, 1980, 255 (2): 401-407.
[6]IROYUKIFUJITA H, EIICHIYOKOYAMA K, YOSHIKAWA M. Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins[J]. J Food Sci, 2000, 65(4): 564-569.
[7]MIYOSHI S, ISHIKAWA H, KANEKO T, et a1. Structures and activity of angiotensin converting enzyme in soybean hydrolysates[J]. J Agric Biol Chem, 1991, 55(3): 1318-1319.
[8]王海燕, 张佳程. 乳源ACE抑制剂(降血压肽)的研究现状[J]. 食品与发酵工业, 2001, 27(11): 70-73.
[9]MIGUEL M, CONTRERAS M M, RECIO I, et al. ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J]. Food Chemistry, 2009, 112(1): 211-214.
[10]MITO K, FUJII M, KUWAHARA M, et al. Antihypertensive effect of angiotensin Ⅰ-converting enzyme inhibitory peptides derived from hemoglobin[J]. European Journal of Pharmacology, 1996, 304(1/3): 93-98.
[11]MAN Jin, HEE J C, NAM-SOON Oh. Process development for hemeenriched peptide by enzymatic hydrolysis of hemoglobin[J]. Bioresource Technology, 2002, 84(1): 63-68.
[12]李艳伟, 江波, 伶祥山. 酶解猪血蛋白中活性肽的纯化和功能研究[J]. 高等学校化学学报, 2005, 26(1): 61-63.
[13]ZHAO Qiuyu, SANNIER F, PIOT J M. Kinetics of appearance of four hemorphins from bovine hemoglobin peptic hydrolysates by HPLC coupled with photodiode array detection[J]. Biochimica et Biophysica Acta, 1996, 1295(1): 73-80.
[14]CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[15]黄晓钰, 刘邻渭. 食品化学综合实验[M]. 北京: 中国农业大学出版社, 2002: 131-132.
Optimization of Process Parameters for Enzymatic Preparation of Antihypertensive Peptides from Porcine Hemoglobin
LI Cheng1,GUO Qi-liang1,2,FU Gang1,CHEN Dai-wen1,ZOU Mo-jun1
(1. College of Food Science, Sichuan Agricultural University, Ya’an 625000, China;2. Chengdu Academy of Agriculture and Forestry Sciences, Chengdu 611130, China)
In order to prepare antihypertensive peptide with high activity, trypsin was selected to hydrolyze porcine hemoglobin. The one-factor-at-a-time and orthogonal array design methods were used to optimize hydrolysis conditions such as substrate concentration, temperature, pH, enzyme dosage and time based on the ACE inhibitory rate of hydrolyzed porcine hemoglobin. The results showed that the optimal hydrolysis conditions were hydrolysis for 8 h at 45 ℃, pH 8.0, an enzyme dosage of 2000 U/g and a substrate concentration of 10 g/100 mL. Under these hydrolysis conditions, the ACE inhibitory rate of porcine hemoglobin hydrolysate was 68.74%.
antihypertensive peptide;porcine hemoglobin;trypsin;enzymatic hydrolysis process
TS201.2
A
1002-6630(2012)01-0195-05
2011-08-08
李诚(1964—),男,教授,博士研究生,主要从事动物性食品加工与质量安全控制研究。E-mail:lichenglcp@163.com
