食用菌致病木霉优良拮抗菌株的筛选及生理特性的初步研究
2012-04-01生吉萍郑嫣燕
张 旭,刘 灿,生吉萍,郑嫣燕,徐 菲,申 琳
(中国农业大学食品科学与营养工程学院,北京 100083)
食用菌致病木霉优良拮抗菌株的筛选及生理特性的初步研究
张 旭,刘 灿,生吉萍,郑嫣燕,徐 菲,申 琳*
(中国农业大学食品科学与营养工程学院,北京 100083)
木霉是食用菌大规模人工栽培过程中的主要致病菌,为寻找安全、高效的拮抗菌,从食用菌培养基中分离得到283株细菌。通过平板对峙法,筛选出16株对木霉有强烈拮抗作用的菌株。选择其中拮抗效果最明显的6株细菌利用杯碟法测定其发酵上清液的抑菌效果,最终筛选出细菌B155,其发酵上清液对木霉的抑菌圈半径达(19.02 ± 1.65)mm。通过形态学、生理生化及16S rDNA鉴定,确定B155为地衣芽孢杆菌,并将其命名为B155 (B. licheniformis)。通过对B155菌株生理特性的初步研究,发现B155菌株的最适生长温度为37℃,最适生长pH值为7.0,最适接种量为1%。
食用菌;木霉;拮抗菌;地衣芽孢杆菌;生理特性
食用菌可以为人类提供丰富的营养物质[1-2],且味道鲜美。近几年来我国食用菌消费水平大幅度增高。由于食用菌生长速度较快且对季节及场地面积要求较小,因而食用菌生产企业逐渐增多,但由于食用菌生长及保藏的过程中,经常受到霉菌特别是木霉[3-8]的污染,阻碍其生长,并加速保鲜过程中产品的腐烂速度[9-11],因而食用菌的污染导致食用菌产量的下降,对生产者造成经济效益下降,也影响到食用菌的食品安全性问题。
针对食用菌的病害问题,目前市场上常用的抑菌制剂大都为化学制剂,虽然效果确切,但存在副作用, 而且生产成本较高,严重的还会造成化学成分的残留,引起了严重的食品安全问题。针对此种情况,研究与开发副作用小、不污染环境、来源于生物的天然抑菌制剂具有很大的理论和现实意义。生物防治在防治植物病害方面的研究已经有一定的基础[12-13],并成功地应用于生产实际操作中。
食用菌中致病微生物生防制剂的研究是通过筛选和安全性鉴定,获得能够拮抗霉菌的安全细菌。在此研究领域,我国已有了一定程度的发展[14]。此外,通过近几年对引起食用菌腐败的致病微生物的研究,以及食用菌培养基中丰富微生物资源的初步利用[10],都为优良拮抗菌株的筛选提供了条件。但对于食用菌中病原微生物的研究目前仍处于起步发展阶段,仍有很大的研究与创新空间。
1 材料与方法
1.1 材料与试剂
蟹味菇培养基、双孢菇培养基、白玉菇培养基、烟台蟹味菇培养基、烟台双孢菇培养基由山东省九龙有限公司提供。
木霉指示菌为中国农业大学食品科学与营养工程学院微生物菌种保藏与鉴定中心提供。
细菌培养基:LB 培养基(蛋白胨10g/L、酵母膏5g/L、NaCl 10g/L,pH7.2~7.4;发酵液培养基:5g/L葡萄糖、5g/L蛋白胨、5g/L酵母浸粉、10g/L NaCl、pH值自然;真菌培养基:PDA 培养基(马铃薯200g/L、葡萄糖200g/L,自然pH 值;固体培养基中加入20g/L 琼脂粉,121℃,20min 灭菌备用。
PCR生化试剂 宝生物工程(大连)有限公司;DNA提取试剂盒 天根科技生化(北京)有限公司;蛋白胨、酵母膏 北京奥博星生物技术有限责任公司。
1.2 仪器与设备
722S型可见分光光度计 上海棱光技术有限公司;DNP-9802型电热恒温培养箱 上海精宏试验设备有限公司;SCL-1300型垂直流洁净工作台 北京赛伯乐试验仪器有限公司;TC512 型PCR 仪 美国Barloworld Scientific公司。
1.3 方法
1.3.1 拮抗菌株的分离
取1g培养基用无菌研钵研磨并加入到9mL无菌生理盐水中,用无菌生理盐水梯度稀释后吸取0.1mL涂布于细菌培养基平板,37℃培养24~72h,挑取单菌落划线纯化。对已纯化的细菌进行编号,并保存待用。
1.3.2 抗木霉拮抗菌株的筛选
木霉的培养及孢子液的制备:木霉接入PDA 斜面(180mm×18mm),28℃培养4d,待孢子充分形成后,每个试管中加入5mL 无菌的体积分数0.5% Tween-80 溶液,充分振荡后以血球计数板计数并以无菌水调整至107个/mL,4℃保存。
抗木霉优良菌株的初筛:用打孔器将培养有木霉的培养基上打下大小相同的带有木霉的培养基圆片,置于筛选培养基平板中心。将1.3.1节已分离纯化的细菌菌株分别点种在LB固体培养基表面上。28℃培养3d,观察细菌菌落周围是否存在抑菌圈并用十字交叉法测量抑菌圈直径。有抑菌能力的菌株用斜面保存。
抗木霉优良菌株的复筛:使用PDA斜面培养基培养木霉,待孢子长满斜面后,用无菌生理盐水冲洗斜面,制成孢子悬浮液,并稀释为101、103、105、107个/mL,4个浓度梯度。再将不同浓度梯度的木霉孢子接入PDA培养基平板中,28℃培养4d,待孢子充分形成待用。
挑出初筛筛出的抑菌效果好的细菌斜面保存的菌株,接入装有50mL发酵液培养基的300mL三角瓶中,置于恒温振荡器中,28℃、140r/min培养48h。发酵液10000r/min离心10min,再经0.22μm滤膜过滤,测定该无菌滤液的抑菌活性。将每个涂布有不同浓度梯度的木霉孢子平板中十字等距离放入四个牛津杯,每个牛津杯中加入100μL无菌滤液并静置,28℃培养72h后十字交叉法测量抑菌圈半径,以接种培养基上清液作为空白对照,每处理3个重复。
1.3.3 菌株的鉴定
形态学鉴定:挑取少量目标菌株在LB平板上划线,37℃培养24h后观察单菌落形态、形状、大小、透明度、边缘、表面、菌落及周围培养基的颜色等形状,并进行革兰氏染色记录菌体形态。继续培养至48h后再次染色,记录菌体形态。
生理生化鉴定:将目标菌株的发酵液接种于API 50生理生化指标鉴定试剂盒中,于37℃培养,并在12、24、48h后观察并记录结果。
16S rDNA 鉴定:按照天根科技生化(北京)有限公司细菌基因组DNA提取试剂盒的方法进行。用细菌通用引物,正向引物16Sf:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物16Sr:5'-GGCTACCTTGTTACGACTT-3'。PCR反应条件:94℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸1min 30s,33个循环;再进行终延伸10min。
所得PCR 产物用琼脂糖凝胶电泳在标准条件下进行检测后送至北京六合华大基因科技股份有限公司测序。所得序列利用Blast 程序在GenBank 基因库中进行比对,选取相似性较高的几株菌株的16S rDNA 序列,用Mega3.1 软件构建系统发育树。
1.3.4 目标菌株生长特性的初步研究
1.3.4.1 最适生长温度的确定
将目标菌株B155菌株接种至含50mL LB培养基的300mL三角瓶中,轻轻振荡,使菌体分布均匀,置于不同发酵温度(20、24、28、32、37、42℃)条件下,140r/min摇床培养24h,离心收集上清液,测600nm波长处的吸光度。
1.3.4.2最适生长pH值的确定
将目标菌株B155菌株分别接种至含50mL不同pH值(5.5、6.0、6.5、7.0、7.5、8.0、8.5)LB液体培养基的300mL三角瓶中,轻轻振荡,使菌体分布均匀,在最适生长温度条件下140r/min摇床培养24h,离心收集上清液,测600nm波长处的吸光度。
1.3.4.3 最适接种量的确定
将目标菌株B155采用不同接种量(0.05%、0.1%、0.5%、1.0%、2.0%、3.0%和4.0% )接种至含50mL LB培养基的300mL三角瓶中,轻轻振荡,使菌体分布均匀,在最适生长温度、最适生长pH值条件下140r/min摇床培养24h,离心收集上清液,测600nm波长处的吸光度和活菌数。
1.3.4.4 最适培养条件下生长曲线的测定
将目标菌株B155采用最适生长温度,最适生长pH值及最适接种量接种至含50mL LB培养基的300mL三角瓶中,轻轻振荡,使菌体分布均匀,置于140r/min摇床中振荡培养。每隔一段时间取样,以未接种液体培养基作对照,测定A600nm。以培养时间为横坐标,A600nm为纵坐标绘制曲线。
2 结果与分析
2.1 单菌落的分离结果
从不同食用菌培养基共计16个样品中分离得到有单一菌落形态的细菌283株,其中来源于蟹味菇培养基37株,双孢菇培养基23株,白玉菇培养基26株,烟台蟹味菇培养基21株,烟台双孢菇培养基176株,对分离所得细菌分别进行斜面保藏和甘油保藏。
2.2 拮抗木霉优良菌株的初筛及复筛结果
通过划线接种法,在接有霉菌的平板上,距霉菌距离相等的4个方向分别划长度相等的沾有细菌的直线。从分离的283株细菌中,共筛出16株在抑菌对峙实验中形成清晰透明圈的细菌。部分菌株产生的拮抗效果见图1。由于木霉的最适生长温度在25~28℃,而细菌最适生长温度在30℃以上,实验中若始终在28℃条件下培养,某些细菌的抑菌效果不明显,而37℃条件下木霉孢子不能萌发,超过24h后大部分孢子死亡。最终将实验条件确定为在37℃条件下培养8h后,移至28℃培养箱培养48h。
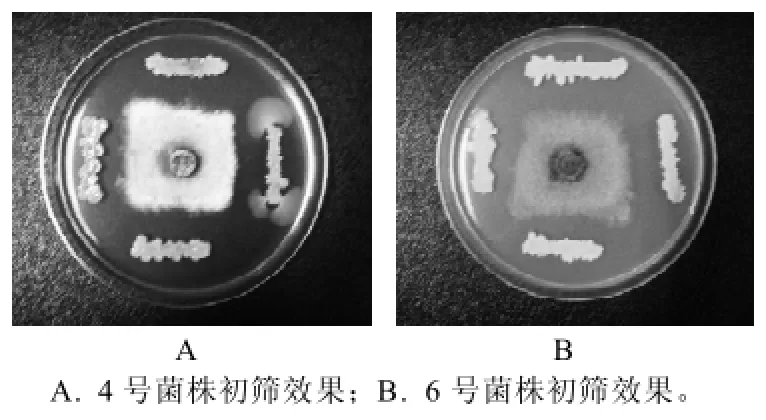
图1 部分拮抗木霉细菌产生的拮抗效果Fig.1 Inhibitory effect of antagonistic bacteria on Trichoderma
选择初筛抑菌效果明显的6株细菌,通过对其发酵上清液的抑菌活性测定来进一步复筛优良菌株,结果见表1。
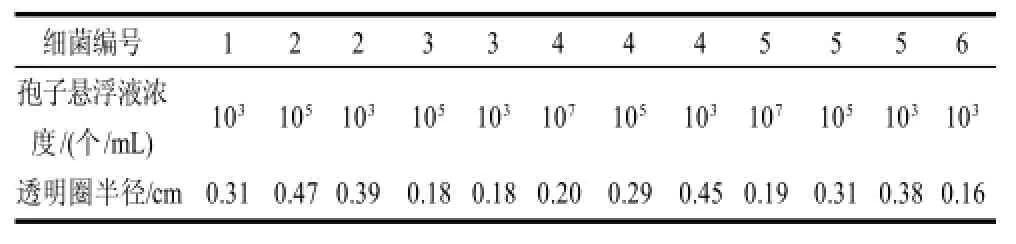
表1 部分拮抗木霉细菌复筛抑菌效果Table1 Inhibitory effect of antagonistic bacteria obtained from secondary screening on Trichoderma
从表1可以看出,6株细菌的发酵上清液均能产生抑菌圈,其中4号、5号菌株的抑菌效果较其他两株明显,可以抑制的孢子悬浮液浓度为107个/mL,透明圈的半径为0.20、0.19cm,故确定目标菌株为4号菌株,编号为B15 5。通过目标菌株的抑菌实验可得,其发酵上清液对木霉的抑菌圈半径达(19.02 ± 1.65)mm。
2.3 目标菌株的鉴定
2.3.1 菌株B155形态学鉴定结果
B155号菌株在细菌培养基平板上生长时呈现乳白色半透明的圆形菌落,边缘呈锯齿状,表面较光滑,菌落周围培养基颜色未发生改变。通过革兰氏染色可知B155号菌为革兰氏阳性菌,且为产芽孢细菌。菌体为杆状,芽孢为椭球形,如图2所示。

图2 B155号菌株形态学鉴定结果Fig.2 Morphology of strain B155
2.3.2 菌株B155生理生化鉴定结果
由表2可知,菌株B155接触酶反应、MR实验呈阳性,卵磷脂水解呈阴性,能够利用葡萄糖及淀粉,不能在4、1 0、55 ℃生长,能在7% NaCl 溶液中生长,这些结果与《常见细菌系统鉴定手册》[15]比对显示菌株B155为地衣芽孢杆菌。

表2 菌株B155生理生化特性鉴定结果Table2 Physiological and biochemical characteristics of strain B155
2.3.3 菌株B155 16S rDNA鉴定结果
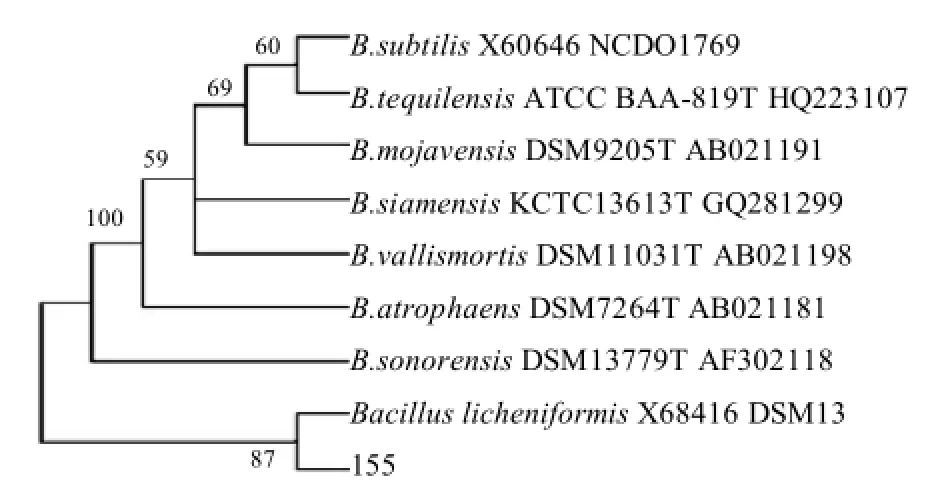
图3 菌株B155的16S rDNA 系统发育树Fig.3 Phylogenetic tree based on the 16S rDNA sequences of strain B155
将菌株B155在GenBank上进行序列比对,与地衣芽孢杆菌同源性最高,高达99%。使用Mega 3.1软件建立系统发育树,结果如图3所示。菌株B155与地衣芽孢杆菌处于同一发育水平上。根据表型特征、生理生化特性以及16S rDNA鉴定结果,可以判定菌株B155为地衣芽孢杆菌,并将其命名为地衣芽孢杆菌ABM 155 (B. licheniformis ABM 155)。
2.3.4 ABM155菌株生理特性的初步研究
通过测定地衣芽孢杆菌ABM 155 在不同生长温度的A600nm值,确定地衣芽孢杆菌ABM 155 最适生长温度为37℃(图4A)。运用同样的方法,测定地衣芽孢杆菌ABM 155 在最适生长温度不同pH值条件下的A600nm值,确定ABM155的最适生长pH值为7.0(图4B)。在地衣芽孢杆菌ABM 155 最适生长温度、最适生长pH值条件下,其最适接种量为1%(图4C)。
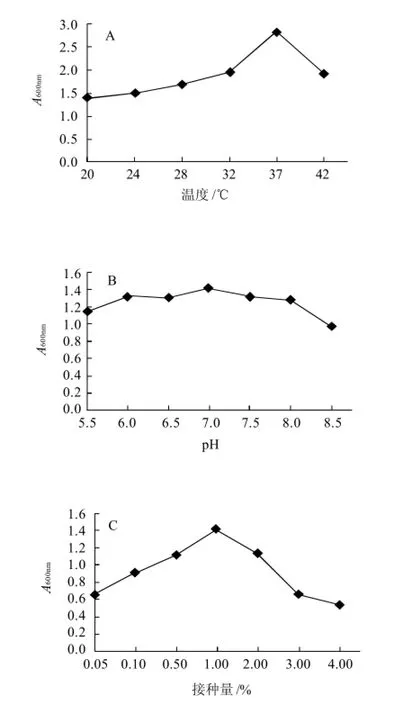
图4 菌株B155最适生长温度、pH值、接种量的测定结果Fig.4 Optimal growth temperature, pH and inoculum amount of strain B155 strain
根据测定的地衣芽孢杆菌ABM 155 在最适生长温度、最适生长pH值及最适接种量条件下随发酵时间的A600nm值及活菌数,确定地衣芽孢杆菌ABM 155 生长曲线,具体结果见图5。

图5 发酵过程中地衣芽孢杆菌ABM155的A600nm值变化Fig.5 Change of A600nmduring the fermentation of ABM155
由ABM155的生长曲线可知,菌株在0~5h生长较为缓慢,该阶段为菌株生长的延滞期,在5~14h生长迅速,进入对数期,而在14h以后,吸光度变化较小,为目标菌株ABM155的稳定期。
3 讨 论
本实验从不同食用菌培养基共计16个样品中分离得到283株芽孢杆菌,通过平板对峙法及杯碟法测定其发酵液的抑菌效果,最终筛选出一株芽孢杆菌ABM155,其发酵上清液对木霉的抑菌圈直径达到(19.02 ± 1.65)mm,通过形态学、生理生化指标测定及16S rDNA 序列分析,最终将该菌株鉴定为地衣芽孢杆菌ABM155。通过对其生理特性的初步研究得出地衣芽孢杆菌ABM155 菌株最适生长温度为37℃,最适生长pH值为7.0,最适接种量为1%。本实验所选的菌种均分离自健康食用菌培养基,主要是考虑到以下几个因素:1)健康食用菌培养基细菌种类丰富;2)健康食用菌培养基中可能会含有抑制木霉的拮抗菌株;3)健康食用菌培养基无论是对人体还是对食用菌自身的生长而言安全性较高。基于以上3点可以提高本实验获得安全、高效抑制致病木霉的优良细菌菌株的效率。
从本实验结果可以看出,从健康食用菌培养基中可分离出较大数量拮抗木霉的菌株,其中一部分对木霉产生明显的拮抗效果。很多优良的拮抗菌株如枯草芽孢杆菌己成功应用于农业生产[16]。向晶晶等[17]筛选得到污染食用菌培养基的青霉的拮抗菌蜡样芽孢杆菌,在田间实验中,所分离的抗菌物质原液抑菌率达到80%,在食用菌病害的生物防治上取得良好的效果。本实验目前已完成拮抗菌株的筛选及生理生化特性的初步研究,今后将集中对抑菌物质的分离、纯化以及抑菌机理进行深入研究。
[1]刘振江, 王红育. 食用菌功能食品的研究与开发[J]. 食品科技, 2007, 29(3): 29-31.
[2]刘宏. 食用菌营养价值及开发利用[J]. 中国食物与营养, 2007,12(9): 25-27 .
[3]CHEN C, TUMEN D, ARNOULD C, et al. Hydrolytic enzyme activity of Paenibacillus sp. strain B2 and effects of the antagonistic bacterium on cell integrity of two soil-born pathogenic fungi[J]. Applied Soil Ecology, 2000, 15: 191-199.
[4]张中义. 植物病原真菌学[M]. 成都: 四川科学技术出版社, 1988: 71- 73.
[5]章初龙, 徐同. 木霉属分类研究进展[J]. 云南农业大学学报, 2000, 15(3): 269- 274.
[6]徐同. 木霉分子生物学研究进展[J]. 真菌学报, 1996, 15(2): 143-148.
[7]GRONDONA I, HERMOSA R, TEJADA M, et al. Physiological and biochemical characterization of Trichoderma harzianum, a biological control agent against soilborne fungal plant pathogens[J]. Applied and Environmental Microbiology, 1997, 63(8): 3189- 3198.
[8]吴小平, 吴晓金, 胡方平. 食用菌栽培中相关木霉的遗传多样性及生物学特性[ J]. 福建农业大学学报, 2008, 37(5): 527-531.
[9]蒋素蓉, 文成敬, 徐耀波. 温度和杀菌剂对平菇、香菇及其主要污染真菌菌丝生长的影响[J]. 中国食用菌, 2005, 24(6): 40-43.
[10]吴小平. 食用菌致病木霉的鉴定、致病机理及防治研究[J]. 福建农林大学学报, 2008, 37(5): 527-531.
[11]李宝聚, 阚琳娜, 徐凯, 等. 食用菌生产中主要竞争性病害的种类及其防控技术[J]. 中国蔬菜, 2005(12): 61-62.
[12]辛雅芬, 商金杰, 高克祥. 拮抗木霉菌的生防机制研究进展[J]. 东北林业大学学报, 2005, 33(4): 88-91 .
[13]MARC O, PHILIPPE J. Bacillus lipopeptides: versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2008, 16(3): 115-125.
[14]吴小平, 彭建升. 食用菌污染菌脉孢菌的生物防治[J]. 中国食用菌, 2009, 28(2): 51-53.
[15]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 43-65.
[16]崔堂兵, 刘熠平, 郭勇, 等. 枯草芽孢杆菌培养生产农用抗真菌素初步研究[J]. 广东农业科学, 2007(1): 51-54.
[17]向晶晶. 食用菌种植中污染菌青霉的拮抗菌筛选与应用研究[D]. 成都: 四川大学, 2007 .
Screening, Identification and Physiological Characteristics of Antagonistic Bacteria against Trichoderma in Mushroom
ZHANG Xu,LIU Can,SHENG Ji-ping,ZHENG Yan-yan,XU Fei,SHEN Lin*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Trichoderma can widely contaminate mushroom and result in the decay of mushroom. In order to screen antifungal bacteria for the application in mushroom cultivation industry, 283 strains were isolated from 16 kinds of cultivation media. Of them, 16 exhibited obvious antifungal activity against Trichoderma, and 6 with the strongest antagonistic activity were screened out and the inhibitory effects of their fermentation supernatants were tested by the cup method. As a result, the best strain named as B155 was screened out with an inhibition zone radius of (19.02 ± 1.65) mm. According to morphological, physiological and biochemical characteristics as well as partial 16S rDNA sequence analysis, strain B155 was identified as B. licheniformis and designated as ABM 155. The optimal growth temperature, pH and inoculum amount for the strain were 37 ℃, 7.0 and 1%, respectively.
mushroom;Trichoderma;antagonistic bacteria;B. licheniformis;physiological characteristics
Q93.331
A
1002-6630(2012)01-0186-05
2011-05-21
国家公益性行业(农业)科研专项(200803033)
张旭(1990—),女,本科生,研究方向为食品科学与工程。E-mail:zhangxu19901218@163.com
*通信作者:申琳(1964—),男,副教授,博士,研究方向为生物工程与农产品综合利用。E-mail:pingshen@cau.edu.cn
