菠萝蛋白酶水解泥鳅蛋白制备ACE抑制肽的研究
2012-04-01姚东瑞盘赛昆周鸣谦王淑军胡金玲
姚东瑞,盘赛昆,周鸣谦,王淑军,胡金玲
(淮海工学院食品工程学院,江苏 连云港 222005)
菠萝蛋白酶水解泥鳅蛋白制备ACE抑制肽的研究
姚东瑞,盘赛昆,周鸣谦,王淑军,胡金玲
(淮海工学院食品工程学院,江苏 连云港 222005)
为了探讨利用泥鳅蛋白制备功能性肽的可能性,采用高效液相色谱法测定泥鳅肉水解物对血管紧张素转换酶(ACE)的抑制作用,从胰蛋白酶、胃蛋白酶、菠萝蛋白酶、复合风味蛋白酶、复合蛋白酶5种酶中筛选出菠萝蛋白酶作为酶解泥鳅肉制备具有降血压活性水解物的适宜水解酶。在单因素试验的基础上,采用L9(34)正交试验设计对该酶的酶解条件进行优化。结果表明最佳水解条件为:温度55℃,固液比1:3,pH6.5,加酶量1000U/g pro,水解时间90min。在该条件下,水解物的ACE抑制率IC50值为0.0184mg/mL,ACE抑制肽的相对分子质量主要集中在924左右。
泥鳅;酶解;降血压;血管紧张素转换酶(ACE);菠萝蛋白酶
高血压是对人类健康危害极大的一种疾病,在西方国家1/4的人群受其影响[1],全世界每年因高血压死亡的人数高达1200万[2]。据国家高血压研究中心最新统计,我国高血压患者己达1.2亿人,发病率为10.8%,其危害仅次于肿瘤[3]。血管紧张素转换酶(angiotensin-I converting enzyme,ACE,EC 3. 4.15.1)是一种含锌的二肽羧基肽酶[3],是动物体内血压控制的一种关键物质[4]。ACE催化血管紧张素-Ⅰ脱去C未端两个氨基酸残基形成活性很强的血管紧张素-Ⅱ,而血管紧张素-Ⅱ是肾素——血管紧张素调节系统中已知活性最强的血管收缩剂,它能作用于小动脉,使血管平滑肌收缩,迅速引起升压效应;同时还能刺激醛固酮分泌和直接对肠胃作用(减少肾血流量及促进Na+、K+的重吸收),引起钠贮量和血容量的增加,也能使血压升高。缓激肽是降血压物质,ACE也能作用于缓激肽,催化从其C未端脱去两个氨基酸残基而使其失活,从而也使血压升高[4]。因此,如果抑制了ACE的活性,就能有效防止和治疗高血压的发生。降血压肽能够竞争性地与ACE结合,从而抑制其发挥作用。自Ferreira等从蛇毒中首次发现天然ACE抑制肽以来,食源性降血压肽具有无毒副作用、安全性高的特点而倍受科研工作者的关注[5-8]。
泥鳅(Misgurnus anguillicaudatus)系鳅科动物,肉或全体可入药,收载于《中药大辞典》[9]。中医认为,泥鳅性味甘、平、无毒,具有调中益气、壮阳祛湿等功能,可用于治疗肝炎、皮肤瘙痒、水肿、黄疸和痔疮等疾病[10-11]。泥鳅是滋补佳品,素有“水中人参”之美誉,肉质细嫩,味道鲜美,分析表明,泥鳅蛋白质含量达17%左右,谷氨酸、天冬氨酸、丙氨酸与甘氨酸4种鲜味氨基酸的含量远超过其他鱼类[12],是一种高蛋白、低脂肪的高档营养珍品[13]。泥鳅是一种食性杂、生产潜力大、很有发展前途的养殖品种,国内外市场的需求量较大[13]。我国除青藏高原外,各地的河川、沟渠、水田、池塘都有泥鳅的分布,仅连云港地区养殖水面就达16000多亩,是一种优质而丰富的蛋白质资源。近年来,如何高效利用泥鳅蛋白成为研究的焦点。利用蛋白酶专一水解特性,将蛋白质中无活性的氨基酸序列释放为具有各种活性的肽段是一种食源性功能肽的有效制备方法[14]。You Lijun等[10]利用木瓜蛋白酶和复合蛋白酶水解泥鳅蛋白制备抗氧化活性肽,而酶解泥鳅蛋白制备降血压肽的研究尚未见报道。
本实验利用高效液相色谱法测定泥鳅蛋白水解物对ACE的抑制活性,以水解度(DH)和水解产物对ACE的抑制率为指标对酶解过程进行分析,旨在为利用泥鳅蛋白制备降压肽提供理论指导。
1 材料与方法
1.1 材料与试剂
鲜活泥鳅购于连云港敦尚镇泥鳅养殖基地,经淮海工学院水产养殖系程汉良教授鉴定为泥鳅(Misgurnus anguillicaudatus),去头、尾和血并洗净,置于-40℃冰箱中冷冻备用。
复合蛋白酶(42300U/g)、复合风味蛋白酶(31800U/g) 诺维信(沈阳)生物加工有限公司;菠萝蛋白酶(14000U/g)、胰蛋白酶(15000U/g)、胃蛋白酶(35000U/g) 广州市齐云生物技术有限公司;ACE(从兔肺提取)、马尿酰-组氨酰-亮氨酸(HHL)、卡托普利 美国Sigma公司;乙腈、三氟乙酸(色谱纯) 美国Fisher公司。
1.2 仪器与设备
日立CR22G高速冷冻离心机 日本Hitach公司;BioLogic DuoFlowTM层析系统 美国Bio-Rad公司;PHS-3C型pH计 上海精宏实验设备有限公司;Waters600高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 泥鳅蛋白酶解工艺流程
鲜活泥鳅→预处理(去头、去内脏、用自来水洗净、沥干)→冷冻备用→解冻→加蒸馏水匀浆→调整酶解条件→酶解→灭酶(沸水浴,10min)→冷却→调pH8.3→离心(10000r/min,30min)→取上清液→-18℃保存或冻干备用
1.3.2 蛋白酶活力测定
采用Folin-酚法,以酪蛋白为底物,参照GB/T 23527—2009《蛋白酶制剂》[15]附录1方法进行测定。
1.3.3 泥鳅蛋白水解度测定
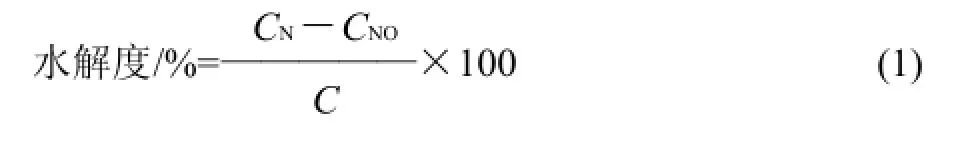
式中:CN为水解液中游离氨基氮的含量/(g/100mL);CNO为鱼糜匀浆水解前游离氨基氮的含量/(g/100mL);C为鱼糜匀浆中总蛋白氮的含量/(g/100mL)。
蛋白质及蛋白氮含量采用凯氏定氮法测定,参照GB5009.5—2010《食品中蛋白质的测定》[16]的方法进行,游离氨基氮含量采用甲醛电位滴定法测定[17]。
1.3.4 水解物ACE 抑制活性的RP-HPLC测定
参照文献[18-20]的方法,并略有改进。ACE、HHL分别用0.1mol/L硼酸钠缓冲液(含0.3mol/L NaCl,pH8.3)配成25mU/mL ACE溶液和8.3mmol/L HHL溶液;马尿酸标准品用超纯水配成5mg/mL的贮存液,使用时稀释成不同浓度的使用液。取25μL样品溶液和75μL HHL溶液混匀,于37℃保温10min,加入50μL ACE溶液,在37℃反应60min后,加入150μL浓度为1mol/L HCl溶液终止反应,10000r/min离心15min,取上清液进行分析,同时用硼酸钠缓冲液代替样品溶液做空白对照。
色谱条件:SunfireTMC18柱(4.6mm×150mm,50μm);洗脱液为15%乙腈+85%水(含0.05%三氟乙酸);流速为1.0mL/min;检测波长为228nm;进样量为20μL;柱温为30℃。按式(2)计算ACE抑制率。
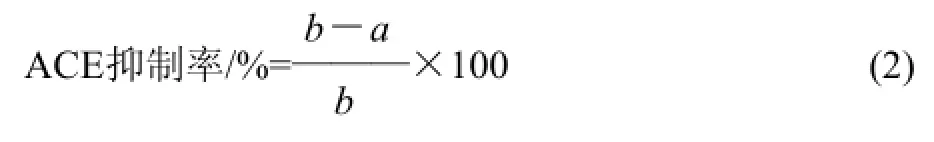
式中:a为样品组马尿酸峰面积;b为对照组马尿酸峰面积。
IC50定义为ACE抑制率达50%时的多肽质量浓度(mg/mL),用SPSS13.0 统计软件的概率单位法(probit)计算。多肽含量采用双缩脲法测定[21]。
1.3.5 酶的筛选
取泥鳅肉10g,加水30mL,按2000U/g pro加酶量分别加入复合风味蛋白酶、复合蛋白酶、菠萝蛋白酶、胰蛋白酶和胃蛋白酶,在上述酶的适宜条件(表1)下进行酶解,以水解度及IC50为指标考察0~240min内(间隔30min)供试酶的水解进程及酶解液对ACE的抑制作用。

表1 供试酶的作用条件Table1 Hydrolysis conditions of proteases tested in this study
1.3.6 泥鳅肉水解物的相对分子质量分布测定
参照文献[22]的方法,采用凝胶层析法测定水解物相对分子质量分布。
2 结果与分析
2.1 蛋白酶的筛选趋
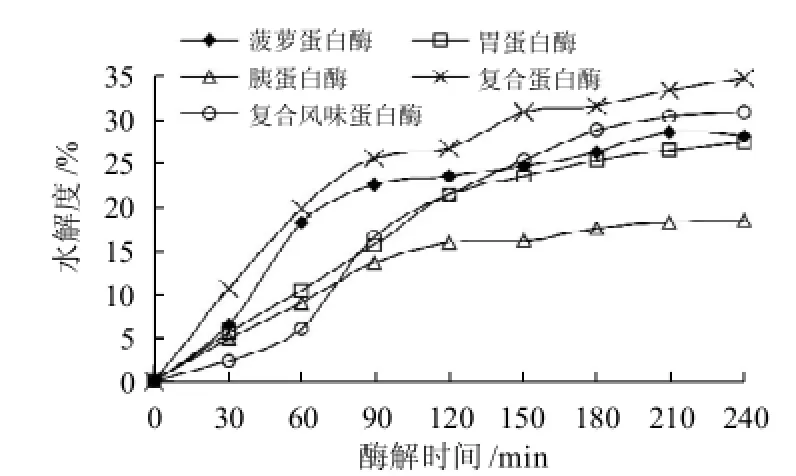
图1 5种供试酶对泥鳅肉的水解进程Fig.1 Hydrolysis courses of loach protein by five proteases
如图1所示,随着酶解时间延长,泥鳅蛋白在不同蛋白酶作用下的水解度逐渐增加,达到150min后增加势变缓。图2显示,未经水解的泥鳅肉匀浆几乎没有ACE抑制活性。经酶水解后,均表现出了一定的ACE抑制活性。其中,复合蛋白酶水解物的ACE抑制活性提高最快,但随着水解程度的不断推进,ACE抑制活性呈现无规律的波动,复合风味蛋白酶也有类似的现象,可能是因为这两种酶制剂为多种酶的复合,水解位点多造成的。在供试的酶中,胃蛋白酶水解物的ACE抑制活性始终较低。菠萝蛋白酶水解物的ACE抑制活性在水解开始后就呈现快速上升的趋势,在120min时达到最大(IC50=0.023mg/mL),随后呈现下降现象。水解度和抑制率之间没有正相关性,这一现象与姚东瑞等[23]的研究结果一致,因此酶的选择及工艺条件的优化在制备功能肽时是非常必要的。菠萝蛋白酶水解物表现出较强的ACE抑制活性,因此选用菠萝蛋白酶用于下一阶段的研究。
2.2 单因素试验
2.2.1 pH值对水解物ACE抑制率的影响
调节pH值为6.0、6.5、7.0、7.5、8.0,其他水解条件为:温度50℃,加酶2000U/g pro,固液比1:3,酶解时间120min,测定酶解液水解度及其对ACE抑制率,结果如图3所示。
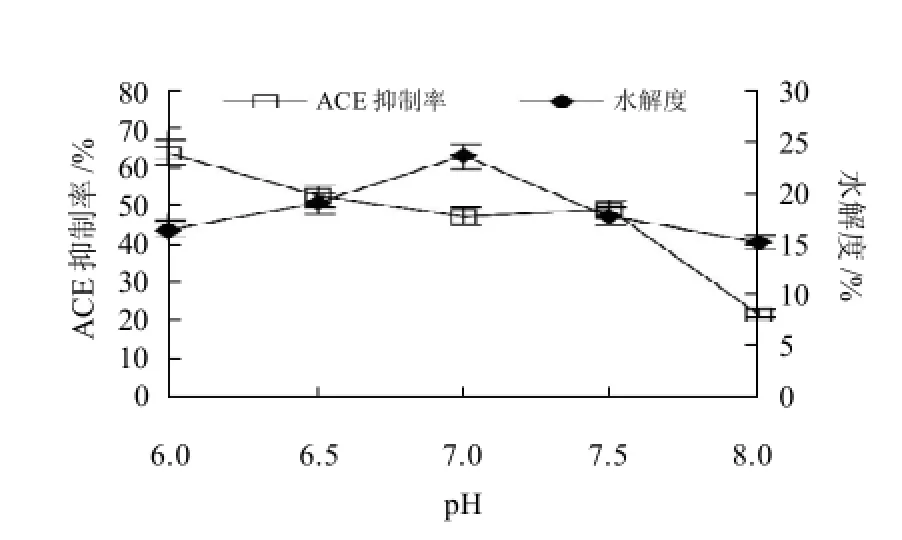
图3 pH值对水解物ACE抑制率的影响Fig.3 Effect of hydrolysis pH on ACE inhibitory rate of loach protein hydrolysates
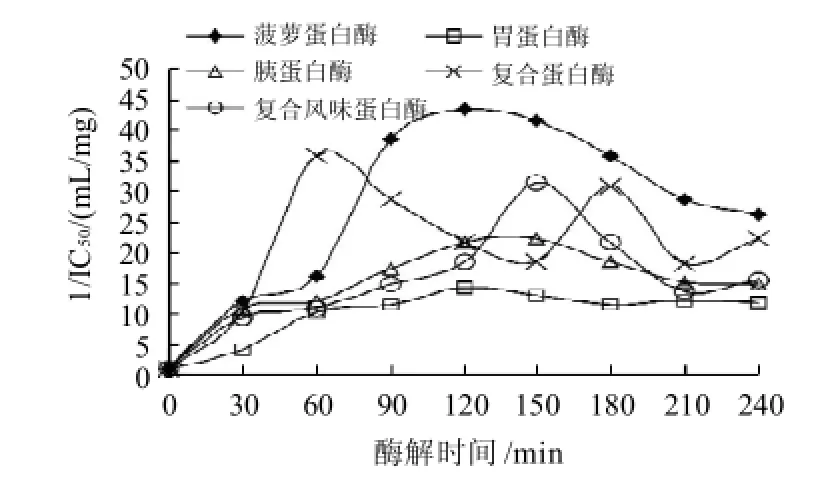
图2 不同蛋白酶水解物对ACE抑制率的影响Fig.2 Effect of protease type on ACE inhibitory rate of loach protein hydrolysates
由图3可见,在试验范围内,随pH值升高ACE抑制率呈下降趋势,而水解度呈现先上升后下降的趋势,水解度与ACE之间出现不一致的现象,水解120min的条件下,pH6时水解物对ACE的抑制活性最高,显然此时酶并非处在最佳的作用pH值。
2.2.2 温度对水解物ACE抑制率的影响
设定酶解温度为40、45、50、55、60℃,pH值为6,其他条件同2.2.1节,测定酶解液水解度及ACE抑制率,结果如图4所示。

图4 温度对水解物ACE抑制率的影响Fig.4 Effect of hydrolysis temperature on ACE inhibitory rate of loach protein hydrolysates
图4显示,温度对水解物的ACE抑制率影响极显著,5℃的波动即可引起ACE抑制率的较大波动,在50℃时达到最大,因此选择50℃作为正交试验优化时的中心水平。
2.2.3 加酶量对水解物ACE抑制率的影响
设定加酶量为500、1000、1500、2000、2500U/g pro,温度50℃,pH6,其他条件同2.2.1节,测定酶解液水解度及其对ACE抑制率,结果如图5所示。
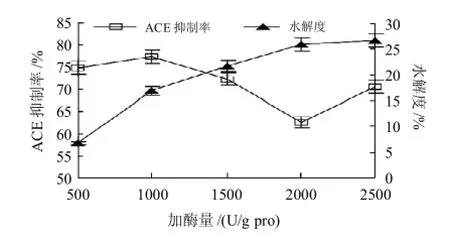
图5 加酶量对水解物ACE抑制率的影响Fig.5 Effect of enzyme dose on ACE inhibitory rate of loach protein hydrolysates
图5显示,水解度随加酶量增加而提高,而ACE抑制率在水解度达到较大值时却降低,水解度最大时的ACE抑制率并非最大,说明肽的大小对其活性的影响是非常重要的,适宜的加酶量为1000U/g pro。
2.2.4 固液比对水解物ACE抑制率的影响
设定固液比为1:1、1:2、1:3、1:4及1:5,其他酶解条件为:加酶量1000U/g pro,pH6.0,在50℃条件下酶解120min,水解度及ACE抑制率变化如图6所示。
图6显示,固液比对水解物的ACE抑制率产生显著的影响,1:4时达到最高,随着固液比的增大,底物浓度变小,水解度及抑制率均呈下降趋势。因此,固液比为1:4是比较适宜的,此时水解度为19.6%。

图6 固液比对水解物ACE抑制率的影响Fig.6 Effect of solid-to-liquid ratio on ACE inhibitory rate of loach protein hydrolysates
2.2.5 酶解时间对ACE抑制率的影响
设定酶解时间为30、60、90、120、150min,固液比1:4,其他条件同2.2.4节,测定酶解液水解度及ACE抑制率,结果如图7所示。

图7 酶解时间对水解物ACE抑制率的影响Fig.7 Effect of hydrolysis duration on ACE inhibitory rate of loach protein hydrolysates
图7显示,90min时水解物的ACE抑制率达到最大。随着酶解时间延长,虽然水解度有所提高,但水解物的ACE抑制率却呈下降趋势。
从单因素试验结果来看,水解度与水解物ACE抑制率大小之间并没有正相关关系,似乎要使ACE抑制率达到最大时,水解度应处在某一水平。这可能是因为活性肽的作用主要取决于肽链中暴露的氨基酸侧链基团的性质和肽的氨基酸序列,同时,水解液的ACE抑制活性是由多种结构的肽提供的,而水解度过高或过低均可能使具有活性结构的肽含量发生变化从而使总的活性降低,这种现象与许庆陵等[24]、黄艳春等[25]的结果是一致的。
2.3 酶解工艺优化
通过SPSS 13.0软件对单因素试验结果进行单因素方差分析和多重比较,结果表明pH值、温度和固液比3个因素对水解物的ACE抑制率有显著影响。根据正交试验设计原理,采用L9(34)正交表设计三因素三水平试验对酶解条件进行优化。正交试验设计及结果分析见表2。
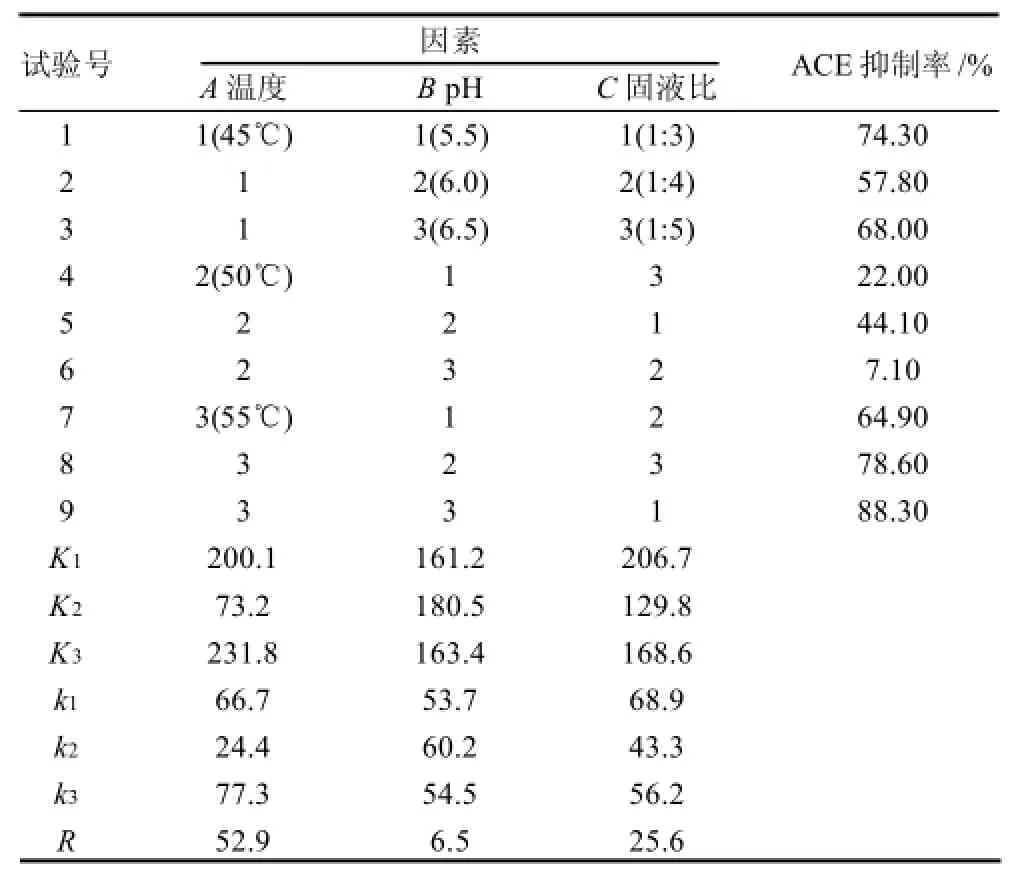
表2 正交试验设计及结果分析Table2 Orthogonal array design and results

表3 正交试验结果方差分析表Table3 Analysis of variance for the experimental results of orthogonal array design
对表2试验结果进行方差分析以确定各因素对试验结果的影响显著性,结果显示(表3),温度对水解物的ACE抑制率影响极显著(P<0.01)、固液比对水解物的ACE抑制率影响显著(P<0.05),而pH值对水解物的ACE抑制率影响不显著(P>0.05)。
表2极差分析结果显示,影响菠萝蛋白酶水解物的ACE抑制率的主次因素顺序是A>C>B,即温度>固液比>pH值,温度对酶解反应的影响最大,固液比次之,pH值的影响最小。因为pH值对ACE抑制率的影响不显著,所以最佳水解条件确定为A3B3C1,即实际水解条件为温度55℃,固液比1:3,pH6.5,时间90min,酶用量1000U/g pro。
2.4 IC50值测定结果
采用最佳酶解条件制备水解物,将冻干后的水解物用超纯水配成5mg/mL的溶液,按5倍稀释为0.000064~5mg/mL的系列质量浓度。以质量浓度的对数为横坐标,抑制率为纵坐标绘制量效关系图,结果见图8。经SPSS 13.0计算(probit模型)得泥鳅肉酶解液ACE抑制率的IC50=0.0184mg/mL。
经优化后,泥鳅蛋白水解物的ACE抑制活性显著提高(IC50由0.023mg/mL降至0.0184mg/mL),说明酶解条件的优化是非常必要的。在相同的条件下测得卡托普利的IC50为0.056μg/mL,泥鳅蛋白水解物的ACE抑制活性虽然低于卡托普利,但与其他食源性肽相比,泥鳅蛋白水解物的ACE抑制活性远高于大豆肽(1.20mg/mL)[26]、银杏蛋白水解物(0.98mg/mL)[18]、乳酪蛋白水解物(0.0528mg/mL)[27],也远高于其他水产源蛋白水解物[28],例如大西洋鲑鱼(Atlantic salmon)、银鲑(coho salmon)、阿拉斯加鳕(Alaska pollock)和南方蓝鳕(southern blue whiting)的IC50分别为5.00、3.70、2.90、3.60mg/mL。因此,菠萝蛋白酶水解泥鳅蛋白制备ACE抑制肽效果是非常好的。

图8 样品质量浓度与ACE抑制率的量效关系图Fig.8 Relationship between mass concentration and ACE inhibitory rate of loach protein hydrolysates
2.5 泥鳅肉水解物的相对分子质量分布
2.5.1 标准曲线
测定水解物相对分子质量分布的Sephadex G-15凝胶柱参数为V0=17.95mL,Vt=39.94mL。由各标准品的保留时间计算出相应的Ve,进而计算出有效分配系数Kav,制作标准曲线,得标准曲线回归方程为y=-1.2895χ+4.3499,R2=0.9978。
2.5.2 泥鳅肉水解物的相对分子质量分布及ACE抑制率
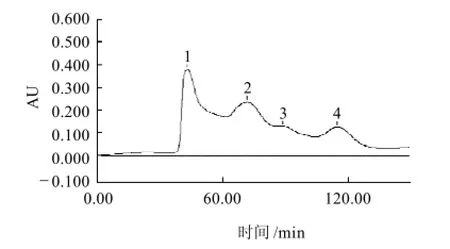
图9 泥鳅肉酶解液Sephadex G-15层析图Fig.9 Sephadex G-15 gel filtration chromatogram of loach protein hydrolysates
图9、10显示,水解物中不同相对分子质量的肽段均具有一定的ACE抑制活性,但活性高低差别很大,主要活性肽的相对分子质量在924左右,而其他组分的ACE抑制活性相对较弱。这种现象可能是因为ACE是一类专一性相对较弱的酶,在蛋白质经酶解后获得的多肽中,存在着多种ACE抑制肽类物质,这些ACE抑制肽并非是简单的有或无[24-25]。
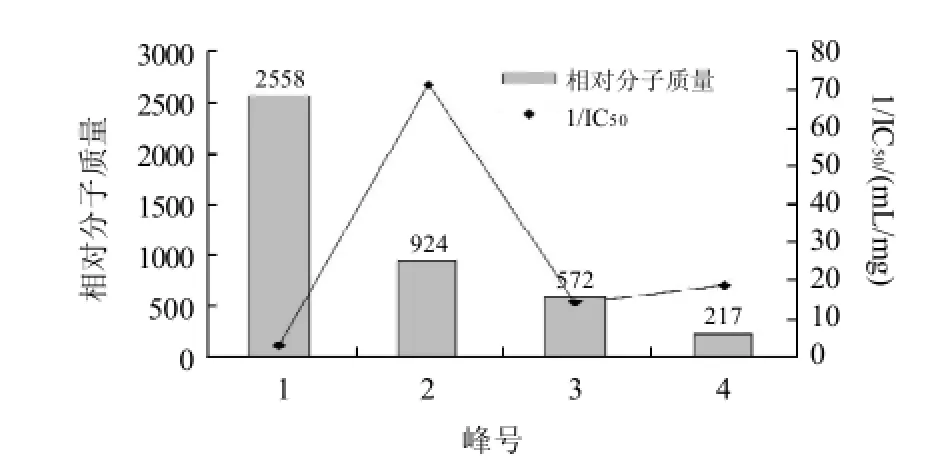
图10 各分离组分的相对分子质量和ACE抑制活性Fig.10 Relative molecular mass and ACE inhibitory rate of each fraction separated by from loach protein hydrolysates Sephadex G-15 gel filtration chromatography
3 结 论
3.1 通过对泥鳅肉酶解进程及ACE抑制作用的研究发现,水解度与ACE抑制活性之间没有正相关性,选择适合的酶及酶解条件的优化可能是酶法制备ACE抑制肽的关键。
3.2 菠萝蛋白酶是一种比较适合于酶解泥鳅肉制备具有ACE抑制活性的活性肽水解酶,在最优条件下制备的水解物具有很高的ACE抑制活性。
3.3 经正交试验优化的最佳酶解条件为:温度55℃,固液比1:3,pH6.5,时间90min,酶用量1000U/g pro,在该条件下水解物对ACE抑制率的IC50为0.0184mg/mL。水解液中活性肽的相对分子质量主要集中在924左右。
[1]OTTE J, SHALABY S M A, ZAKORA M, et al. Fractionation and identification of ACE-inhibitory peptides from α-lactalbumin and βcasein produced by thermolysin-catalysed hydrolysis[J]. International Dairy Journal, 2007, 17: 1460-1472.
[2]王金玲, 李恒星, 董晓美, 等. 酶解法生产降血压肽的水产蛋白原料筛选研究[J]. 中国食品学报, 2009, 9(3): 111-116.
[3]王瑛瑶, 王璋, 陈尚卫. 花生ACE 抑制活性肽的分离纯化与结构鉴定[J]. 食品科学, 2008, 29(10): 341-344.
[4]RAGHAVAN S, KRISTINSSON H G. ACE-inhibitory activity of tilapia protein hydrolysates[J]. Food Chemistry, 2009, 117: 582-588.
[5]CHIANG W D, TSOU M J, TSAI Z Y, et al. Angiotensin I-converting enzyme inhibitor derived from soy protein hydrolysate and produced by using membrane reactor[J]. Food Chemistry, 2006, 98: 725-732.
[6]WU Hao, HE Hailun, CHEN Xiulan, et al. Purification and identification of novel angiotensin-I-converting enzyme inhibitory peptides from shark meat hydrolysate[J]. Process Biochemistry, 2008, 43: 457-461.
[7]WANG Jiapei, HU Jianen, CUI Jinzhe, et al. Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats [J]. Food Chemistry, 2008, 111: 302-308.
[8]LEE S H, QIAN Z J, KIM S K. A novel angiotensin I converting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J]. Food Chemistry, 2010, 118: 96-102.
[9]钦传光, 黄开勋, 徐辉碧. 泥鳅中的生物活性分子及其药理作用[J].中国生化药物杂志, 2002, 23(1): 47-48.
[10]YOU Lijun, ZHAO Mouming, CUI Chun, et al. Effect of degree of hydrolysis on the antioxidant activity of loach (Misgurnus anguillicaudatus) protein hydrolysates[J]. Innovative Food Science and Emerging Technologies, 2009 10: 235-240.
[11]凌先. 泥鳅的食用价值与药用价值[J]. 种养门诊, 2009, 16(5): 116.
[12]赵振山, 高贵琴, 印杰, 等. 泥鳅和大鳞副泥鳅营养成分分析[J]. 水利渔业, 1999, 19(2): 16-17.
[13]刘孝华. 泥鳅的生物学特性及养殖技术[J]. 湖北农业科学, 2008, 47 (1): 93-95.
[14]GUO Yuxin, PAN Daodong. Optimisation of hydrolysis conditions for the production of the ACE inhibitory peptides from whey protein using response surface methodology[J]. Food Chemistry, 2009, 114: 328-333.
[15]诺维信(中国)生物技术有限公司, 张家港市金源生物化工有限公司,中国食品发酵工业研究所, 等. 蛋白酶制剂[S]. 北京: 中国标准化出版社, 2009.
[16]卫生部食品卫生监督检验所. GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[17]候曼玲. 食品分析[M]. 北京: 化学工业出版社, 2004: 128-129.
[18]刘宁, 仇农学, 朱振宝, 等. 杏仁蛋白水解物对血管紧张素转化酶抑制作用的研究[J]. 食品科学, 2009, 30(5): 249-252.
[19]刘宁, 仇农学. 碱性蛋白酶Alcalase水解杏仁蛋白制备ACE抑制肽[J]. 农产品加工: 学刊, 2009(3): 149-152.
[20]朱迎春, 许小琴, 马俪珍. 鲶鱼骨酶解物的降血压肽活性研究[J]. 青岛农业大学学报: 自然科学版, 2009, 26(1): 61-65.
[21]徐娟, 吕嘉枥. 乳蛋白水解液中多肽含量测定方法的研究[J]. 食品科技, 2010, 35(12): 275-277.
[22]盘赛昆, 顾小红, 汤坚, 等. 鲤鱼肉酶解物清除羟自由基的研究[J].食品研究与开发, 2009, 30(9): 23-27.
[23]姚东瑞, 王淑军, 李圆圆, 等. 泥鳅肉酶解物对羟自由基的清除作用[J]. 食品科学, 2010, 31(21): 29-34.
[24]许庆陵, 曾庆祝. 血管紧张素转换酶(ACE)抑制肽的酶法制备[J]. 广州大学学报: 自然科学版, 2007, 6(6): 41-44.
[25]黄艳春, 熊善柏, 赵思明, 等. 鲢肉酶解工艺及其产物对大鼠ACE抑制活性的研究[J]. 食品科学, 2006, 27(1): 203-206.
[26]吴建平, 丁霄霖. 大豆降血压肽的研制(I): 生产高活性ACE I肽酶系的筛选[J]. 中国油脂, 1998, 23(2): 49-51.
[27]MIGUEL M, CONTRERAS M M, RECIO I, et al. ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J]. Food Chemistry, 2009, 112: 211-214.
[28]NAKAJIMA K, YOSHIE-STARK Y, OGUSHI M. Comparison of ACE inhibitory and DPPH radical scavenging activities of fish muscle hydrolysates[J]. Food Chemistry, 2009, 114: 844-851.
Preparation of ACE Inhibitory Peptides by Bromelain Hydrolysis of Loach (Misgurnus anguillicaudatus) Protein
YAO Dong-rui,PAN Sai-kun,ZHOU Ming-qian,WANG Shu-jun,HU Jin-ling
(School of Food Engineering, Huaihai Institute of Technology, Lianyungang 222005, China)
The present deals with the enzymatic preparation of angiotensin-converting enzyme (ACE) inhibitory active peptides from loach (Misgurnus anguillicaudatus) protein. An L9(34) orthogonal array design methods based on single factor experiments was used to optimize the hydrolysis conditions for achieving maximum ACE inhibitory activity of loach protein hydrolysates. HPLC was used to determine ACE inhibitory activity of loach protein hydrolysates. Bromelain was found to be more suitable to prepare ACE inhibitory active peptides than trypsin, pepsin, flavourzyme and protamex. The optimal hydrolysis conditions were temperature of 55 ℃, solid-to-liquid ratio of 1:3, pH of 6.5, bromelain dose of 1000 U/g protein and hydrolysis duration of 90 min. The IC50 of the loach protein hydrolysate obtained under these conditions was 0.0184 mg/mL and the relative molecular weight distribution of ACE inhibitory peptides in it was mainly concentrated around 924.
Misgurnus anguillicaudatus;enzymatic hydrolysis;antihypertensive activity;angiotensin I-converting enzyme (ACE);bromelain
Q819
A
1002-6630(2012)01-0180-06
2011-05-04
江苏省农业科技自主创新基金项目(CX09-627;CX10-328);连云港市科技基础设施建设计划项目(CK0935);江苏省科技支撑计划(农业)项目(BE2010399)
姚东瑞(1966—),男,教授,博士,研究方向为水产品加工及渔业经济。E-mail:yao-dr@hhit.edu.cn
