超细氧化亚铜的制备及在污水处理中的光催化应用
2012-04-01张传波孙瑶瑶翟爱霞
张传波,孙瑶瑶,翟爱霞
(1.柳州市环境保护局,广西 柳州 545006;2.武汉工业学院,湖北 武汉 430023)
工业污水中含有卤代脂肪烃、卤代芳烃、多环芳烃、染料、农药等多种有害有机成分,对人体健康构成严重的威胁[1~2]。传统的污水处理只是将污染物分离或浓缩,或者只是将污染物从一相转移到另一相,通常会不可避免地带来大量的废料和二次污染。近年来有关污水的处理已转向高级氧化处理法——光催化法。
目前应用最广的光催化剂为TiO2[5~6],TiO2的能带隙为3.12eV,只有波长小于388nm的紫外光辐射才能使TiO2产生电子-空穴对,但在太阳光谱中紫外光(400nm以下)不到5%,为了有效地利用太阳光,研究在可见光下具有高效光催化活性的催化剂势在必行。
Cu2O是一种对可见光响应的P型半导体材料,Cu2O能级差约为2.0eV,完全可在太阳光的辐射下引发光催化反应。自从1998年,Ikeda等[7]宣布用Cu2O作光催化剂可在阳光下将水分解成氢气和氧气以来,Cu2O在可见光下的催化性能成为研究的热点,其应用于污水处理方面已有报道[8~11]。此外,铜元素在地球上含量丰富,氧化亚铜生产成本低且无毒,Cu2O必将成为继TiO2后应用前景最广的光催化剂。本实验采用自制的Cu2O处理台盼蓝溶液,考察台盼蓝在不同工艺条件下的脱色率。
1 实验部分
1.1 主要试剂
实验中所用的硫酸铜、葡萄糖、氢氧化钠、水合肼(80%)、台盼蓝、无水乙醇均为分析纯,所有试剂均没有进一步纯化。
1.2 氧化亚铜的合成
将6.13g的硫酸铜和12g的氢氧化钠分别溶于100mL水中,取3g葡萄糖加入250mL烧瓶中,将溶解的硫酸铜和氢氧化钠加入到烧瓶中,溶液由蓝色变为深蓝色。调节反应温度为20℃,在不断搅拌的条件下加入0.6mL水合肼,一直反应到溶液完全变为红色为止。反应结束后,自然沉降分离,然后分别用去离子水和无水乙醇洗涤4次。50℃真空干燥得到超细Cu2O,待用。
1.3 氧化亚铜光催化性能研究
取一定体积的台盼蓝溶液加入一定量的Cu2O,控温进行脱色处理,脱色处理后,离心分离取上层清液用可见光分光光度计在595nm进行检测,计算台盼蓝的脱色率。为减小误差,太阳光照条件尽量一致,并做3次平行实验,取其平均值。
1.4 分析方法
利用扫描电镜(SEM)和X衍射仪(XRD)对Cu2O进行表征。
采用可见分光光度计在最大波长下(595nm)测定溶液的吸光度,用脱色率来定量表示Cu2O处理染料的能力,台盼蓝溶液处理前后的吸光度之间的关系为:
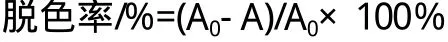
式中:A0-未经处理的染料溶液的吸光度;
A-脱色处理后溶液的吸光度。
2 结果及讨论
2.1 氧化亚铜的表征
根据1.2制备的氧化亚铜的表征如图1所示。

图1 氧化亚铜的SEM图和XRD图谱Fig.1 The SEM image and XRDpattern of cuprous oxide
由图1(a)可看出制备的颗粒为粒径约1μm的类球形,且分散比较均匀。由图1(b)可以看出,产品在衍射角度 2θ分别为 29.66°,36.54°,42.41°,61.59°,73.73°处有强吸收峰,这和标准谱库氧化亚铜立方晶体谱图(JCPDS 05-667)一致,证明产物为Cu2O。图1(b)中可看出其他杂质的衍射峰很弱,证明氧化亚铜的纯度较高。
2.2 温度对脱色率的影响
各取40mL的15mg·L-1的台盼蓝溶液分别在10℃,20℃,30℃,40℃,50℃下加入 0.2g Cu2O,太阳光照150min后测定其脱色率,结果如图2所示。

图2 反应温度对脱色率的影响Fig.2 The effect of reaction temperature on decolorization rate
由图2可看出,随着温度的升高,台盼蓝溶液的脱色率先增加后减小。这是因为在光催化降解过程中涉及的反应可能如下[14]:
(1)样品 + hυ→ h++ e-
(2)e-+ O→ O-22
(3)O2-+ 2H2O+ e-→ H2O2+ 2OH-
(4)H2O2+ e-→·OH + OH-
(5)有机物 +·OH + O2→ CO2+ H2O +其它产物
日光照射后,Cu2O价带上的电子吸收光能转移至较高能级的导带上,而空穴则留在能级较低的价带上,但是在Cu2O光催化体系中,Cu2O的价带空穴电位低于H2O 的氧化电位,因此不能将H2O氧化生成·OH。但Cu2O有很强的吸附分子氧的能力,Cu2O表面的电子能将吸附的O2转变为O2-,O2-进一步与水和电子作用生成H2O2和·OH。羟基自由基( ·OH)具有很强的氧化性,可以将有机污染物氧化成无机物。
当处理台盼蓝的温度较高时,价带上的电子更容易被激发跃过禁带进入导带,并在价带上形成相应的空穴(h+),最终生成具有高活性的超氧负离子(O2-)和强氧化性羟基自由基( ·OH),更有利于光催化降解,如图2的10~30℃区间。但温度过高时,电子运动更加无规则,反而抑制光催化降解。
2.3 光照时间对脱色率的影响
取40mL的15mg·L-1的台盼蓝溶液在30℃下加入0.2g Cu2O,考察太阳光照时间对台盼蓝脱色率,结果如图3所示。

图3 光照时间对脱色率的影响曲线Fig.3 The effect of reaction time on decolorization rate
从图3可看出,刚开始台盼蓝的脱色率随着光照时间的延长而增加,在光照时间为150min时基本稳定,脱色率最高达96.7%。这可能是由于电子在光照下不断被催化剂表面的溶解氧分子俘获,最终生成具有高活性的超氧负离子(O2-)和强氧化性物质羟基自由基( ·OH),·OH具有很强的氧化性能将染料氧化,达到光催化降解的目的[15]。Cu2O的氧化作用打断了染料的生色基(-N=N-),并使助色基脱落,使染料失去了显色能力。随着光催化时间的增长,电子不断被溶解氧捕获,脱色率逐渐增加。150min后,电子捕获基本结束,脱色率达到稳定。
2.4 催化剂用量对脱色率的影响
取0.2g Cu2O分别加入到15mg·L-1不同体积的台盼蓝溶液中,在30℃下,光催化降解150min后,台盼蓝的脱色率如图4所示。
由图4可看出随着催化剂加入量的增加其脱色率先增加后减小。0.2g Cu2O加入到50mL的溶液中时,脱色率最高达98.8%,最佳固液比为4g·(L溶液)-1。这主要是因为台盼蓝溶液多时,催化剂用量不足,色度去除不理想;台盼蓝溶液少时,催化剂过多,过多Cu2O粒子产生光散射现象,使得有效光强降低,溶液底部的催化剂对光的利用率降低导致整个催化效果下降。由这个结论可推测,当有效光强增加时,催化剂的投量可相应增加。

图4 催化剂用量对脱色率的影响Fig.4 The effect of catalyst dosage on decolorization rate
2.5 初始物浓度对脱色率的影响
分别取浓度为 5 mg·L-1、15 mg·L-1、25 mg·L-1、35mg·L-1、45mg·L-1的台盼蓝溶液40mL置于反应器中,在30℃下分别加入0.2g的Cu2O,在搅拌和太阳光照条件下催化150min,结果如图5所示。

图5 台盼蓝初始浓度对脱色率的影响Fig.5 The effect of initial concentration of typan blue on decolorization rate
由图5可看出,脱色率在浓度5~15mg·L-1之间逐渐增加,而过了15mg·L-1之后逐渐降低。在初始物浓度为15mg·L-1时脱色率达到最大,达到96.7%。这可能是因为在初始物浓度较低时,Cu2O的用量相对多,过多氧化亚铜粒子产生了光散射作用,使有效光强度降低,进而使得脱色率较低。随着初始物浓度的增大,Cu2O的用量和台盼蓝量趋于平衡,在台盼蓝初始浓度为15mg·L-1时,脱色率达到最大。随着初始溶液浓度的进一步增加,Cu2O的用量相对少,脱色率降低。因此在初始物浓度较高时,可适当增加Cu2O的用量以提高脱色效果。
2.6 催化剂稳定性
取40mL的15mg·L-1的台盼蓝溶液在30℃下加入0.2g Cu2O太阳光照150min后测其脱色率,离心处理后将Cu2O回收,再将同样的台盼蓝溶液加入到反应容器重复测试Cu2O的脱色效果,结果如表1所示。

表1 催化剂使用次数对脱色率的影响Tab.1 The effect of reuse of catalyst on decolorization rate
由表1可看出,Cu2O重复使用后,脱色率逐渐下降,但并不明显,在使用4次后,其对台盼蓝溶液脱色率为87.8%,表明氧化亚铜光催化剂具有较高稳定性。
3 结论
本文采用水合肼在碱性条件下还原硫酸铜制得平均粒径为1μm的超细Cu2O颗粒。0.2g Cu2O在30℃太阳光照条件下催化50mL(15mg·L-1)的台盼蓝溶液具有最佳效果,最佳脱色率为98.8%。催化剂在使用4次后,脱色率保持在87%以上。
[1] 傅送保,李惠友,朱泽华.环己烷氧化废碱液酸化污水处理研究[J].化工进展,2004,23(2):211-215.
[2] 王秀兰,罗阳,郭斌.河北省水工程质量状况调查及污水危害机理分析[J].河北水利水电技术,2001(4):15-l6.
[3] Wexler D, Calka A, Mosbah A Y. Microstructure and properties of Ti-Ti Nin-situ composites prepared by reactive ball milling of Ti in ammonia followed by hot pressing [J].Materials Science Forum, 2000(33):343-346.
[4] 陈金毅,刘小玲,李闾轮,等.纳米氧化亚铜可见光催化分解亚甲基蓝[J]. 华中师范大学学报(自然科学版),2002(2):200-203.
[5] 卢俊彩,陈火林,李首建.改性纳米二氧化钛的制备及其对硝基苯废水的光催化降解[J].西南大学学报,2009,31(9):116-118.
[6] 谭怀琴,全学军,赵清华,等.二氧化钛光催化技术研究发展[J].重庆工学院学报,2005,19(3):80-83.
[7] Ikeda S, Takata T, Kondo T, et al. Mechano-catalytic overall water splitting [J].Chemical Communication, 1998,20(2):2185-2191.
[8] 何星存,梁伟夏,黄智,等.可见光响应的“Cu核-Cu2O壳”型光催化剂性能的研究[J].现代化工,2005,25(11):38-41.
[9] 梁宇宁,黄智, 覃思晗,等. Cu2O光催化降解水中对硝基苯酚的研究[J].环境污染治理技术与设备,2003(10):36-39.
[10] 李晓勤,方涛,罗永松,等.电解法制备纳米Cu2O及其光催化性能的研究[J]. 化学通报,2006(14):290-293.
[11] 刘小玲,陈金毅,周文涛,等.纳米氧化亚铜太阳光催化氧化法处理印染污水[J].华中师范大学(自然科学版),2002,36(4):475-477.
[12] Huaming Y, Jing Ouyang, Aidong T, et al.Electrochemical synthesis and photocatalytic property of cuprous oxide nanoparticles [J]. Materials Research Bulletin,2006(41):1310-1318.
[13] 肖国林,张喜、艾智慧,等.微波法制备氧化亚铜微球及其光催化降解甲基橙的研究[J].华中师范大学学报(自然科学版),2009,43(2):255-259.
[14] Zhao K Z, Huang B B, Wang Z Y, et al. Crystal Faces of Cu2O and Their Stabilities in Photocatalytic Reactions [J]. J Phys Chem C 2009(113):14448-14453.
[15] Huang Y, Ju X. Study on photocatalytic degradation of organic pollutants in water by using nanometer titanium dioxide [J]. Modern Chemical Industry, 2001,21(4):45-48.
