磷酸化STAT3和Bcl-2在子宫内膜异位症的表达及相互关系
2012-03-27孟津赵敏金海红陈燕
孟津 赵敏 金海红 陈燕
子宫内膜异位症(EMs)是一种育龄女性常见病,严重影响患者生活质量。目前发病机制不明,治疗后复发率高。“在位内膜决定论”指出:子宫内膜碎片必须经黏附、侵袭、血管形成,方可生存、生长,并引起病变和症状[1]。这一过程的完成是以不同在位内膜的不同生物学特性、甚至基因差异为基础。信号传导和转录激活因子3(STAT3)广泛参与肿瘤的侵袭转移、血管发生、凋亡抵抗和免疫逃避等,可能在EMs的发病中发挥重要作用。磷酸化STAT3(P-STAT3)是STAT3的活化形式。B细胞淋巴瘤/白血病-2(Bcl-2)是STAT3重要的靶基因,也是重要的抗凋亡基因之一,与EMs的发生发展有密切关系。本实验采用免疫组化SP法研究P-STAT3和Bcl-2在EMs的在位内膜、异位内膜中的表达,分析它们在不同内膜组织中表达的相关性,探讨两者在EMs发病中的作用。
1 资料与方法
1.1 一般资料 研究组:选取秦皇岛市第一医院妇科2008年1月至2011年1月手术及病理证实的EMs患者40例,包括增殖期23例,分泌期17例。患者年龄23~46岁,平均年龄(38±5)岁,平均体重指数(23.2 ±2.4)kg/cm2。采用 1985 美国生育协会的EMs分期标准(r-AFS):Ⅰ期3例,Ⅱ期8例,Ⅲ期12例,Ⅳ期17例。术中取得在位内膜和异位内膜标本各40例。对照组:正常子宫内膜标本40例,包括增殖期25例,分泌期15例,年龄27~49岁,平均年龄(38±5)岁,平均体重指数(22.9±2.5)kg/cm2。2组间年龄和体重指数差异无统计学意义(P>0.05)。全部患者月经规律,除外妊娠、哺乳期女性,无恶性肿瘤及其他内科外科、妇科合并症,术前6个月内未接受激素治疗。
1.2 主要试剂 兔抗人P-STAT3多克隆抗体购自美国CST公司。鼠抗人Bcl-2单克隆抗体、即用型快速免疫组化MaxVisionTM检测试剂盒及DAB显色剂购自福州迈新生物技术有限公司。
1.3 方法 标本经10%中性甲醛固定,常规石蜡包埋,制成4μm厚连续切片。经常规脱蜡、脱苯、封闭内源性过氧化物酶及抗原修复等步骤,按照试剂盒说明书行免疫组化SP染色,中性树胶封片后置于显微镜下观察。PBS液代替一抗作为阴性对照。
1.4 结果判断 P-STAT3结果判定以子宫内膜腺上皮细胞的细胞核着色为阳性细胞,Bcl-2结果判定以子宫内膜腺上皮细胞的细胞浆着色为阳性。参照Fromowitz等[2]的半定量积分法,以染色强度和染色范围进行结果判定。染色强度分为:不染色0分;淡黄色1分;黄色2分,棕黄色3分。染色范围:随机选取10个具有代表性的高倍镜视野(×400),每视野计数100个腺上皮细胞,按照阳性细胞百分率分为:0~5%计0分,6%~25%计1分,26% ~50%计2分,51% ~75%计3分,>75%计3分。每张切片的两分数相加计算总分:0~2分为阴性(-),3分为弱阳性(+),4分为阳性(++),5~7分为强阳性(+++)。
1.5 统计学分析 应用SPSS 13.0统计软件,采用t检验、检验χ2非参数Wilcoxon W检验、McNemar检验、Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 P-STAT3的表达 P-STAT3蛋白在对照组和研究组在位及异位内膜中均主要表达在腺上皮细胞的细胞核,间质也有少量表达。组间比较:P-STAT3蛋白的表达强度在研究组在位内膜高于对照组,且增殖期和分泌期的表达强度均高于同期对照组;在研究组异位内膜高于在位内膜和对照组,且增殖期和分泌期的表达强度均高于同期的在位内膜和对照组,差异均有统计学意义(P<0.05)。同组增殖期与分泌期比较:P-STAT3蛋白的表达强度在对照组分泌期高于增殖期,差异有统计学意义(P<0.05)。在研究组在位内膜和异位内膜的表达强度,增殖期与分泌期比较均差异无统计学意义(P>0.05)。见表1、图1~3。

表1 P-STAT3在不同子宫内膜中的表达 例
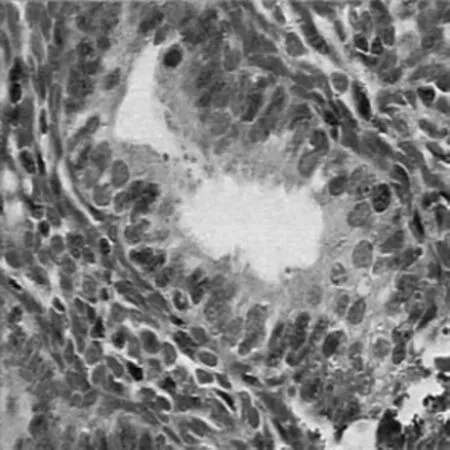
图1 P-STAT3在对照组子宫内膜的阳性表达(SP×400)

图2 P-STAT3在研究组在位内膜的阳性表达(SP×400)

图3 P-STAT3在研究组异位内膜的阳性表达(SP×400)
2.2 BCL-2的表达 Bcl-2蛋白在对照组子宫内膜和研究组在位及异位内膜中均主要表达在腺上皮细胞的细胞浆中,基质中也有表达。组间比较:Bcl-2蛋白的表达强度在研究组在位内膜高于对照组,且增殖期和分泌期的表达强度均高于同期对照组;Bcl-2蛋白的表达强度在研究组异位内膜高于在位内膜和对照组,且增殖期和分泌期的表达强度均高于同期的在位内膜和对照组,差异均有统计学意义(P<0.05)。同组增殖期与分泌期比较:Bcl-2蛋白的表达强度在对照组和研究组在位内膜中增殖期高于分泌期,差异有统计学意义(P<0.05)。在研究组异位内膜中的表达强度,增殖期与分泌期比较均差异无统计学意义(P>0.05)。见表2、图4。
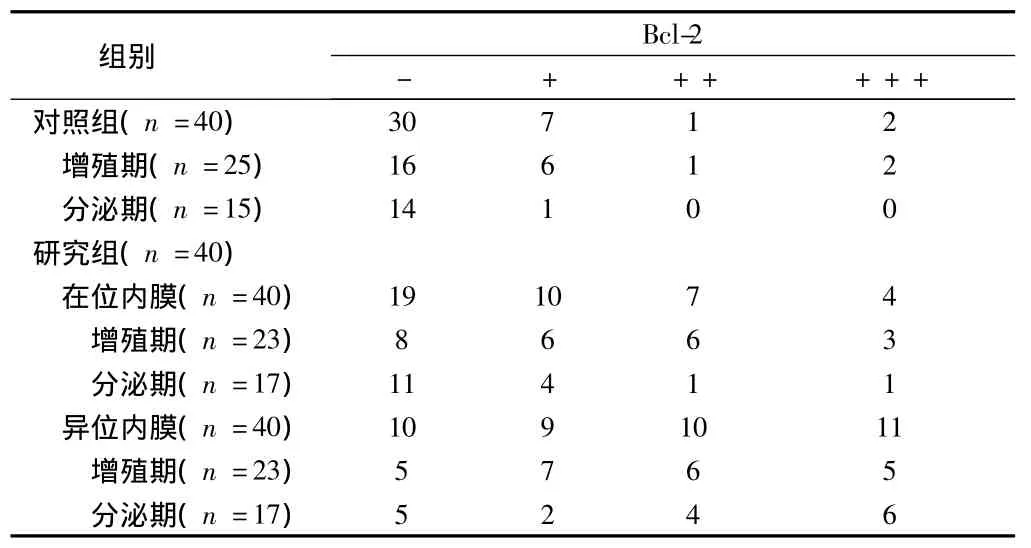
表2 Bcl-2在不同子宫内膜中的表达 例

图4 Bcl-2在研究组在位内膜中的阳性表达(SP法×100)
2.3 STAT3与Bcl-2表达的相关性分析 研究组在位内膜的增殖期中P-STAT3和Bcl-2的表达强度呈正相关(r=0.89,P=0.00),分泌期中P-STAT3和Bcl-2的表达强度呈正相关(r=0.87,P=0.00);研究组异位内膜的增殖期中 P-STAT3和Bcl-2的表达强度呈正相关(r=0.94,P=0.00),分泌期中 PSTAT3和 Bcl-2的表达强度呈正相关(r=0.98,P=0.00)。对照组的增殖期中P-STAT3和Bcl-2无相关性(P=0.06);分泌期中P-STAT3和Bcl-2的表达强度无相关性(P=0.17)。
3 讨论
3.1 STAT3与EMs的关系 STAT3是重要的癌基因,其过度激活与肿瘤的异常增生、侵袭转移、凋亡抵抗、血管发生和免疫抑制等密切相关。而异位内膜类似肿瘤的生物学行为是EMs发病的关键[3]。STAT3可能通过参与凋亡抵抗、血管生成、侵袭转移和免疫逃避等途径参与EMs发病。
3.1.1 P-STAT3在正常子宫内膜的表达和意义:Dimitriadis等[4]认为,P-STAT3免疫反应性在月经周期的分泌期最大化,在分泌中期子宫内膜容受囊胚植入时达峰值。本研究表明,PSTAT3在分泌期的表达高于增殖期,支持STAT3参与子宫内膜蜕膜化的观点。
3.1.2 P-STAT3在 EMs的表达和意义:本研究发现,P-STAT3在在位及异位内膜中均主要表达在腺上皮细胞的细胞核,与正常子宫内膜中的表达一致[4]。P-STAT3在在位和异位内膜中高表达,且与月经周期不同时相无关,表明P-STAT3的异常可能是EMs的发病原因。P-STAT3在在位内膜中高表达,且在在位和异位内膜中都失去周期性变化,提示在位内膜参与EMs发病,并可能是其中关键,这符合“在位内膜决定论”的观点。研究同时发现,P-STAT3在异位内膜中高表达,与月经周期不同时相无关。提示在位内膜的变化可能不是引发EMs的唯一原因,腹腔内环境的改变很可能也参与其中,这与Ryan等[5]的观点相符。
3.2 Bcl-2与EMs的关系 凋亡在EMs发生发展中的作用日益受到重视。Bcl-2是重要的抗凋亡基因,其异常表达可能通过改变子宫内膜的正常凋亡促成EMs发病。
3.2.1 Bcl-2在正常子宫内膜的表达和意义:本研究发现,Bcl-2在正常子宫内膜中主要表达在腺上皮细胞的细胞浆,增殖期的表达高于分泌期。这与Gompel等[6]的研究结果一致,提示其参与调控子宫内膜的周期性改变。
3.2.2 Bcl-2在EMs的表达和意义:本研究发现,Bcl-2在在位和异位内膜中均主要表达在腺上皮细胞的细胞浆,与在正常子宫内膜的表达一致。Bcl-2在在位和异位内膜中高表达,且与月经周期不同时相无关。Bcl-2在在位内膜中的表达增殖期高于分泌期,在异位内膜中失去周期性变化。这与Watanabe等[7]的研究结果一致,提示Bcl-2的异常可能参与EMs发病。本研究表明,Bcl-2在异位内膜中的表达高于在位内膜,并失去周期性变化,提示在位内膜中Bcl-2的变化可能参与子宫内膜的发病,但腹腔内环境的改变进一步影响Bcl-2的表达,并可能最终促成EMs的发生。
3.3 EMs的在位内膜和异位内膜中STAT3与 Bcl-2表达的关系 本研究表明,P-STAT3和Bcl-2在不同月经周期的正常子宫内膜中的表达强度不相关,而在不同月经周期的在位和异位内膜中分别呈正相关。提示上调Bcl-2的表达是STAT3促进EMs发病的可能途径。
综上所述,P-STAT3和Bcl-2在EMs的发病中发挥重要作用。STAT3通路通过对Bcl-2的调控改变子宫内膜的正常凋亡是其参与EMs发病的可能方式之一,与腹腔内环境中基因的变化共同促成EMs的发生。
1 郎景和.子宫内膜异位症研究的新里程.中华妇产科杂志,2005,40:3-4.
2 Fromowitz FB,Viola MV,Chao S,et al.Ras p21 expression in the progression of breast cancer.Hum Pathol,1987,18:1268-1275.
3 Harada T,Taniguchi F,Izawa M,et al.Apoptosis and endometriosis.Front Biosci,2007,12:3140-3151.
4 Dimitriadis E,Stoikos C,Tan YL,et al.Interleukin 11 signaling components signal transducer and activator of transcription 3(STAT3)and suppressor of cytokine signaling 3(SOCS3)regulate human endometrial stromal cell differentiation.Endocrinology,2006,147:3809-3817.
5 Ryan IP,Taylor RN.Endometriosis and infertility:new concepts.Obstet Gynecol Surv,1997,52:365-371.
6 Gompel A,Sabourin JC,Martin A,et al.Bcl-2 expression in normal endometrium during the menstrual cycle.Am J Pathol,1994,144:1195-1202.
7 Watanabe H,Kanzaki H,Narukawa S,et al.Bcl-2 and Fas expression in eutopic andectopic human endometrium during the menstrual cycle in relation to endometrial cell apoptosis.Am J Obstet Gynecol,1997,176:360-368.
