小剂量脂多糖诱导血管内皮细胞TLR4的表达
2012-03-27常文秀曹书华王勇强高红梅
路 玲,常文秀,曹书华,王勇强,高红梅
小剂量脂多糖诱导血管内皮细胞TLR4的表达
路 玲,常文秀,曹书华,王勇强,高红梅
目的:观察小剂量脂多糖(LPS)对人脐静脉内皮细胞(ECV304)TOLL样受体4(TLR4)表达的影响。方法:体外培养ECV304细胞,分别与LPS及LPS+TLR4抗体进行孵育。MTT法检测细胞的增殖活性,免疫组化染色法检测细胞表面TLR4的表达,实时荧光定量聚合酶链反应(RT-PCR)检测细胞核核内TLR4-mRNA及IL-8mRNA的表达。结果:LPS(10~50ng/ mL)刺激ECV304细胞24h内,细胞增殖活性无明显变化(P>0.05);而以100ng/mL刺激24h后,细胞增殖活性明显降低(P<0.05),TLR4抗体对此无明显拮抗作用。LPS能明显上调ECV304表达TLR4、TLR4-mRNA及IL-8mRNA,其中10ng/mL的LPS在24h时、50ng/mLLPS在6~24h时,TLR4表达具有统计学意义(P<0.05);50ng/mL的LPS刺激ECV304细胞在4h及8h时,细胞核内TLR4mRNA表达均明显升高(P<0.05),而IL-8mRNA表达在8h时明显升高(P<0.05)。TLR4抗体对ECV304表达TLR4及TLR4-mRNA有拮抗作用(P<0.05),对IL-8mRNA表达无明显拮抗作用(P>0.05)。结论:小剂量LPS可诱导ECV304细胞表达TLR4并引起细胞活化,TLR4抗体可抑制TLR4的表达,但不能抑制细胞的活化。
脂多糖;血管内皮细胞;TOLL样受体4
脂多糖(Lipopolysaccharide,LPS)是革兰阴性菌细胞壁的主要成分与毒力因子,可使内皮细胞活化,促使炎症介质、酶等释放,作用于凝血、纤溶系统,促发弥漫性血管内凝血。在全身炎症反应中,内皮细胞是易受炎性介质损伤的首个靶器官,许多致炎因子通过直接或者间接方式作用于血管内皮细胞表面的TOLL样受体(TOLLlikereceptorsTLRs),引起胞内信号转导释放炎性介质。本研究以人脐静脉内皮细胞株(endothelialcelllineECV304)细胞为靶细胞,观察小剂量LPS对人脐静脉内皮细胞系ECV304细胞TLR4表达及活化的影响,从而探讨革兰阴性致病菌在脓毒症发生中内皮细胞损伤的病理机制。
1 材料与方法
1.1 主要试剂与器材 ECV304细胞由天津市环湖医院神经细胞研究所张文治教授惠赠;大肠杆菌内毒素(美国Sigma公司);小鼠抗人TLR4抗体(美国Santa cruz公司);四氮唑蓝(methyl thiazolyl tetrazolium MTT)、二甲基亚砜(dimethyl sulfoxide DMSO)(美国Sigma公司);TRIzol Reagent(美国Invitrogen Life Technologies公司);3-吗啉基丙磺酸(3-(morpholino)propanesulfonic acid MOPS,德国Calbiochem公司);SP免疫组化染色试剂盒(北京中杉金桥生物公司);M-MLV逆转录酶(美国Promega公司);引物合成由北京Ivitrogen生物技术公司完成;2×浓缩的实时定量PCR扩增的预混和溶液(SYBR Green Mix,美国Invitrogen公司);实时荧光定量PCR仪(美国ABI公司)。
1.2 ECV304细胞培养及传代 细胞常规培养于含10%胎牛血清的DMEM高糖培养液中,含青、链霉素双抗。在37℃、5%CO2的细胞培养箱内培养。实验采用传代后3 d处于指数增殖期的细胞。
1.3 不同浓度的LPS对ECV304细胞的诱导活化传代细胞于24孔板调整并计数2×103/mL细胞,接种于细胞培养瓶并使终体积为100μL,培养箱中培养至细胞贴壁达到80%汇合时,弃去培养液,PBS液洗涤细胞3次后分为3组,即对照组(含有5%胎牛血清的DMEM溶解LPS的溶剂)、脂多糖组(配制LPS原始液浓度10 ug/mL,使用浓度10 ng/mL、50 ng/mL及100 ng/mL的 LPS原始液加量依次为10 uL、5 uL、1 uL于含有5%胎牛血清的DMEM中)、脂多糖+TLR4抗体组(anti-TLR4溶解于PBS的原始浓度200 ug/mL,使用浓度30μg/mL的anti-TLR4原始液加量为150 uL,此组LPS原始液10 ug/mL,其中5%胎牛血清的DMEM 850 uL+anti-TLR 4150 uL),每组设3个复孔,重复实验3次。于37℃、5%CO2培养箱静置培养。
1.4 MTT法测定细胞增殖活性 细胞分别培养至8 h及24 h,各孔加入5 mg/mL的MTT溶液15 uL,37℃、5%CO2培养箱静置培养4 h。弃去上清,每孔加入DMSO 150 uL,震荡溶解蓝紫色甲瓒,酶标仪490 nm处测定各孔的吸光度OD值,与空白孔OD值之差即为实际吸光度。
1.5 细胞免疫组化染色法检测细胞表面TLR4表达 调整并计数各孔105/mL细胞,接种于24孔细胞培养板并使终体积为1 mL,分为3组,即空白对照组、内毒素组、内毒素+TLR4抗体组。同前培养细胞,LPS浓度分别为10 ng/mL及50 ng/mL,每组各设6 h、8 h、10 h、12 h及24 h 5个时间点。细胞培养至相应时间点后,加3%H2O2-甲醇液封闭内源性过氧化物酶,PBS洗涤后,加入0.1%TritonX-100增加细胞膜的通透性,按照SP免疫组化试剂盒说明书进行操作。光镜下观察细胞呈黄色染色为阳性表达,胞膜胞浆无显色为阴性。按阳性细胞所占百分比计算阳性细胞指数(%)为结果进行统计。
1.6 实时荧光定量PCR(Real Time-PCR) 细胞分为空白对照组、内毒素组、内毒素+TLR4抗体组,LPS浓度为50 ng/mL。分别培养至4 h、8 h后,弃去上清夜。PBS漂洗3次,收集细胞后,Trizol法提取细胞总RNA,甲醛变性琼脂糖凝胶电泳检测RNA完整性。逆转录合成cDNA,实时定量PCR扩增检测表达水平。TLR4上游引物5’-CCTGGAGTGGGAGGACAGTGT-3’端,下游引物 5’-ACCCACTGTTCCTTCTGGATTC-3’(扩增产物为103 bp);IL-8上游引物5’-CTCTTGGCAGCCTTCCTGATT-3’,下游引物5’-TATGCACTGACATCTAAGTTCTTTAGCA-3’(扩增产物为87 bp);β-actin内参上游引物5’-GCATGGGTCAGAAGGATTCCT-3’,下游引物5’-TCGTCCCAGTTGGTGACGAT-3’(扩增产物为106 bp)。PCR反应循环条件为50℃2 min,95℃10 min,95℃15 s,55℃(TLR4、β-actin)、60℃(IL-8)30 s,72℃ 30 s,共50个循环。用样品/ β-actin的比值表示该样品PCR产物的相对水平。1.6 统计学处理 所得计量资料以均数±标准差(±s)表示,采用SPSS 13.0统计软件进行数据结果分析。计量资料采用单因素方差分析,组间比较采用S-N-K q检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度的LPS对ECV304细胞增殖活性的影响 以100 ng/mL LPS刺激细胞8 h及24 h,MTT检测细胞增殖活性均明显降低,脂多糖组与对照组比较具有统计学差异(P<0.05及0.01),脂多糖+TLR4抗体组与脂多糖组比较无明显差异(P>0.05)。分别以10 ng/mL及50 ng/mL的LPS刺激ECV304细胞8 h及24 h时,MTT检测细胞增殖活性均无明显变化(P>0.05),脂多糖+TLR4抗体组与脂多糖组比较亦无明显差异(P>0.05)。具体见表1。
2.2 LPS刺激后ECV304细胞表面TLR4表达的免疫组化染色结果 根据MTT检测结果,本部分实验LPS浓度选用10 ng/mL及50 ng/mL。研究结果显示,ECV304细胞经10 ng/mL的LPS刺激后,仅24 h组细胞表面TLR4表达明显升高,与空白对照组具有统计学差异(P<0.05)。脂多糖+TLR4抗体组表达水平明显低于脂多糖组,并具有统计学差异(P<0.05)。于其他各时点,LPS刺激后细胞表面TLR4表达与空白对照组无明显差异。以50 ng/mL的LPS刺激细胞后,于各时点检测细胞表面TLR4表达与空白对照组比较均明显升高(P<0.05及0.01),脂多糖+TLR4抗体组表达水平均明显低于脂多糖组,并具有统计学差异(P<0.05),但仍高于对照组水平。具体见表2及表3。其中以50 ng/mL的LPS刺激ECV304细胞8 h,细胞膜表面TLR4的阳性表达,在对照组见图1,脂多糖组见图2,脂多糖+TLR4抗体组见图3。
2.3 RT-PCR检测TLR4mRNA及IL-8 mRNA的表达 电泳检测RNA完整性清楚显示三条带。内皮细胞经LPS刺激后4 h,细胞核内TLR4 mRNA和IL-8mRNA水平显著升高,与对照组比较具有统计学差异(P<0.05);而脂多糖+抗体组TLR4 mRNA和IL-8mRNA表达亦明显升高,与脂多糖组比较无明显下降(P>0.05)。作用8 h后,脂多糖组细胞核内TLR4mRNA和IL-8mRNA表达水平亦明显高于对照组,具有统计学差异(P<0.05);而脂多糖+抗体组TLR4 mRNA表达较内毒素组明显下降,具有统计学差异(P<0.05),但IL-8mRNA表达较脂多糖组无明显下降,无统计学差异(P>0.05)。见表4。
表1 不同浓度LPS刺激后ECV304细胞MTT检测(±s)
注:与对照组相比,aP<0.01
组别对照组脂多糖组脂多糖+TLR4抗体组8 h 24 h 10 ng/mL 0.398±0.019 0.395±0.011 0.406±0.012 50 ng/mL 0.405±.0.093 0.414±0.028 0.425±0.037 100 ng/mL 0.421±0.005 0.040±0.052a0.039±0.055a10 ng/mL 0.394±0.045 0.405±0.023 0.403±0.011 50 ng/mL 0.411±0.022 0.426±0.022 0.422±0.048 100 ng/mL 0.399±0.048 0.053±0.050a0.047±0.051a
表2 10 ng/m L LPS刺激后ECV304表达TLR4的变化(±s,%)

表2 10 ng/m L LPS刺激后ECV304表达TLR4的变化(±s,%)
注:与对照组相比,aP<0.05,aaP<0.01;与脂多糖组相比,bP<0.05
对照组脂多糖组脂多糖+TLR4抗体组6 h 25.733±5.445 21.487±8.106 24.423±2.398 8 h 18.300±3.905 23.290±3.723 21.563±4.738 10 h 18.813±4.135 23.450±3.715 23.180±3.741 12 h 22.467±6.912 23.613±1.331 22.260±2.200 24 h 19.393±2.380 32.707±3.370aa26.510±3.308a、b
表3 50 ng/m L LPS刺激后ECV304表达TLR4的变化(±s,%)

表3 50 ng/m L LPS刺激后ECV304表达TLR4的变化(±s,%)
注:与对照组相比aP<0.05,aaP<0.01;与脂多糖组相比,bP<0.05
对照组脂多糖组脂多糖+TLR4抗体组6 h 23.33±3.24 27.98±4.52a24.04±6.22a、b8 h 18.84±2.07 26.36±8.67a24.03±9.27a、b10 h 22.32±3.34 26.94±5.23a25.32±3.32a、b12 h 13.76±3.21 24.54±11.18aa18.89±5.70a、b24 h 24.40±1.59 27.16±1.79aa26.71±3.05a、b

图1 对照组ECV304细胞膜TLR4阳性表达(免疫组化染色×200)

图2 脂多糖组ECV304细胞膜TLR4阳性表达(免疫组化染色×200)
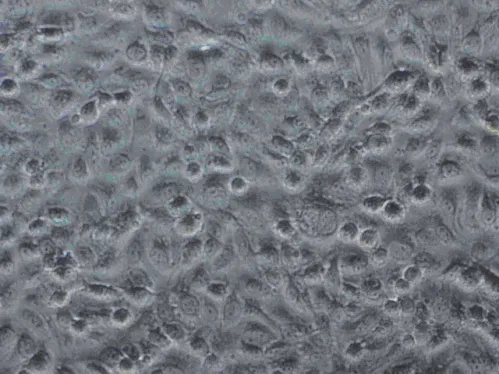
图3 脂多糖+TLR4抗体组ECV304细胞膜TLR4阳性表达(免疫组化染色× 200)
表4 RT-PCR检测TLR4及IL-8 m RNA的表达(±s)

表4 RT-PCR检测TLR4及IL-8 m RNA的表达(±s)
注:与对照组相比,aP<0.05,aaP<0.01;与脂多糖组相比,bP<0.05
组别对照组脂多糖组脂多糖+抗体组TLR4 mRNA*1000 4 h 57.5696±21.862 58 98.6984±6.648 96a101.5133±21.8046a8 h 15.0313±2.273 58 104.6274±6.3084aa74.8186±20.127 40aa、bIL-8mRNA*100 4 h 35.7501±3.765 44 33.0623±3.056 90 32.8023±10.833 24 8 h 27.4938±5.857 95 47.0004±3.363 35aa53.8012±6.933 78aa
3 讨论
LPS是革兰阴性菌脓毒症的主要致病因子。LPS入血后,与脂多糖结合蛋白(lipopolysaccharide binding protein LBP)结合,再与sCD14形成内毒素sCD14复合物,与血管内皮细胞膜受体结合,引起NF-κB活化,促使炎性介质释放[1]。内皮细胞激活在脓毒症中扮演了核心角色,可做为脓毒症治疗效果评价的方法之一[2]。因此,研究内皮细胞在脓毒症中的作用机制,成为深刻理解MODS的关键环节。近年来,对其膜表面的受体研究成为热点,. PoltorakA、HoshinoK及Suzuki等从遗传学分析、细胞转染、基因敲除等方面发现TLR4与革兰阴性菌感染有关,参与LPS的信号转导。亦有研究证明,抑制TLR4表达,可显著减少细胞因子释放,减轻革兰阴性菌脓毒症小鼠的炎症反应,提示抑制TLR4表达可作为治疗革兰阴性菌脓毒症的靶点[3-4]。有研究证实,在脓毒症中,当病原体入侵时,不同细胞表面的TLRs,不仅仅是一个特定的配基,而是参与炎症反应的正反馈回路[5]。血管内皮细胞不会发生免疫耐受[6],小剂量LPS可激活TLR4并诱导其本身表达的增加,引起炎症反应的级联扩大。
健康内皮细胞具有广泛的活性,可不断感受各种原因导致的细胞外环境变化[7]。本研究使用的小剂量LPS刺激ECV304,MTT检测并未造成细胞损伤。主要观察了小剂量LPS作用于内皮细胞后,对TLR4表达及细胞活化的作用及机制,揭示革兰阴性菌脓毒症早期的内皮细胞分子机制,为早期治疗革兰阴性菌脓毒症提供可能的理论依据。Faure E等[8]认为,LPS剂量低至50 ng/mL作用于人脐静脉内皮细胞8 h时可使其活化,与本实验结果一致,Steven M.Opal等[9]在253位严重脓毒症或脓毒症休克患者血浆中检测 LPS的含量,中位数 300 pg/mL(25%~75%四分位数间距,110~726 pg/mL),但是否细胞学体外实验加入LPS的剂量与在体实验时人体内LPS的浓度水平有一定的换算关系,有待进一步证实,但本实验结果发现,小剂量LPS作用于ECV304后,细胞核内TLR4mRNA、IL-8mRNA及其膜表面TLR4的表达均有所增加,且有时间依赖性。提示TLR4在小剂量LPS使血管内皮细胞活化释放炎性介质的过程中发挥了重要的作用。本研究亦发现,刺激8 h时内毒素组细胞核内IL-8mRNA的表达明显增高,但脂多糖+抗体组与脂多糖组相比表达无明显降低。考虑其可能原因:⑴TLR4抗体的量不足,不足以结合ECV304表面的所有TLR4以阻断TLR4介导的信号转导通路,炎性因子释放,但8 h时,脂多糖+抗体组核内TLR4mRNA的表达较脂多糖组下降,故量不足的原因可能存在,但不是唯一原因。⑵本实验在LPS及anti-TLR4共同孵育ECV304时,部分未来得及与抗体结合的TLR4先与LPS结合,使NF-κB活化,炎性介质释放,NF-κB及炎性介质作为致炎因子,再次刺激ECV304,使细胞表面另外的膜受体如TLR2表达增加,因TLR2基因启动子上有NF-κB结合位点,而LPS本身也是NF-κB的有效激活剂[10],通过该途径可引起炎症因子的持续表达。而IL-8,IL-1β对内皮细胞有比LPS更强的刺激作用,从而形成了更为复杂的级联反应[11]。⑶不排除TLR2与TLR4作为二聚体共同识别LPS,使anti-TLR4的拮抗作用减弱,并激活信号转导途径引发相应的免疫防御反应[12]。
小剂量LPS激活血管内皮细胞,促使炎性介质的释放是一个复杂的过程,TLR4参与并发挥了不可或缺的作用,但TLR4是否是唯一LPS可识别的膜受体,有待进一步研究证实。近年来,关于脓毒症的理论与临床研究取得很大的进展,但其死亡率居高不下,为寻求抑制LPS通过TLR4引起的NF-KB活化,对TLR4拮抗剂如RP105-MD、RP105、ST2做了许多深入的研究[13-14],故明确TLR4在内皮细胞活化中的作用机制,显得尤为重要。
[1]Yang Q,Zhu P,Wang Z,Jiang J.Lipopolysaccharide upregulates the expression of Toll-like receptor 4 in human vascular endotheli⁃al cells.Chin Med J(Engl).2002;115(2):286-289.
[2]Schildberger A,Rossmanith E,Weber V,et al.Monitoring of endo⁃thelial cell activation in experimental sepsis with a two-step cell culturemodel[J].Innate Immun,2010,16(5):278-287.
[3]Roger T,Froidevaux C,Le Roy D,et al.Protection from lethal gram-negative bacterial sepsis by targeting Toll-like receptor 4 [J].Proc Natl Acad SciU SA,2009,106(7):2348-2352.
[4]Hawkins LD,Christ WJ,Rossignol DP.Inhibition of endotoxin re⁃sponse by synthetic TLR4 antagonists[J].Curr Top Med Chem, 2004,4(11):1147-1171.
[5]Tsujimoto H,Ono S,Efron PA,et al.Role of Toll-like receptors in the development of sepsis[J].008,29(3):315-321.
[6]WangW,Deng M,Liu X,et al.TLR4 Activation Induces Nontoler⁃ant Inflammatory Response in Endothelial Cells[J].Inflammation, 2010,28(10):9254-9258.
[7]Aird WC.Endothelial cell dynamics and complexity theory[J].Crit Care Med,2002,30(5 Suppl):180-185.
[8]Faure E,Thomas L,Xu H,et al.Bacterial Lipopolysaccharide and IFN-Induce Toll-Like Receptor 2 and Toll-Like Receptor 4 Ex⁃pression in Human Endotheli300Cells:Role of NF-B Activation. J Immunol,2001,166:2018-2024.
[9]Opal SM,Scannon PJ,Vincent JL.Relationship between Plasma Levels of Lipopolysaccharide(LPS)and LPS-Binding Protein in Pa⁃tients with Severe Sepsis and Septic Shock.J Infect Dis,1999, 180:1584-9.
[10]Matsuguchi T,Musikacharoen T,Ogawa T,et al.Gene expressions ofToll-like receptor 2,but not Toll-like receptor 4,is induced by LPS and inflammatory cytokines in mouse macrophages[J].J Im⁃munol,2000,165(10):5767-5772.
[11]MakóV,Czúcz J,Weiszhár Z,et al.Proinflammatory activation pat⁃tern of human umbilical vein endothelial cells induced by IL-1β, TNF-α,and LPS[J].Cytometry(Part A),2010,77(10):962-970.
[12]Chow JC.Young DW.Golenbock DT,et al.Toll-likereceptor-4 mediates lipopolysaccharide-induced signal transduction[J].Bio Chem,1999,274(16):106-115.
[13]Divanovic S,Trompette A,Atabani SF,et al.Negative regulation of Toll-like receptor 4 signaling by the Toll-like receptor homolog RP105[J].Nat.Immunol,2005,6(6):571–578.
[14]Wittebole X,Coyle SM,Kumar A,et al.Expression of tumour ne⁃crosis factor receptor and Toll-like receptor 2 and 4 on peripheral bloodleucocytes of human volunteers after endotoxin challenge: acomparison of flow cytometric light scatter and immunofluores⁃cencegating[J].Clin Exp Immunol,2005,141(1):99–106.
(收稿:2011-07-06 修回:2011-11-16)
(责任编辑 刘洪斌 屈振亮)
Research on Small Doses of Lipopolysaccharide Induced Vascular Endothelial Cells Expression of Toll Like Receptor 4
LU Ling,CHANG Wen-xiu,CAO Shu-hua,et al. First Central Clinical College of Tianjin Medical University,Tianjin(300192),China
ObjectiveTo investigate the expression of Toll like receptor 4(TLR4)on human umbilical vein endothelial cells(HUVEC)induced by small doses of lipopolysaccharide(LPS). Methods The ECV304 be⁃longing to HUVEC was cultured in vitro.and hatched with LPS and LPS+antibody of TLR4(anti-TLR4)respec⁃tively.Cell proliferation activity was detected by MTT.The effect of LPS on change of the cell surface of TLR4 was observed with immunohistochemical staining method.The expression of TLR4-mRNA and of IL-8mRNA were evaluated by Fluorescence Detection Quantitative Polymerase Chain Reaction(PCR). Results ECV304 cells stimulated by LPS of(10-50)ng/mL within 24 h,MTT detection showed no apparent change(P>0.05);but with 100 ng/mL LPS stimulated the cells 24 h,the number of cells reduced significantly(P<0.05),under the circumstances,anti-TLR4 didn’t withstand evidently.The 10 ng/mL LPS stimulated ECV304 in 24 h,the ex⁃pression of TLR4 was elevatory;and with 50 ng/mL LPS stimulation,the expression of TLR4 was significantly in⁃creased in 6-24 h(P<0.05),with 50 ng/mL LPS stimulating ECV304 cells in 4 h and 8 h.The expression of TLR4-mRNA in LPS group and LPS+anti-TLR4 group increased significantly as compared with the normal con⁃trol group(P<0.05),but LPS+anti-TLR4 group only in 8 h lower than LPS group;the expression of IL-8mRNA in LPS group and LPS+anti-TLR4 evaluated obviously as compared with the normal control group only in 8 h, which did not affect with anti-TLR4. Conclusion Small doses of LPS can induce ECV304 cells expressing TLR4 and cause cell activation,and anti-TLR4 can inhibit TLR4 expression,but can't restrain cell activation.
Lipopolysaccharide,Endothelial cell,TOLL like receptor 4
Q95-33
:A
1007-6948(2012)01-0047-05
10.3969/j.issn.1007-6948.2012.01.014
天津医科大学第一中心临床学院ICU(天津 300192)
常文秀,E-mail:changwx@sina.com
