微生物浊度法与管碟法测定乙酰麦迪霉素制剂的效价Δ
2012-03-26王淑娟高燕霞程桂茹长春工业大学长春3002河北省药品检验所石家庄0500
王淑娟,高燕霞,程桂茹(.长春工业大学,长春3002;2.河北省药品检验所,石家庄0500)
麦迪霉素为一组16元环大环内酯类抗生素的混合物,是日本的Takashi公司1971年从日本土壤中分离出来的生米加链霉菌(Streptomyces mycarofaciens)ATCC 21454经发酵提取分离制得的。其抗菌作用稍低于红霉素,临床主要用于革兰阳性菌感染。乙酰麦迪霉素为麦迪霉素的2个位点上的羟基经乙酰化所得的一种二乙酰化合物,对革兰阳性球菌有较强的抗菌活性,口服吸收良好,血药浓度高,无苦味,具有很好的制剂学优点。乙酰麦迪霉素的体外活性与麦迪霉素基本相同,但体内活性却显著优于麦迪霉素,原因之一可能是由于分子结构中增加了2个乙酰基,使其脱酰化代谢变缓、体内浓度增加所致。
目前,乙酰麦迪霉素采用管碟法测定其含量[1~3]。管碟法能直观反映样品的体外抗菌能力,尤其对于单纯化学方法难以分开的多组分抗生素来说,一直被广泛应用。但同时因其操作烦琐、影响因素多,而使结果的准确性有待商榷。采用浊度法测定则可克服上述不足之处[4,5]。笔者建立了以浊度法测定乙酰麦迪霉素制剂效价的方法,并与管碟法比较。通过对乙酰麦迪霉素用浊度法测定其效价的研究,可以进一步提高产品效价测定的准确性,有效地减少了误差。同时,浊度法作为效价检测的方法,不但可反映抗菌能力的高低,且具有更直观的效果。
1 仪器与试药
WBS-100全自动微生物比浊法测定仪、石英培养杯(厚度2 cm)(北京先驱威锋技术开发公司);CBZ-1抗生素光度比浊法测量仪、石英培养杯(厚度1 cm)(北京潮声公司);CAM-ⅢA智能抑菌圈测定仪(上海波浦新材料技术有限公司)。
金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]、乙酰麦迪霉素标准品(批号:130362-200301,纯度:998 u·mg-1)均由中国食品药品检定研究院提供;乙酰麦迪霉素片(石药集团欧意药业有限公司,批号:114080401、6114090201,规格:每片0.1 g(10万u));乙酰麦迪霉素干混悬剂(沈阳第一制药厂,批号:080308,规格:0.1 g∶0.5 g,1万u);抗生素检定培养基Ⅲ号(pH7.0,批号:080501)、抗生素检定培养基Ⅷ号(批号:080301)均由北京三药科技开发公司提供,中国食品药品检定研究院监制;灭菌0.9%氯化钠溶液和磷酸盐缓冲溶液(PBS,pH4.5)均按《中国药典》2010年版二部附录[6]制备。
2 方法与结果
2.1 管碟法[1~3]
2.1.1 菌液的制备。
取枯草芽孢杆菌的试验菌液[6]0.2 mL加至培养基Ⅷ号(另加0.3%酵母浸出粉,调节pH值使灭菌后为7.8~8.0)100 mL中,摇匀,为实验菌液。
2.1.2 溶液的制备。
(1)标准品溶液。取乙酰麦迪霉素标准品适量,精密称定,加乙醇溶解并稀释成500 u·mL-1的溶液,作为储备液备用;精密量取储备液适量,用PBS进一步稀释成20、40 u·mL-1的标准品溶液。
(2)供试品溶液。取乙酰麦迪霉素片10片,研细,精密称取适量,加乙醇适量,充分振摇使溶解,再用乙醇稀释制成500 u·mL-1的溶液,静置,作为储备液备用;精密量取储备液适量,用PBS进一步稀释成20、40 u·mL-1的供试品溶液a。取乙酰麦迪霉素干混悬剂20包,混合均匀,精密称取适量,加乙醇适量,充分振摇使溶解,再用乙醇稀释制成500 u·mL-1的溶液,静置,作为储备液备用;精密量取储备液适量,用PBS进一步稀释成20、40 u·mL-1的供试品溶液b。
2.1.3 培养与测定。
按照管碟法二剂量法进行试验。在抑菌圈电脑测量分析仪上测量并计算结果,即得乙酰麦迪霉素片及干混悬剂的含量。
2.2 浊度法[6]
2.2.1 试验菌、培养基及加菌量的选择。
乙酰麦迪霉素为广谱抗生素,对革兰阳性菌及阴性菌均有很好的抗菌作用,同时选择金黄色葡萄球菌、肺炎克雷伯菌为试验菌,培养基为抗生素检定培养基Ⅲ号。
在WBS-100全自动微生物比浊法测定仪上,选择肺炎克雷伯菌为试验菌,加菌量为2.5%,抗生素浓度为3.0、4.5、6.0、7.5、9.0 u·mL-1;测定后绘制乙酰麦迪霉素不同浓度及阳性对照的时间-吸光度曲线(生长曲线),详见图1。
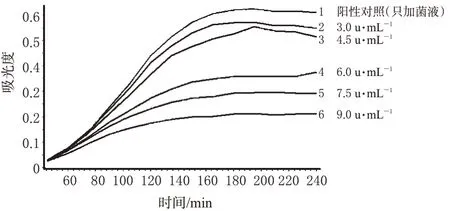
图1 肺炎克雷伯菌为试验菌时乙酰麦迪霉素的生长曲线Fig 1 Growth curves of acetyl midecamycin with K.peumoniae as test organism
在CBZ-1抗生素光度比浊法测量仪上,选择金黄色葡萄球菌为试验菌,加菌量为1.2%,抗生素浓度为0.3、0.5、1.0、1.5、2.0、2.5、3.0 u·mL-1;测定后绘制乙酰麦迪霉素不同浓度及阳性对照的时间-吸光度曲线(生长曲线),详见图2。
对比图1、图2可知,采用肺炎克雷伯菌作为试验菌,乙酰麦迪霉素的抗菌浓度范围较窄,到达平台期较早(180 min,3 h左右),曲线斜率较小,乙酰麦迪霉素的浓度较金黄色葡萄球菌时为高,这些都说明乙酰麦迪霉素对金黄色葡萄球菌更为敏感,所以最终采用金黄色葡萄球菌作为本实验的菌种。
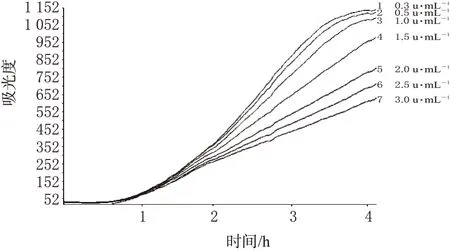
图2 金黄色葡萄球菌为试验菌时乙酰麦迪霉素的生长曲线Fig 2 Growth curves of acetyl midecamycin with S.aureus as test organism
2.2.2 一剂量法。
(1)菌液的制备。取金黄色葡萄球菌的营养琼脂斜面培养物,接种于营养琼脂斜面上,在35~37℃培养20~22 h,临用时,用0.9%灭菌氯化钠溶液洗下;取新鲜的菌悬液适量,加12%甲醛液1 mL杀灭,以生理盐水稀释,使得其在530 nm波长处的吸光值为1.0,记录其稀释所用的生理盐水的毫升数和1 mL12%甲醛液的总毫升数,再将原菌液按此比例稀释,即为试验菌液。取试验菌液1.2~2.5 mL加至培养基100 mL中,摇匀,为实验菌液。
(2)溶液的制备。①标准品溶液:精密量取标准品储备液适量,用PBS进一步稀释成0.3、0.5、1.0、1.5、2.0、2.5、3.0 u·mL-1的标准品溶液。②供试品溶液c:精密量取供试品储备液a适量,用PBS进一步稀释成1.5 u·mL-1的供试品溶液。③供试品溶液d:精密量取供试品储备液b适量,用PBS进一步稀释成1.5 u·mL-1的供试品溶液。
(3)培养与测定。取标准品溶液及供试品溶液c各1.0 mL,加入灭菌培养管中,再加入实验菌液9.0 mL,置于抗生素光度比浊法测量仪内,于37℃培养;另取PBS 1.0 mL,加9.0 mL空白培养基,混匀,作为空白对照。仪器在线于530 nm波长处测定各管金黄色葡萄球菌对数生长期内不同培养时间(实时记录,从0开始到5 h左右)下的吸光度值,根据量反应平行线原理计算供试品的效价值。同法测定供试品溶液d。
2.2.3 二剂量法。
(1)溶液的制备。①标准品溶液:精密量取标准品储备液适量,用PBS进一步稀释成1.0、2.0 u·mL-1的标准品溶液;②供试品溶液e:精密量取供试品储备液a适量,用PBS进一步稀释成1.0、2.0 u·mL-1的供试品溶液;③供试品溶液f:精密量取供试品储备液b适量,用PBS进一步稀释成1.0、2.0 u·mL-1的供试品溶液。(2)菌液的制备、培养与测定均同一剂量法相关操作。
2.2.4 线性范围的测定。
照抗生素微生物检定一剂量法测定,并按“2.2.2”项下各组浓度标准品溶液所制菌液吸光度的值(y)对溶液对数浓度(x)进行线性回归,绘制标准曲线,计算回归方程及相关系数为y=-4.048 8×10-1x+5.670 7×10-1(r=0.998 3)。结果表明,采用标准品溶液进行一剂量法试验,乙酰麦迪霉素检测浓度线性范围为0.3~3.0 u·mL-1。
2.2.5 回收率试验。
精密称取乙酰麦迪霉素标准品及已知含量的片剂样品和干混悬剂样品,按“2.2.3”项下方法制备各浓度的标准品溶液和供试品溶液a和供试品溶液b的储备液,得3种溶液浓度均为400、500、600 u·mL-1的溶液,备用;分别等量精密量取标准品溶液和供试品溶液a和b储备液适量,用PBS稀释制成0.8和1.6 u·mL-1、1.0和2.0 u·mL-1、1.2和2.4 u·mL-1的供试品溶液(分别代表80%、100%和120%3种水平,每种溶液的终溶液再稀释为2种浓度共6个溶液,进行二剂量法的测定)于仪器上测定,计算回收率。结果,片剂平均回收率为101.99%,RSD=1.9%(n=9);干混悬剂平均回收率为101.68%,RSD=1.68%(n=9),详见表1。
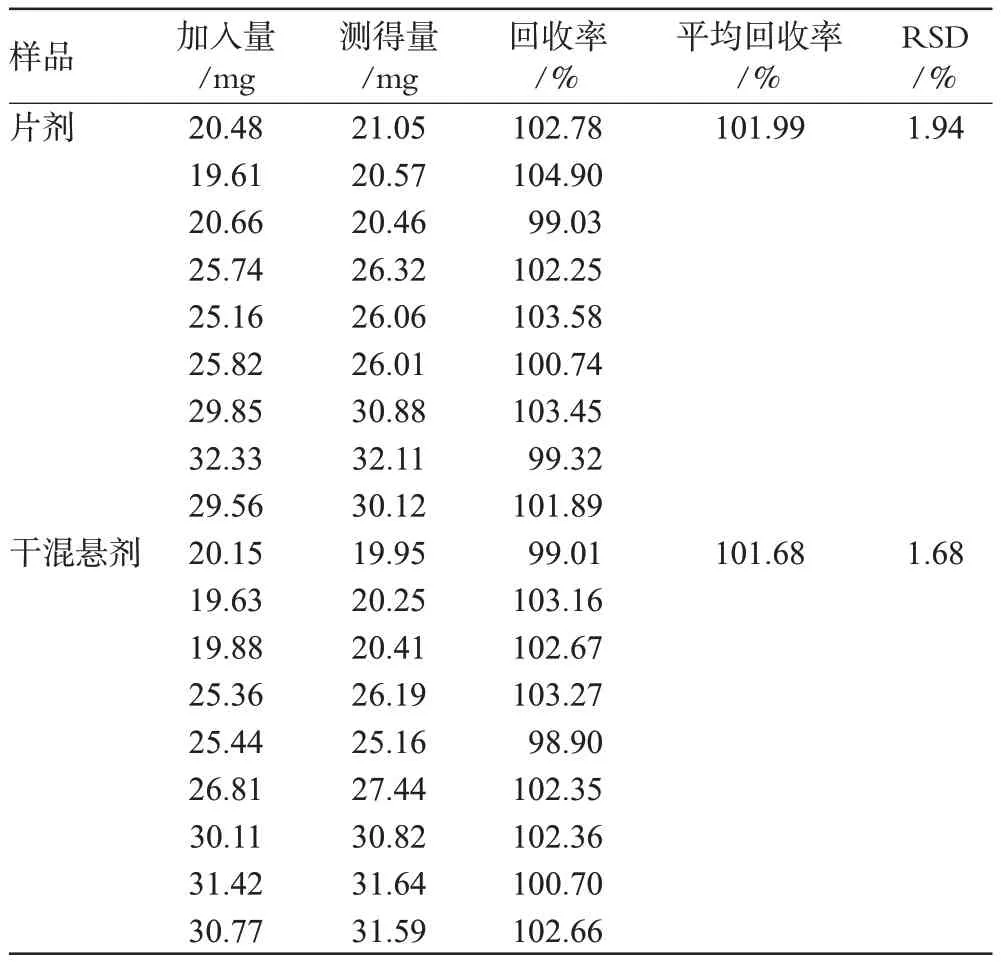
表1 加样回收试验测定结果(n=9)Tab 1 Results of recovery test(n=9)
2.2.6 适用性考察。
将乙酰麦迪霉素制剂按“2.2.3”项下方法制备成供试品贮备液及供试品溶液,分别在冰箱保存5、2 d,每天照“2.2.3”项下方法进行测定,并计算当天效价。结果,供试品贮备液和供试品溶液的效价的RSD均小于1.5%,表明乙酰麦迪霉素制剂的贮备溶液和进样用测定溶液分别在冰箱保持5 d和2 d内稳定,完全满足试验需要。
2.2.7 样品效价测定。
取乙酰麦迪霉素制剂共3批,按“2.2.3”项下方法进行测定。并将结果与原方法(即管碟法)进行比较。结果表明,本方法结果与管碟法结果无显著性差异,具体见表2。
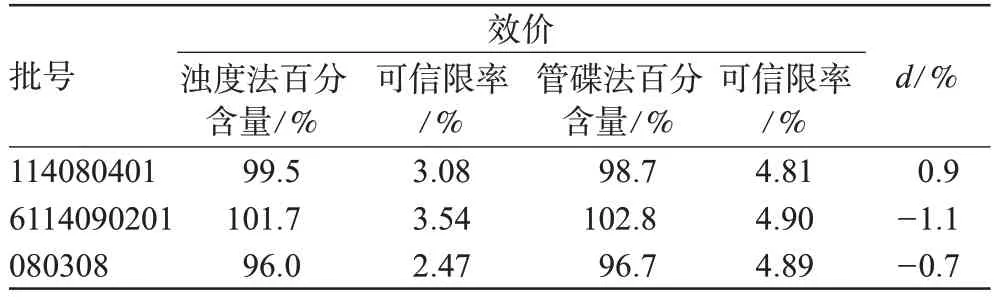
表2 2种方法效价测定结果比较Tab 2 Comparison of antimicrobial activity of two methods
2.2.8 2种方法的数据检验。
采用成对观测的t检验[7],由表2可计算出3批制剂的2种方法效价差值d的平均值为-0.9%,标准偏差s为-1.058 3%,需要的检验统计量t为:
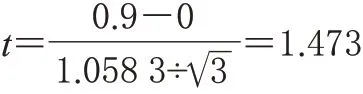
当自由度为2、水平为5%的│t│的临界值是4.303,由于1.473<4.303,因而可认为2种方法的效价测定结果基本一致,2种方法均可控制药品质量。
3 讨论
乙酰麦迪霉素采用管碟法测定效价时,抗生素检测浓度线性范围均为5~40 u·mL-1[1,2],本文采用浊度法测定效价时,抗生素线性范围为0.3~3.0 u·mL-1,说明采用浊定法具有更低的检测限、更高的灵敏度,表现更直观。本文所建立的浊度法,通过“2.2.1”项下的比对结果,采用更为敏感的金黄色葡萄球菌作为试验用菌,不仅方法更灵敏,可信限率也大大降低;而方法可靠性增加后,必然会使结果的准确性得以提高。
由于乙酰麦迪霉素为16元环大环内酯类抗生素,是由A1、A2~A4、柱晶白霉素A6等组分组成的混合物,受发酵菌种和生产工艺的影响,各组分含量比例变化不定。所以在化学方法越来越占分析主流的今天,多组分抗生素仍采用生物测定法进行含量测定。但采用管碟法测定效价时,受扩散系数、培养基黏稠度、抑菌圈大小等诸多因素影响,因此测定误差较大。浊度法测定在液体培养基中进行,可避免上述因素的影响;用固定波长测定菌液的吸光度,精密度优于管碟法中对抑菌圈的测定,且培养时间短,因此测定更为快速、准确。
现行标准采用管碟法测定乙酰麦迪霉素制剂的效价时,样品制备时贮备液几乎都是采用乙醇进行溶解,到终溶液时用缓冲液来稀释,这样终溶液中乙醇的浓度达到了8%。因为该方法是现行方法,所以笔者未对该方法进行修改。同时,为便于比较管碟法和浊度法,笔者沿用了标准中溶液制备的方法。
经浊度法与管碟法测定效价比较结果表明,浊度法测定乙酰麦迪霉素制剂效价的方法准确、可靠、快捷,并具有更低的检测限、更直观的效果。本方法作为乙酰麦迪霉素制剂效价测定的质控方法值得推广,可与管碟法并存。
[1]WS1-(X-352)-2003Z,乙酰麦迪霉素[S].2004.
[2]WS1-(X-320)-2003Z,乙酰麦迪霉素片[S].2004.
[3]WS1-(X-254)-2003Z,乙酰麦迪霉素干混悬剂[S].2004.
[4]王金龙,高燕霞.浊度法测定四环素的效价[J].药物分析杂志,2007,27(12):1 988.
[5]高燕霞,王茉莉.交沙霉素及其片剂效价的比浊法测定[J].中国医药工业杂志,2008,39(2):123.
[6]国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录93、附录95.
[7]罗 旭.化学统计学[M].北京:科学出版社,2001:120-121.
