阿苯达唑-聚乙二醇6000固体分散体壳聚糖微球的制备与药剂学性质研究Δ
2012-03-26王晓青刘扬陈袁兰朱爱军张光宇张学农任伟新迪理木拉提巴吾东顾俊鹏许晓东苏州大学医学部药学院江苏苏州53新疆医科大学附属第一医院乌鲁木齐830054
王晓青,刘扬,陈袁兰,朱爱军,张光宇,张学农#,任伟新,迪理木拉提·巴吾东,顾俊鹏,许晓东(.苏州大学医学部药学院,江苏苏州 53;.新疆医科大学附属第一医院,乌鲁木齐 830054)
阿苯达唑(Albendazole,ABZ)为苯并咪唑类广谱抗寄生虫药,是治疗泡球蚴病和细粒棘球蚴病的首选药物之一,研究[1,2]证明,由于ABZ的低溶解性和在体内广泛的分布性,极大影响了其吸收及生物利用度,且疗效与其溶解性呈正相关,因此,提高ABZ溶解度和口服生物利用度或研究其新型肝动脉栓塞微球制剂是目前治疗包虫病的有效途径。
固体分散体是提高难溶性药物溶解度和生物利用度的有效途径,且工艺简单易行,适合工业化生产[3,4]。本课题以亲水性材料聚乙二醇6000(PEG)为载体,采用了固体分散技术制备ABZ固体分散体(ABZ-SD,ASD)。同时,利用壳聚糖(Chitosan,CS)为天然的阳离子聚合物,具有无毒、生物相容性好、体内降解产物易被人体吸收、毒副作用小的特点[5]。以ASD为主体、壳聚糖为载体材料,采用乳化交联法制备壳聚糖骨架型微球,以达到提高ABZ生物利用度、稳定性和延长其体内作用时间的目的。
1 仪器与试药
UV2401-PC型紫外分光光度计(日本岛津公司);ME215S型分析天平(德国赛多利斯公司);pHS-3TC型数显pH计(上海天达仪器有限公司);光学显微镜(日本Olympus公司);S-4700冷场发射扫描电镜(日本日立公司);Mercury CCD X射线单晶衍射仪(日本理学电机株式会社);DSC 2010热分析仪(美国TA Instruments公司)。
ABZ(武汉远城科技发展有限公司,批号:090901,纯度:99.16%);壳聚糖(浙江澳兴生物科技有限公司,分子量Mw:50 kDa,脱乙酰度:93%);ASD(苏州大学自制,载药量:20%);PEG、司盘(Span)-80、液体石蜡、25%戊二醛、甲醇(色谱纯)均由国药集团化学试剂有限公司提供;其余试剂均为分析纯。
2 ASD的制备及鉴别、表征
2.1 制备方法
取PEG油浴80℃熔融,于搅拌状态加入ABZ,使药物均匀分散在熔融的载体(PEG)后倾倒于预冷4℃玻璃板上冷却固化。-18℃冷冻20 min后干燥24 h,粉碎过230目分样筛备用。
2.2 平衡溶解度的测定[6]
分别取ABZ、ABZ与不同比例PEG(药载比1∶1、1∶2、1∶3、1∶4、1∶5、1∶6)的固体分散体(ASD1~ASD6),置于蒸馏水中,35℃恒温振摇3 d,至其溶解度不变为止;静置,取上清液过0.45 μm滤膜,紫外295 nm波长测定其吸光度并计算其溶解度。结果,随着载体比例的增加,ASD的溶解度呈增加趋势,当药载比为1∶6时(ASD6),其溶解度达到原药溶解度的31.09倍,结果详见表1。

表1 溶解度试验结果(n=3)Tab 1 Results of solubility experiment(n=3)
取上述ASD同批次制备微球,分别测定其包封率和载药量,结果显示药物在微球中的包封率和载药量并不是随着载体比例的增加而增加,当药载比为1∶4时,其包封率和载药量最高。推测原因可能是载体比例过大,药物的溶解度显著增加的同时易通过油水界面扩散至水相[7],导致其包封率降低,故最终ASD的药载比确定为1∶4。
2.3 ASD的鉴别与表征
2.3.1 扫描电镜观察。取适量ABZ及ASD(1∶4),用导电胶带粘结固定后溅金,并固定在样品台上,对准架台的槽沟送入到停止点为止,然后抽真空观察粉末形态。二者扫描电镜照片见图1。
由图1可知,ABZ呈砂晶分布,而ASD呈无定形存在,表明药物由于晶型的改变而使其溶解度增大。
2.3.2 红外光谱。分别取ABZ、ABZ与PEG物理混合物、ASD、PEG,在波数400~4 000 cm-1内扫描进行红外光谱测定,详见图2。
由图2显示,ASD与物理混合物在指纹区和其他区域均基本相似,说明ABZ的化学结构未发生变化,且ASD的红外光谱只是ABZ与PEG光谱的简单叠加,表明药物与载体之间并未发生氢键效应等作用,ASD中无新的复合物产生。

图1 扫描电镜图Fig 1 TEM

图2 固体分散体红外光谱图Fig 2 FT-IR spectra of solid dispersions
3 ABZ含量测定方法的建立[8]
精密称取ABZ 10 mg置于25 mL量瓶中,加冰醋酸1 mL,溶解后加甲醇至刻度作为储备液;分别精密量取储备液0.25、0.5、0.75、1.0、2.0、2.5、3.0、3.5、4.0 mL置于25 mL量瓶中,加甲醇稀释至刻度,得到不同浓度的一系列溶液,摇匀;在295 nm波长下测定,以吸光度(A)和浓度(c)进行回归,得其线性方程为:c=0.040 6A+0.017(r=0.999 4),ABZ检测浓度线性范围为1~20 μg·mL-1。按相关方法进行回收率和精密度试验,结果,低、中、高浓度回收率分别为101.3%、100.4%、99.42%,平均回收率为100.37%(RSD=0.94%);平均日内RSD=0.21%,日间RSD=0.88%。
首先,推进利率市场化。银行业高利润为有序推进利率市场化创造了良好机遇。当前,应鼓励银行多向中小企业提供融资服务,完善银行贷款利率的风险定价机制,以实现我国经济产业结构和收入分配结构的不断优化。
4 ABZ-PEG壳聚糖微球的制备与药剂学性质评价
4.1 微球的制备
取ASD缓慢加入已溶胀好的壳聚糖溶液超声溶解即得水相,将水相逐滴(1滴/2 s)加入至含乳化剂Span-80的液体石蜡中,恒速乳化后加戊二醛交联固化2 h,石油醚、异丙醇清洗,40℃干燥15 h,即得ABZ-PEG壳聚糖微球;不加ASD即得空白壳聚糖微球。
4.2 包封率和载药量的测定
取研细的微球加冰醋酸消解,甲醇定容至50 mL,摇匀,295 nm波长处测定吸光度,由下面公式计算载药量和包封率:载药量=(微球中ABZ的重量/微球重量)×100%;包封率=(微球中ABZ的重量/ABZ投药量)×100%。
4.3 微球制备工艺优化
结合文献[9]以及单因素考察试验结果,选定对微球包封率、载药量、粒径分布和产率影响较大的Span-80含量(A)、壳聚糖浓度(B)以及油-水(液体石蜡-含药壳聚糖溶液)比例(C)为影响因素,设定处方总量为70 mL,加入药物量为140 mg,采用L9(34)正交表安排试验,以a(平均粒径,μm)、b(产率,产率=干燥后微球总量/(ABZ投药量+壳聚糖量)×100%,%)、c(包封率,%)、d(载药量,%)为指标,分别给4个指标赋予-0.3、-0.1、0.3、0.3的权重,采用综合加权评分法进行正交设计。粒径评分=-0.3×a/目标粒径;产率评分=-0.1×b/最大产率;包封率评分=0.3×c/最高包封率;载药量评分=0.3×d/最大载药量。故综合评分=粒径评分+产率评分+包封率评分+载药量评分=-0.3×a/200-0.1×b/91.12+0.3×c/67.19+0.3×d/6.91。因素水平见表2,正交结果见表3,方差分析见表4。

表2 因素水平表Tab 2 Factors and levels
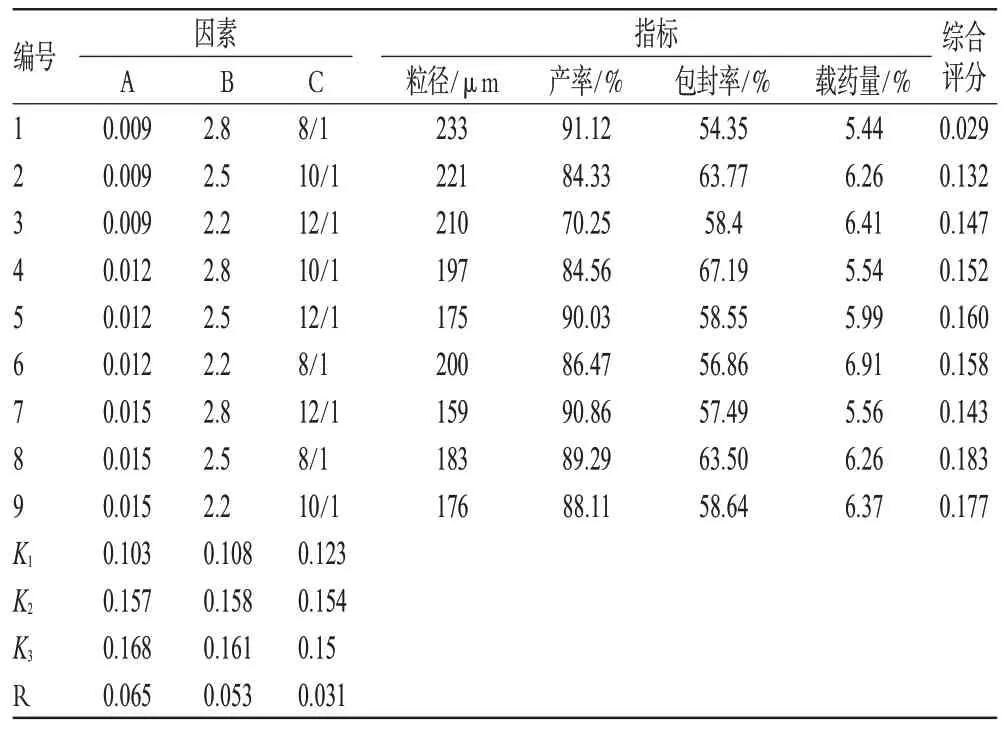
表3 正交试验结果Tab 3 Results of orthogonal design
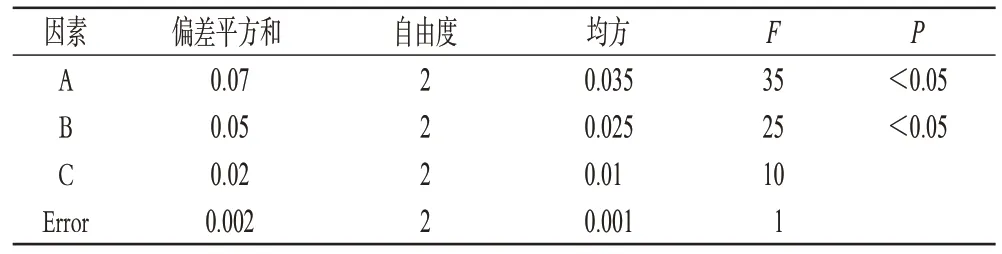
表4 方差分析表Tab 4 Analysis of variance
由直观分析结果判断,3因素极差大小依次为A>B>C,再综合方差分析,其中Span-80的用量和壳聚糖浓度对综合评分有显著性影响(P<0.05),因此,3因素的最佳组合为A3B3C2。最终确定的较佳处方工艺为Span-80的含量:0.015 g·mL-1,壳聚糖浓度:2.2%,油-水比例:10∶1。
4.4 验证试验
采用较优工艺处方制备微球,重复5次,同等条件测定上述指标。结果,包封率为(57.86±0.74)%(RSD=1.27%),载药量为(6.42±0.32)%(RSD=1.87%),粒径为(210±3.8)μm(RSD=1.8%),产率为(85.77±1.5)%(RSD=1.74%)。结果表明,较优工艺处方制备微球达到了预期目标,且工艺稳定、重现性良好。
4.5 微球的药剂学性质评价
4.5.1 形态粒径考察。取微球适量均匀撒布在载玻片上以计数法测定其平均粒径,用电镜观察(30倍)微球的表面形态及特征,见图3A;另取制备后微球及放置2个月后的微球,用扫描电镜放大300倍观察微球表面形态,详见图3B、图3C。
图3结果表明,微球形态圆整,粒径分布均匀,平均粒径约210 μm,表面光滑、圆整,互不粘连,分散性好。

图3 微球形态电镜图Fig 3 Appearance of MS under electric microscope
4.5.2 粉体学性质考察。取10 g微球,分别进行圆整度、压缩度及休止角等粉体学性质的考察。(1)圆整度:取定量微球置于平板上,将平板一侧抬起,测量微球滚动前倾斜平面与水平面的夹角。(2)压缩度:取定量微球轻装入量筒中测量最初疏松体积;在桌面上轻敲至体积不再减小为止,测量最终体积;计算最松密度ρ0和最紧密度ρf,计算压缩度C=(ρf-ρ0)/ρf×100%。(3)休止角:测量漏斗的高度和形成圆锥体的半径,计算休止角。3批样品结果详见表5。

表5 微球粉体学性质考察Tab 5 Micromeritics properties of microspheres
表5结果表明,所制微球分散性和流动性均良好。
4.5.3 微球的结构表征。(1)红外光谱:取ABZ、壳聚糖、物理混合物(ABZ、PEG、壳聚糖)及药物微球进行红外光谱测定,结果见图4。
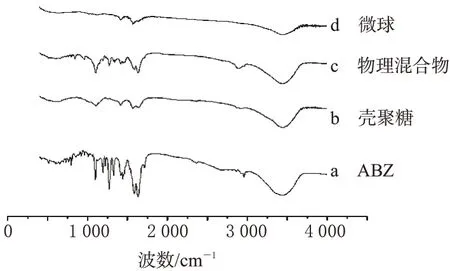
图4 微球红外光谱图Fig 4 FT-IR spectra of microspheres
由图4可见,微球中药物与PEG的特征峰均消失,说明药物已包载其中。
(2)X衍射分析。取“4.5.3”(1)项下4种样品进行X衍射分析,结果见图5。
由图5可见,微球中药物结晶峰全部消失,而在物理混合物中仍大量存在,证明了药物已被包埋在壳聚糖微球骨架中,而不是以物理混合物的形式存在。
5 微球的释放行为
称取微球100 mg置于透析袋中,加4 mL释放介质,用棉绳扎紧封口,固定于螺旋桨上,分别置于(37±0.5)℃、250 mL的0.1 mol·L-1盐酸、pH 3.5的醋酸盐溶液、pH7.4的磷酸盐缓冲液(PBS)释放介质中,根据2010年版《中国药典》二部附录ⅩC中小杯法[10]操作,测定药物累积释放率。调整转速为100 r·min-1,分别于1 、2 、4、6、12 h,1、2、3、4、8、10 d取样4.0 mL,同时补充同温介质4.0 mL。样液用0.45 μm微孔滤膜过滤,紫外法测定其吸光度值,微球在3种介质中的释放情况详见图6。
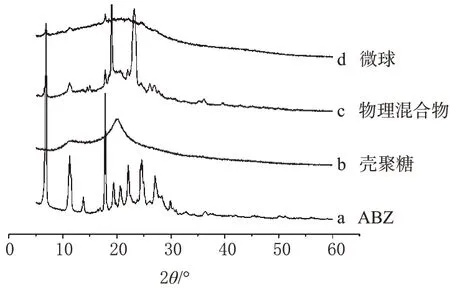
图5 X衍射分析图Fig 5 X-ray diffraction

图6 微球在3种介质中的体外释放曲线Fig 6 Release profiles of microspheres in 3 kinds of medium in vitro
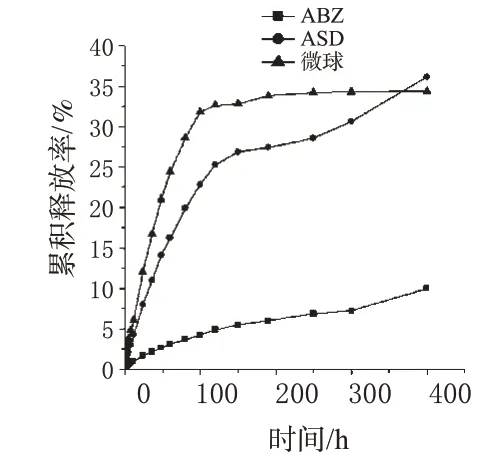
图7 3种样品在pH3.5醋酸盐溶液中的体外释放曲线Fig 7 Release profiles of 3 samples in pH3.5 acetate so lution
由图6可见,微球在pH3.5醋酸盐溶液中释放更优,微球前30 min内,释放率低于40%,基本不产生突释现象;同时总体释放程度显著提高,显示出其显著缓释效果。故选其作为微球的释放介质,同时以ABZ、ASD作为对照。由于固体分散体使原料药溶出度得到大幅度改善,故延长各样品释放时间至17 d(408 h)。3种样品体外释放详见图7。
将ABZ、ASD及微球释放时间(t)与药物的累积释放率(Q)分别用一级释放模型、威布尔(Weibull)函数、Higuchi方程进行拟合,结果见表6。
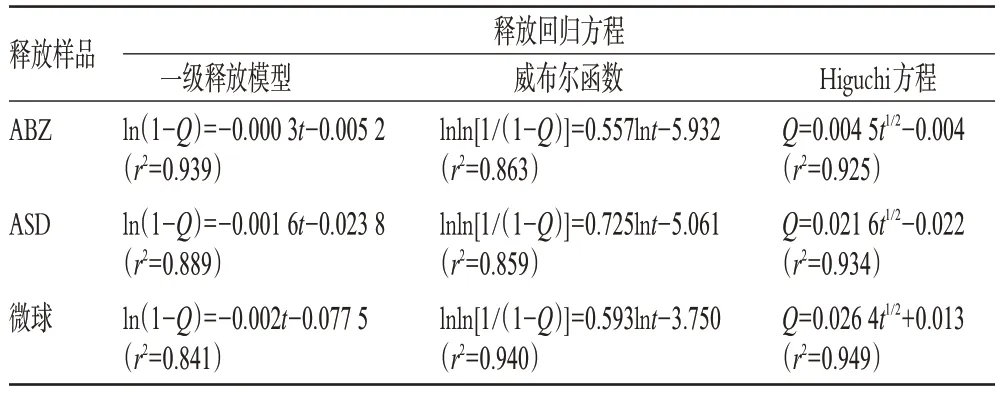
表6 3种样品释放曲线拟合方程Tab 6 Regression equations for drug release of 3 samples in vitro
以各方程的相关系数为指标,结果发现ASD和微球在介质中的释放行为按Higuchi方程拟合效果较好,且Higuchi系数分别为0.021 6、0.026 4,表明微球的释放模式符合壳聚糖微球的孔道扩散机制。同时释放曲线和拟合方程均显示所制备微球有显著的缓释效果。
6 讨论
ABZ水溶性极差,但易溶于冰醋酸,而壳聚糖易溶于稀酸溶液,将ABZ制备为亲水性材料固体分散体后,水溶性显著提高,降低了其对高浓度醋酸的依赖性,进而可均匀分散在壳聚糖的稀酸溶液中,为微球的制备提供了可能性;壳聚糖体内降解产物易被人体吸收,毒副作用小,在缓释给药系统中应用非常广泛。
以平均粒径、产率、包封率和载药量为指标筛选处方和制备工艺,结果表明转速是影响微球粒径大小及分布的主要因素,随着转速增大,微球的平均粒径逐渐减小,当转速低于500 r·min-1,平均粒径增大且分布不均。经过反复调整,最终确定以750 r·min-1的转速进行处方优化。同时,ASD的粉碎程度直接影响微球的圆整度,当ASD粉末不能过200目分样筛时,所制微球表面突起不平,不利于栓塞给药。
ASD能显著提高药物的溶解度,其原因主要是载体材料PEG可有效抑制药物结晶,使其成为无定形高分散的状态;固体分散体具有较大的表面积,随着可溶性载体的降解,药物可在骨架中缓慢释放。同时释放曲线显示,ASD溶出速率明显快于ABZ。本法制备的微球吸附药物较少,前期释放的药物主要是处于微球孔道内的药物,壳聚糖溶胀使得微孔口径减小甚至通道关闭,随后的药物释放通过骨架慢慢地扩散或通过壳聚糖的降解慢慢地释放。由释放曲线可知,通过乳化交联法制成的ASD壳聚糖微球具有良好的缓释性能。
固体分散体同时面临着贮放时间长后易老化的缺点,这是因为其中的药物物理结构发生了改变,成为无定形而存在,有转化为稳定的药物结晶的趋势。这可通过添加表面活性剂、多元载体等方法改进工艺等解决,本试验将制得的固体分散体在短期内制备成微球可以有效地防止其老化。经过优化工艺制备的微球表面光滑、球形圆整。通过筛选分级后得到不同粒径段的微球,可满足体内各大、中、小血管栓塞的要求。
[1]王建华,温 浩,孙殿甲.阿苯达唑的体内过程和剂型研究进展[J].中国寄生虫病防治杂志,2002,15(3):187.
[2]Venkatesan P.Albendazole[J].J Antimicrob Chemother,1998,41(2):145.
[3]张 波,张东娜,王洪权,等.难溶性药物增溶技术的研究进展[J].解放军药学学报,2009,25(5):425.
[4]杜光玲,赵燕燕,刘会芳,等.洛伐他汀固体分散体的制备和体外溶出度[J].中国医药工业杂志,2008,39(8):598.
[5]Lim ST,Mrtin GP,Berry DJ,et al.Preparation and evaluation of the in vitro drug release properties and mucoadhesion of novel microspheres of hyaluronic acid and chitosan[J].J Control Release,2000,66(5):281.
[6]徐晓弘,翟所迪.阿苯达唑固体分散物制备及体外溶出特性研究[J].中国药学杂志,2002,37(4):283.
[7]O’Donnell PB,McGinity JW.Preparation of microspheres by the solvent evaporation technique[J].Adv Drug Deliv Rev,1997,28(1):25.
[8]张学农,张 强,温 浩,等.乳化聚合法制备阿苯达唑聚氰基丙烯酸酯纳米球的方法比较及稳定性考察[J].中国药学杂志,2003,38(5):357.
[9]刘 纯,金梦瑶,张学农,等.丝素蛋白-壳聚糖双氯芬酸钠缓释微球的制备与特性研究[J].中国新药杂志,2009,18(16):1 566.
[10]国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅩC.
