苯溴马隆对罗格列酮在小鼠体内药动学的影响
2012-03-26李新春广西医科大学南宁530021
阮 冲,李新春,夏 爽(广西医科大学,南宁 530021)
罗格列酮(Rosiglitazone,Rog)为第2代噻唑烷二酮类(TZDs)衍生物,是选择性的过氧化物酶增殖体γ受体(PPAR-γ)激动药,近年来广泛应用于2型糖尿病的治疗。其作用机制主要是通过增加肌肉和脂肪组织对葡萄糖的摄取,抑制肝糖元的异生,增强胰岛素的敏感性,从而发挥降糖的作用[1]。苯溴马隆(Benzbromarone,Beb)属苯并呋喃衍生物,是一种新型的尿酸排泄促进剂,该药不仅能抑制肾小管对尿酸的重吸收,还可抑制嘌呤氧化酶,对降低尿酸具有双重功效,临床上主要用于高尿酸血症和痛风的治疗[2]。高尿酸血症(包括痛风)与糖尿病、高血压、高血脂以及胰岛素抵抗相关联,大约有14.1%的2型糖尿病患者合并有高尿酸血症[3],因此在糖尿病的治疗过程中可能会联合使用尿酸排泄剂(如Beb)。Beb是一种强效的细胞色素P450(CYP)2C9抑制剂[4],能够抑制多种CYP2C9的底物如甲苯磺丁脲、吲哚美辛等药物的代谢;Rog在肝脏内主要经CYP2C8代谢,CYP2C9也参与其体内的代谢过程[5],因此在Beb与Rog联合使用时,可能会对Rog的代谢产生影响。
近来,美国食品药品管理局(FDA)提出药物预警:Rog可能会增加心血管事件的风险[6],因而探讨联合用药情况下该药物在体内的代谢过程显得尤为必要。目前尚未有Rog与Beb联合使用时Rog药动学研究的报道。本研究拟建立高效液相色谱-荧光(HPLC-FLU)法,考察Beb对Rog在小鼠体内药动学的影响。
1 仪器与材料
1.1 仪器
HPLC仪,包括LC-10ATvp输液泵、RF-10Axl荧光检测器、5301PC荧光分光光度计(日本Shimadzu公司);超纯水发生器(美国Millipore公司);精密移液器(法国Gilson公司)。
1.2 试药
Rog对照品(江苏恒瑞医药股份有限公司,批号:20080518,纯度:99.5%);Beb原料药(广东东阳光药业有限公司,批号:080902,纯度:98.8%);甲醇、乙腈均为色谱纯,其余试剂均为国产分析纯。
1.3 动物
昆明种小白鼠110只,♀♂不拘,体重(20±1.5)g,购自广西医科大学实验动物中心,许可证号:SCXK(桂)2003-0003。
2 方法与结果
2.1 色谱条件
色谱柱:Kromasil C18(250 mm×4.6 mm,5 μm);流动相:乙腈-四氢呋喃-10 mmol·L-1KH2PO4(含0.2%三乙胺,H3PO4调pH至5.5)=45∶10∶45,使用前经0.45 μm微孔滤膜过滤和超声脱气,流速:1 mL·min-1;荧光检测波长:λex=247 nm、λem=370 nm;柱温:30 ℃;进样量:20 μL。
2.2 系统适用性试验
取空白血浆、Rog对照品溶液、空白血浆+Rog对照品溶液、血浆样品处理后,按“2.1”项色谱条件进样测定。结果显示,Rog峰形良好,保留时间约为6.8 min;理论板数按Rog计大于6 000;血浆中的内源性物质及代谢物不干扰Rog的出峰。取浓度为1 μg·mL-1的Rog对照品溶液重复进样6次,峰面积的RSD为1.6%。色谱见图1。
2.3 对照品溶液的制备
取Rog对照品25 mg,精密称定,置于25 mL量瓶中,加甲醇适量使溶解,定容到刻度,摇匀,得浓度为1 mg·mL-1的贮备液,置于4℃冰箱中保存。精密吸取贮备液适量,分别置于7个量瓶中,加甲醇稀释,使浓度分别为0.2、0.5、1、2、5、10、20 μg·mL-1。
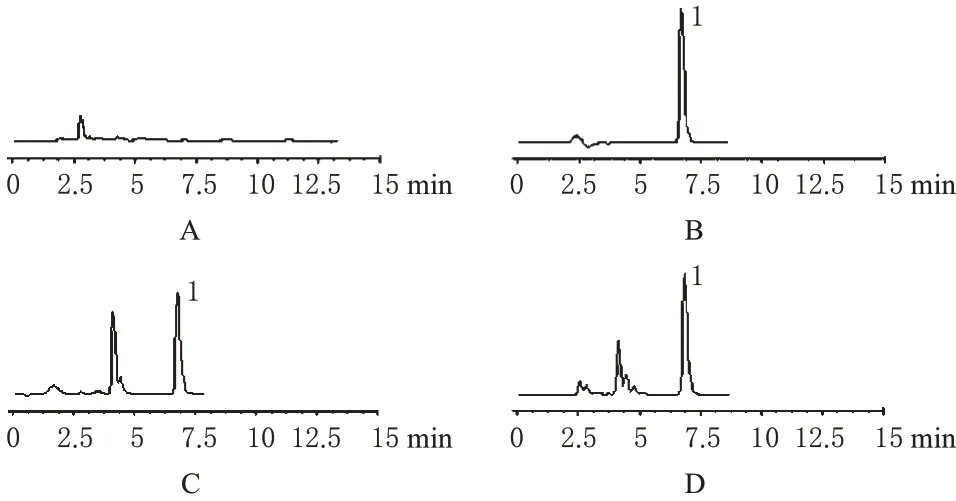
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.4 Rog荧光光谱考察
用甲醇制备浓度为1 μg·mL-1的Rog对照品溶液,以甲醇为空白,在荧光分光光度计上扫描,其最大激发波长和发射波长分别为247 nm和370 nm。
2.5 血浆样品的处理
精密吸取血浆0.2 mL,置于5 mL离心管中,加入pH8.0的磷酸盐缓冲液0.1 mL,涡旋混匀10 s,加入乙醚-二氯甲烷(2∶1,V/V)混合液2 mL,涡旋提取3 min,于3 500 r·min-1离心5 min,转移上清液1.0 mL至另一尖底离心管中,置于40℃水浴中,通N2流挥干,残渣用100 μL流动相复溶,涡旋混合30 s,8 000 r·min-1离心3 min,取20 μL进样。
2.6 标准曲线与检测限考察
精密吸取Rog对照品系列溶液各20 μL,分置于7个5 mL的离心管中,N2流挥干溶剂,加入空白血浆0.2 mL,混匀,得浓度分别为20、50、100、200、500、1 000、2 000 ng·mL-1的含药血浆样品,按“2.5”项下操作,记录药物色谱峰面积,以峰面积(A)对血药浓度(c)作加权回归计算。得回归方程:A=1.584×103c-236.5(r=0.999 7)。结果表明,Rog检测浓度的线性范围为20~2 000 ng·mL-1;按S/N>3∶1计,本方法的最低检出限为5 ng·mL-1。
2.7 回收率试验
按“2.6”项下方法用空白血浆制备Rog浓度分别为50、200、1 000 ng·mL-1的低、中、高浓度血浆样品,每种浓度重复5个样本,按“2.5”项下操作。以血浆样品中药物峰面积与相对应的Rog的峰面积之比,计算绝对回收率;用标准曲线计算得到的浓度值除以理论值,得相对回收率,结果见表1。
表1 回收率与精密度试验结果(±s,n=5)Tab 1 Results of recovery and precision of tes(t±s,n=5)
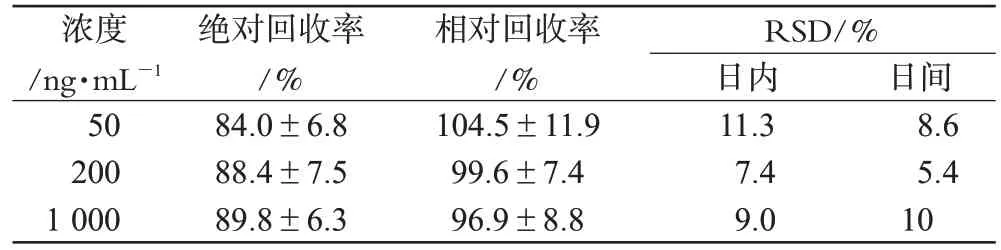
表1 回收率与精密度试验结果(±s,n=5)Tab 1 Results of recovery and precision of tes(t±s,n=5)
浓度/ng·mL-1 50 200 1 000绝对回收率/%84.0±6.8 88.4±7.5 89.8±6.3相对回收率/%104.5±11.9 99.6±7.4 96.9±8.8 RSD/%日内11.3 7.4 9.0日间8.6 5.4 10
2.8 精密度试验
取“2.7”项下方法制备处理后的低、中、高浓度血浆样品,分别在同日内测定,每个浓度平行分析5次,考察日内精密度;另3种浓度每日各测定1次,连续测定5 d,考察日间精密度。结果见表1。
2.9 给药方案
取小鼠随机分为单用组(Rog 0.2 mg·kg-1)和 联用组(Rog 0.2 mg·kg-1+Beb 5 mg·kg-1)组,每组55只,按人临床常用剂量换算灌胃给予相应药物,给药前12 h禁食,但全程不限饮水。将Rog和Beb分别用0.5%的羧甲基纤维素钠(CMCNa)溶液制成混悬液后进行灌胃。给药后分别于0.17、0.33、0.75、1.5、2.0、2.5、4.0、6.0、8.0、12.0、24.0 h随机处死5只小鼠抽取静脉血,合并同一时间点血样,置于肝素化的抗凝试管中,3 000 r·min-1离心5 min,分取血浆,置于-20 ℃冰箱中保存。
2.10 血药浓度的测定与药动学参数计算
用所建立的HPLC-FLU法测定“2.9”项下采得血浆中Rog的浓度。另外,用空白血浆制备浓度分别为75、250、1 500 ng·mL-1的含药血浆,作为质控(QC)样品,按“2.5”项下操作,每种浓度重复6次,记录色谱,采用3p97软件进行拟合。结果表明,Rog在小鼠体内过程符合一级吸收的一室模型(权重系数为1),药动学参数结果见表2。
3 讨论
目前关于Rog定量分析的方法有HPLC-紫外检测法及高效毛细管电泳法[7]、液质联用法[8]等。由于Rog的血药浓度低,利用紫外检测器时,其灵敏度达不到分析的要求;高效毛细管电泳法尽管具有极高的分离效能,但方法的精密度较差,制约了其在生物分析中的广泛使用。
Wang等[8]采用去蛋白方法处理血样,但这种方法不能使药物有效地富集,因此极大地降低了分析的灵敏度。考虑到Rog的血药浓度低,笔者前期分别尝试了乙醚、二氯甲烷和乙酸乙酯等有机溶剂进行提取,结果发现乙醚的提取效率低(小于70%),而后2种溶剂对Rog均有很高的绝对回收率。但由于单独采用二氯甲烷提取时,有机相位于下层,使得转移挥干的操作不便;而选用乙酸乙酯提取时,血浆中内源性物质对药物出峰存在着一定的干扰,遂尝试用乙醚-二氯甲烷混合溶剂提取,可有效地避免内源性物质的干扰。
本研究结果显示,联用Beb时,Rog的cmax和AUC0~24h均显著升高(P<0.05),提示Beb在小鼠体内可增强Rog的吸收,增加其生物利用度。这种效应是否会增加Rog所致的心血管风险还有待进一步的研究。
[1]Inqlis AM,Miller AK,Culkin KT,et al.Lack of effect of rosiglitazone on the pharmacokinetics of oral contraceptives in healthy female volunteers[J].J Clin Pharmacol,2001,41(6):683.
[2]Rodilla F,Sanchez-Beltran MJ,Izquierdo R,et al.Inhibition of purine catabolism by benzbromarone in isolated rat liver cells[J].Biochem Pharmacol,1988,37(19):3 561.
[3]曹雪霞,王 立.国产苯溴马隆治疗2型糖尿病合并高尿酸血症的疗效与安全性[J].中国新药杂志,2006,15(4):301.
[4]Locuson CW 2nd,Wahlstrom JL,Rock DA,et al.A new class of CYP2C9 inhibitors:probing 2C9 specificity with high affinity benzbromarone derivatives[J].Drug MeTab Dispos,2003,31(7):967.
[5]Baldwin SJ,Clarke SE,Chenery RJ.Characterization of the cytochrome P450enzymes involved in the in vitro metabolism of rosiglitazone[J].Br J Clin Pharmacol,1999,48(3):424.
[6]雷嘉川,宋金春.2008-2010年门诊药房口服抗糖尿病药应用分析[J].中国医院用药评价与分析,2011,11(9):786.
[7]Gomes P,Sippel J,Jablonski A,et al.Determination of rosiglitazone in coated tablets by MEKC and HPLC methods[J].J Pharm Biomed Anal,2004,36(4):909.
[8]Wang M,Miksa IR.Multi-component plasma quantitation of anti-hyperglycemic pharmaceutical compounds using liquid chromatography-tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,856(1-2):318.
