盐胁迫下黑果枸杞幼苗对外源甜菜碱的生理响应
2012-03-13米永伟郭凤霞王龙强
米永伟,陈 垣,2,郭凤霞,王龙强,2
(1.甘肃农业大学农学院,甘肃 兰州 730070; 2.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;3.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
盐碱地是地球陆地上分布较广泛的一种土地资源,随着现代工业和灌溉农业的发展,环境持续恶化,盐碱地的面积也在逐年扩大,盐碱地已成为全球重要的后备土地资源。我国从滨海到内陆,从低地到高原都分布着不同类型的盐碱土壤,它们主要分布于西北、华北、东北和滨海地区,总面积达到2 000万hm2,约占总耕地面积的10%[1]。在盐胁迫作用下,植物生长受到抑制[2],光合作用减弱,代谢失调[3],严重时出现植株萎蔫,甚至死亡。而许多高等植物,特别是藜科、禾本科植物,在盐胁迫下体内能大量积累甜菜碱(Glycine Betaine,GB)[4]。甘氨酸甜菜碱是一种在很大生理 pH 值范围内呈电中性的季铵类化合物,极易溶于水,广泛分布在植物、动物和细菌体内[5]。细胞中积累甜菜碱能提高细胞的渗透调节能力,稳定逆境条件(如高盐、冷害、冻害等)下酶和蛋白质复合物的结构和功能[6],能保护膜免受逆境伤害[7],维持膜的完整性[6]。近年来研究表明,外源甜菜碱能增强植株的抗盐性[8-9]。张士功等[10]认为外源甜菜碱能提高小麦(Triticumaestivum)幼苗抗盐性和对盐分胁迫的适应性。高雁等[11]研究表明,用甜菜碱处理能有效缓解盐胁迫对棉花(Gossypiumspp.)幼苗的伤害,并以施用 5 mmol·L-1甜菜碱效果较好。另外,陈传芳等[7]成功将山菠菜(Prunellaasiatica)甜菜碱醛脱氢酶BADH基因转入白三叶草(Trifoliumrepens),转基因植株的耐盐性有一定程度的提高。
黑果枸杞(Lyciumruthenicum)藏药称“旁玛”,系茄科枸杞属多年生灌木,具棘刺,多分布于我国山西北部、宁夏、甘肃、青海、新疆、西藏等省(区)的盐碱土荒地、盐化沙地、路旁等各种盐渍化土壤或荒漠环境,其味甘、性平,清心热,用于治疗心热病、心脏病、月经不调、停经等病症[12]。目前,关于枸杞属植物的研究主要集中在枸杞上,许多学者已对枸杞的栽培、引种繁育、加工、果实的成分及药理方面做了大量研究,并取得了显著成果,而对同属植物黑果枸杞的研究主要集中在天然花色苷色素和多糖提取工艺及药理研究方面[13-15],关于其耐盐生理机制及对盐胁迫下的生理反应方面的研究报道还不多见。因此,本试验通过研究盐胁迫下黑果枸杞幼苗对甜菜碱的生理响应,分析甜菜碱在盐胁迫下对黑果枸杞幼苗生长中的作用,旨在为黑果枸杞耐盐性研究和提高其幼苗对盐分胁迫的适应性及引种驯化、西北盐渍土生物防治等提供理论依据。
1 材料与方法
1.1试验材料 供试黑果枸杞种子采自甘肃省民勤县东坝镇盐碱沙荒地,为多年生野生种。将采集的黑果枸杞种子表面附着的色素、杂质洗净后,挑选饱满度、外观(大小、性状、色泽)基本一致的种子,经70%酒精消毒15 min,清水冲洗干净后,自然晾干备用。甜菜碱为 BBI 公司生产的盐酸甜菜碱。
1.2试验处理 试验于2009年7月进行,将处理后的黑果枸杞种子播种于装有经高温灭菌土壤的、内径为15 cm的花盆中,置于昼夜温度为25 ℃/20 ℃、光照变幅为12 h/12 h、相对湿度为75%的人工气候箱内培养,每天用定量的Hogland营养液进行根灌。出苗后每盆留苗10株,到幼苗高度达8~9 cm时开始处理。试验共设置5个处理如表1(配置母液均为Hogland营养液),每个处理5盆,重复3次,第1次处理(浇灌)后,以后每隔3 d用相应处理的Hogland营养液等量灌溉,直至胁迫结束。处理后第7和14 天采集相同叶龄的黑果枸杞幼苗叶片进行各项生理指标的测定。

表1 试验处理Table 1 Treatments design in this experiment
1.3测定项目及方法 各指标的测定均参考高俊凤[16]的方法。叶绿素含量采用95%乙醇提取法;细胞质膜透性采用DDS-11A型电导率仪法,以相对电导率表示细胞膜相对透性;膜脂过氧化产物丙二醛含量采用硫代巴比妥酸(TBA)法;脯氨酸含量采用酸性茚三酮法;可溶性糖含量采用蒽酮比色法。

1.4统计分析 试验数据用SPSS 11.5软件进行统计分析,采用Duncan法进行显著性分析。
2 结果与分析
2.1外源甜菜碱对盐胁迫下黑果枸杞叶绿素含量的影响 盐胁迫下,黑果枸杞叶片叶绿素(Chl)总量在第7天极显著高于对照(P<0.01),Chl a/Chl b却极显著低于对照(第7和14天)。盐胁迫下,处理第7天,添加外源甜菜碱(T2和T3)的叶绿素总量与未添加处理差异不显著(P>0.05),但到处理第14天时,添加甜菜碱处理叶绿素总量和Chl a/Chl b均极显著高于未添加处理,与处理第7天相比,T3、T4和T5的叶绿素总量和Chl a/Chl b分别增加0.9%、14.3%、11.0%和7.3%、6.8%、6.6%(表2)。
2.2外源甜菜碱对盐胁迫下黑果枸杞细胞质膜透性的影响 盐胁迫下,未添加外源甜菜碱处理的黑果枸杞叶片相对电导率在第7和14天均极显著高于对照,分别高130.0%和194.7%,盐分胁迫对叶片质膜透性的伤害率为1.30%和1.95%。盐胁迫下,处理第7天,所有添加外源甜菜碱处理的黑果枸杞幼苗叶片相对电导率、膜透性伤害率都明显较未添加处理低,其中叶片相对电导率分别较盐处理降低20.32%、26.39%和29.85%,膜透性伤害率分别是盐处理的64.55%、53.35%和47.57%;随着胁迫时间的延长,各甜菜碱处理中的质膜透性均比未添加处理显著下降,叶片相对电导率分别降低22.37%、31.31%和36.21%,膜透性伤害率较未添加处理分别降低33.44%、47.27%和54.51%,且差异达到极显著水平(P<0.01)(表3)。
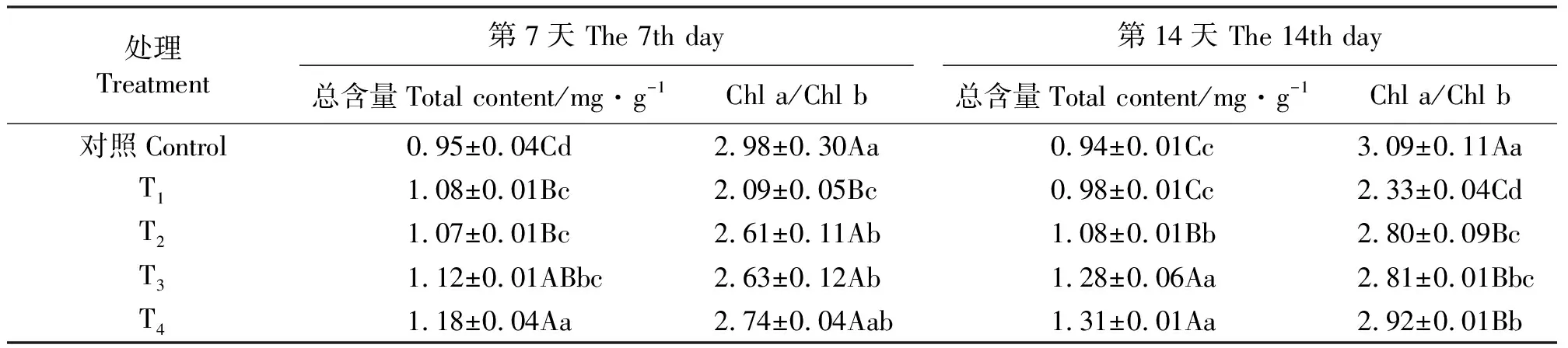
表2 外源甜菜碱对盐胁迫下黑果枸杞叶片叶绿素含量的影响Table 2 Effects of GB on chlorophyll content in leaves of Lycium ruthencium seedlings under salt stress
2.3外源甜菜碱对盐胁迫下黑果枸杞叶片中丙二醛含量的影响 盐胁迫下,黑果枸杞叶片中过氧化产物MDA含量极显著增加(P<0.01),其中处理第7和14天叶片MDA含量分别比同时间下的对照增加了137.59%和134.61%。盐胁迫下,在处理第7和14天,添加外源甜菜碱各处理中的MDA含量均显著低于未添加处理,且随甜菜碱浓度的增加其含量逐渐下降,当外源加入2.0 mmol·L-1甜菜碱时,幼苗叶片MDA含量分别是未添加处理的62.86%和56.47%(表4)。
2.4外源甜菜碱对盐胁迫下黑果枸杞叶片中脯氨酸含量的影响 盐胁迫下,黑果枸杞叶片中脯氨酸含量较对照极显著增加,在处理第7和14天,分别比对照增加了388.96%和253.89%。在处理第7天,各添加外源甜菜碱处理均极显著高于未添加处理,分别比未添加处理增加了24.99%、108.92%和43.36%;随着处理时间延长,各甜菜碱处理中脯氨酸含量仍极显著高于未添加处理,分别比未添加处理增加了47.20%、113.48%和36.13%,且甜菜碱浓度为1.0 mmol·L-1时,其含量达到最大,是对照的7.55倍。与处理第7天相比,处理第14天时T2、T3和T4中的脯氨酸含量分别增加了29.73%、12.57%和4.61%,且增幅逐渐减小(表4)。

表3 外源甜菜碱对盐胁迫下黑果枸杞叶片相对电导率和伤害率的影响Table 3 Effects of GB on relative conductivity and harm rate in leaves of L.ruthencium seedlings under salt stress %

表4 外源甜菜碱对盐胁迫下黑果枸杞叶片丙二醛和脯氨酸含量的影响
2.5外源甜菜碱对盐胁迫下黑果枸杞叶片中可溶性糖含量的影响 盐胁迫下,黑果枸杞叶片中可溶性糖积累,分别比对照同期增加8.50%和25.79%。处理第7天时,处理T2、T3和T4中的可溶性含量分别比未添加处理增加了31.57%、39.30%和7.93%;在处理第14天时,可溶性糖含量随甜菜碱浓度增加而增加,当增加至1.0 mmol·L-1后变化不再显著。与处理第7天相比,处理第14天时各甜菜碱处理中的可溶性糖含量均显著增加,其增幅分别为29.43%、30.21%和24.61%(表5)。

表5 外源甜菜碱对盐胁迫下黑果枸杞叶片可溶性糖含量的影响 Table 5 Effects of GB on soluble sugar content in leaves of L.ruthencium seedlings under salt stress mg·g-1
3 讨论与结论
甜菜碱作为一种非毒性的渗透调节物质,主要分布于植物叶绿体和细胞质中,在叶绿体中合成,当植物受到环境胁迫时细胞内能够积累从而降低渗透势,同时,甜菜碱还能作为保护物质维持生物大分子的结构和完整性,维持植物正常的生理功能和代谢活动[17]。近年来的研究表明,甜菜碱作为渗透调节剂,可促进植物的生长并能提高植物的抗盐性。如赵博生等[18]指出在盐胁迫条件下,甜菜碱有利于植物对光能的捕获和转换,明显促进植物生长,降低盐胁迫对植物的抑制作用。谈建中等[19]发现,叶面喷施甜菜碱可有效缓解盐胁迫对桑树(Morusalba)生长的抑制,从而提高其抗盐性。Khalid和Muhammad[20]研究也表明,叶片喷洒100 mmol·L-1甜菜碱可以增加盐胁迫下玉米(Zeamays)叶片的相对含水量和减少叶片的渗透势。此外,Farooq等[21]研究发现,外源甜菜碱可以增加低温胁迫玉米叶片中可溶性糖和可溶性蛋白的含量。
在盐胁迫环境下,甜菜碱除了作为渗透调节剂发挥渗透调节作用以外,还具有其他的生理功能,如不同程度地提高植物细胞内超氧化物歧化酶和过氧化物酶等细胞保护酶的活性,降低活性氧自由基对质膜的伤害和膜脂过氧化作用水平,维持细胞质膜的稳定性和完整性[10]。此外,甜菜碱还能在一定程度上限制植物幼苗对Na+、K+、Cl-吸收,提高体内K含量及向上运输效率,降低地上部分对Na+、K+的选择性[22]。
本研究表明,盐胁迫对黑果枸杞幼苗各生理指标都有显著影响,主要是细胞质膜透性、可溶性糖和脯氨酸含量主动积累增加,而叶绿素总量、Chl a/Chl b和MDA含量都极显著降低,且随着胁迫时间的延长各生理指标均变化显著。说明黑果枸杞幼苗在遭受盐胁迫后,光系统Ⅱ活性降低,叶片光合能力下降,导致光能利用率和同化率受到抑制,促进了活性氧的生成和脂质过氧化,膜系统受损,质膜透性加大,从而影响了膜的正常生理功能[23-24]。同时,细胞中积累了脯氨酸、甜菜碱、甘油、有机酸、可溶性糖等小分子有机物和多种无机盐离子,以维持较高细胞质渗透压,利于黑果枸杞幼苗在盐分环境下对水分的吸收[25],从而抵御外来干扰。而在300 mmol·L-1NaCl盐胁迫下对黑果枸杞幼苗直接施用甜菜碱后发现,外源甜菜碱能不同程度地降低对质膜的伤害和膜脂过氧化程度,维持细胞质膜的稳定性和完整性,表现在叶片相对电导率、膜伤害率和膜内不饱和脂肪酸的过氧化作用产物MDA含量的显著降低。另外,外源甜菜碱还促进幼苗体内游离脯氨酸和可溶性糖的进一步积累,从而提高细胞的渗透调节能力,减缓盐胁迫对黑果枸杞幼苗的伤害。说明盐胁迫下施用适宜浓度的甜菜碱可改善黑果枸杞幼苗的耐盐能力和提高对盐胁迫逆境的适应性,促进其生长,为黑果枸杞的引种驯化、种质资源的保护以及西北盐碱地的合理利用提供理论依据。
[1] 徐恒刚.中国盐生植被及盐渍化生态[M].北京:中国农业科学技术出版社,2004:23-25.
[2] 陈兰,黄广远.多效唑对盐胁迫下高羊茅耐盐性的作用[J].草业科学,2009,26(8):177-180.
[3] 时丽冉,牛玉璐,李明哲.苣荬菜对盐胁迫的生理响应[J].草业学报,2010,19(6):272-275.
[4] 梁峥.甜菜碱和甜菜碱醛脱氢酶[J].植物生理学通讯,1995,31(1):1-8.
[5] Prasad K V S K,Saradhi P P.Enhanced tolerance to photoinhibition to transgenic plants through targeting of glycinebetaine biosynthesis into the chloroplasts[J].Plant Science,2004,166(5):1197-1212.
[6] Gorham J.Betaines in higher plants-biosynthesis and role in stress metabolism[J].Amino Acids and Their Dericatices in Higher Plants,1995,171-203.
[7] 陈传芳,李义文,陈豫,等.通过农杆菌介导法获得耐盐转甜菜碱醛脱氢酶基因白三叶草[J].遗传学报,2004,31(1):97-101.
[8] Holmstrom K O,Somersalo S,Mandal A,etal.Improved tolerance to salinity and low temperature in transgenic tobacco producing glycine betaine[J].Journal of Experimental Botany,2000,51(343):177-185.
[9] 张士功,高吉寅,宋景芝.外源甜菜碱对盐胁迫下小麦幼苗体内几种与抗逆能力有关物质含量以及钠钾吸收和运输的影响[J].植物生理学通讯,2000,36(1):23-26.
[10] 张士功,高吉寅,宋景芝,等.甜菜碱对小麦幼苗生长过程中盐害的缓解作用[J].北京农业科技,1998,16(3):13-17.
[11] 高雁,娄恺,李春.盐分胁迫下棉花幼苗对外源甜菜碱的生理响应[J].农业工程学报,2011,27(1):244-248.
[12] 陈海魁,蒲凌奎,曹君迈,等.黑果枸杞的研究现状及其开发利用[M].黑龙江农业科学,2008(5):155-157.
[13] 李进,瞿伟菁,吕海英,等.黑果枸杞色素的提取和精制工艺研究[J].天然产物研究与开发,2006,18:650-654.
[14] 汪建红,陈晓琴,张伟佼.黑果枸杞果实多糖生物功效及其机制研究[J].食品科学,2009,30(5):244-248.
[15] 冯薇,何恩鹏,陈晓琴,等.黑果枸杞果实多糖对小白鼠运动能力影响及量效研究[J].干旱区研究,2009,26(4):586-590.
[16] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:72-163.
[17] Atsushi S,Norio M.Genetic engineering of glycinebetaine synthesis in plants:Current status and implications for enhancement of stress tolerance[J].Journal of Experimental Botany,2000,51(342):81-88.
[18] 赵博生,衣艳君,刘家尧.外源甜菜碱对干旱/盐胁迫下的小麦幼苗生长和光合功能的改善[J].植物学通报,2001,18(3):378-380.
[19] 谈建中,承建平,孙丙耀,等.外源甜菜碱对桑树抗盐生理的影响及其作用机理的研究[J].蚕业科学,2005,31(4):404-408.
[20] Khalid N,Muhammad A.Improvement in salt tolerance of maize by exogenous appllcation of glycinebetaine:Growth and water relations[J].Pakistan Journal of Botany,2007,39(5):1647-1653.
[21] Farooq M,Aziz1 T,Hussai M,etal.Glycinebetaine improves chilling tolerance in hybrid maize[J].Journal of Agronomy and Crop Science,2008,194:152-160.
[22] 张士功,高吉寅,宋景芝.盐分胁迫条件下甜菜碱对小麦幼苗体内Na+、K+和Cl-的含量及其分布的影响[J].西北植物学报,1999,19(2):278-283.
[23] 薛延丰,刘兆普.钙离子对盐胁迫下菊芋幼苗生长、生理反应和光合能力的影响理论[J].农业工程学报,2006,22(9):44-47.
[24] 朱新广,张其德.胁迫对光能利用和耗散的影响[J].生物物理学报,1999,15(4):787-791.
[25] 毛桂莲,许兴,许兆桢.植物耐盐生理生化研究进展[J].中国生态农业学报,2004,12(1):43-46.
