CBF1基因转化饲草玉米SAUMZ1提高抗寒性的研究
2012-03-13向白菊李成君
向白菊,李成君,张 健,罗 艺,蒋 安
(重庆市畜牧科学院,重庆 402460)
饲草玉米SAUMZ1(Zeamays)是四川农业大学的科研人员以玉米和具有相关优良基因的近缘种属[大刍草(Z.diploperennis)等]为亲本材料,采用分子育种技术,进行种质创新,经过多年选育而成的一个产量高、饲用品质优良、适应性广的多年生优质饲草玉米[1]。研究表明,饲草玉米SAUMZ1适合在重庆地区推广利用,但其越冬情况较差,中海拔地区越冬率较低,自然越冬率为21.4%;低海拔地区自然越冬率为60.5%,在大部分地区难以实现多年生长和利用[2]。如果通过育种技术增强饲草玉米的抗寒能力,提高其在寒冷地区的越冬率,拓宽牧草生长的地理范围,就可以提高草种利用效率,延长生长时间,提高牧草产量和品质,从而增加种植饲草玉米的经济效益。
与传统育种方法相比,植物基因工程育种周期短、见效快,打破了物种之间生殖隔离障碍,大大扩展了育种的范围,在牧草遗传育种中占有越来越重要的地位。CBF(C-repeat Binding Factor)基因是一类受低温诱导的反式作用因子,其编码产物能与多个抗逆基因启动子上的顺式作用元件CRT/DRE特异结合,从而启动下游多个冷诱导和脱水诱导基因的表达[3-4],激活植物体内的多种耐逆机制,并且它极有可能是控制抗寒基因表达的主开关[5]。CBF转录因子的发现为植物耐逆性的改良研究提供了新的思路[6],该转录因子在改良植物耐寒性方面具有广泛的应用前景。目前,许多国内外研究机构已经通过导入CBF基因来提高作物的抗寒性[7],在水稻(Oryzasativa)、烟草(Nicotianatobacum)、油菜(Brassicacampestris)、草莓(Fragariaananassa)、番茄(Solanumlycopersicum)、小麦(Triticumaestivum)、高羊茅(Festucaarundinacea)、胡杨(Populuseuphratica)等植物上获得了成功[8-9]。甄伟等[10]将CBF1转入油菜和烟草中,电解质渗漏法检测转基因植株的抗寒性的结果显示,转基因油菜植株的抗寒性比对照植株明显提高,转基因烟草植株的抗寒性也有一定程度的提高。金万梅等[11]用根癌农杆菌介导法将拟南芥的冷诱导转录激活因子CBF1导入草莓中,抗寒生理鉴定结果表明,CBF1基因可以提高草莓对低温胁迫的抵抗力。
本研究开展拟南芥CBF1转化饲草玉米SAUMZ1,并对转基因饲草玉米的抗寒性进行鉴定分析,以期揭示出玉米基因组中CBF1类似转录激活因子是否调控抗寒基因,明确利用拟南芥CBF1转录激活因子来创新饲草玉米抗寒新材料的可行性,以期为培育具有较高抗寒能力的转基因饲草玉米新品种奠定基础。
1 材料与方法
1.1材料 植物材料饲草玉米SAUMZ1由四川农业大学玉米研究所提供;农杆菌LBA4404、真核表达载体pBI121和其他菌种、质粒为西南大学花卉实验室提供;序列测定由上海生物技术公司完成;各种核酸限制性内切酶、DNA连接酶等为宝生物工程(大连)有限公司生产;所有引物由北京奥科生物技术公司合成。分化培养基:MS+0.5 mg·L-16-BA+100 μg·mL-1Kan+0.2 mg·L-1NAA;继代培养基:MS+0.5 mg·L-16-BA;生根培养基:MS+0.2 mg·L-1NAA+2.0 mg·L-1IBA。
1.2方法
1.2.1拟南芥CBF1的克隆
1)引物设计
根据NCBI上公布的拟南芥CBF1基因序列设计一对引物,引物序列如下:
上游引物(CBF1-UP)为:5′- C■GTACTCTGATCAATGAACTCATT-3′;
下游引物(CBF1-DOWN):5′-C◆GGAAACGACTATCGAATATTAGT-3′。
其中,■为BamHI酶切位点GGATCC,◆为SacI酶切位点GAGCTC。
2)CBF1基因序列的克隆
采用分别加入BamHI和SacI酶切位点的上游引物(CBF1-UP)和下游引物(CBF1-DOWN)扩增拟南芥(哥伦比亚野生型)基因组DNA,PCR扩增体系为20 μL,扩增反应条件为:95 ℃预变性5 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,共循环35次,72 ℃延伸10 min,在18 ℃时结束反应。将PCR产物连接T-Easy载体,转化大肠杆菌DH5α感受态,挑取阳性克隆,用含卡拉霉素的液体LB摇菌培养过夜,获得含目的基因序列的菌体。
1.2.2对扩增出的序列进行初步分析 从拟南芥基因组DNA扩增出的序列中挑选一个单克隆进行测序,将测序结果与GenBank登陆的CBF1基因序列用DANMAN软件进行对比分析,初步分析其功能属性。
1.2.3植物表达载体的构建 质粒DNA提取、大肠杆菌感受态细胞的制备以及酶切、连接等植物表达载体构建过程参考文献[12-13]。采用冻融法[12]将植物表达载体转入农杆菌中。
1.2.4农杆菌感受态的制备(CaCl2法)
1)挑选LBA4404农杆菌单菌落,接种于含Sm 125 mg·L-1的5 mL YEB液体培养基中,28 ℃下摇菌2 d(250 r·min-1)。
2)将过夜活化的菌液2 mL转入新鲜YEB液体培养基50 mL中,28 ℃下摇菌至OD600 nm值0.5,冰浴30 min。
3)4 ℃,5 000 r·min-1,离心5 min,去除上清液,收集菌体。
4)加10 mL冷的0.15 mol·L-1的NaCl重悬浮菌体,4 ℃下5 000 r·min-1离心5 min,倒掉上清液。
5)用1 mL冷的CaCl2(20 mmol·L-1)重悬浮菌体,加入15%~20%的甘油。
6)分装成每管100 μL,液氮中冷冻后置于低温冰箱-80 ℃保存。
1.2.5饲草玉米SAUMZ1的转化 无菌的饲草玉米SAUMZ1嫩叶沿着横向切成2 mm左右的小条,在农杆菌菌液中浸泡20 min。用无菌滤纸吸干叶片表面的菌液,转入上面铺有一层滤纸的MS基本培养基,在28 ℃下暗培养3 d,然后转到含有抗生素的分化培养基中进行培养。待抗性芽生长为2~3 cm高时转入生根培养基中诱导生根。
1.2.6转基因植株的PCR检测 用CBF1基因引物(CBF1-UP和CBF1-DOWN)对转基因再生植株总DNA进行PCR扩增,电泳检测是否扩增出了CBF1转录因子基因的片段。
1.2.7相对电导率的测定 本试验采用人工模拟冷冻试验分析转基因植株玉米草抗寒性,选取玉米草幼苗,用去离子水冲洗2~3次,再用滤纸吸干表面水分,剪成1 cm长的小段放入10 mL的离心管中,每个处理3个重复,分别放入-4、-8、-12、-16 ℃低温中处理30 min后取出,置于4 ℃的冰箱30 min后,加入5 mL去离子水,真空抽气7 min,然后静置1.5 h,用DDS-ⅡA型电导仪测定电导率,然后将样品置于沸水浴15 min,使质膜完全破坏,取出在自来水中冷却5 min,冷却至室温后再次测定电导率,按以下公式计算低温胁迫对植物相对电导率[14]。

2 结果
2.1拟南芥CBF1的克隆 本试验从拟南芥(哥伦比亚野生型)的基因组DNA中扩增出一段686 bp长的序列,挑选单克隆进行测序,初步分析发现该序列包含一个642 bp的最大开放阅读框。用DANMAN软件将所测序列与GenBank登陆的CBF1基因序列进行比较分析,结果显示二者同源性高达99.84%。所测序列第426位碱基G被置换成A,导致第142位的一个氨基酸与GenBank上的不同,但这一位置并不在CBF1转录因子的功能结构域上,推测这一处碱基的变化并不会影响其基因功能。因此,所克隆到的产物应该具有正常的生理功能。
2.2植物表达载体构建
2.2.1构建流程 因为植物表达载体pBI121中的Gus基因两端带有限制性内切酶BamHI和SacI酶切位点,所以设计引物(CBF1-UP和CBF1-DOWN)时特意加入了这两个酶切位点,扩增出的CBF1基因序列两端也就有了这两个位点。同时,载体pBI121带有NptⅡ基因序列,可用于筛选被转化细胞,它还带有CaMv35s启动子,能启动双子叶植物细胞中外源基因的表达。因此,本试验利用BamHI和SacⅠ这两个酶切位点将pBI121的Gus结构序列(1.9 kb)切除,并同时保留了CaMv35s启动子、Nos终止子等其他部分,总长为10.9 kb,将这部分序列与约686 bp长的CBF1基因序列连接之后,就构建成了一个植物表达载体,命名为pBI121-CBF1(图1)。
2.2.2植物表达载体酶切鉴定 将重组质粒pBI121-CBF1用限制性内切酶BanmHI和SacI进行酶切,凝胶电泳结果显示获得了长约0.7和10.9 kb的两个条带,与预期结果相符,证实重组质粒中含有目的基因CBF1片段(图2)。
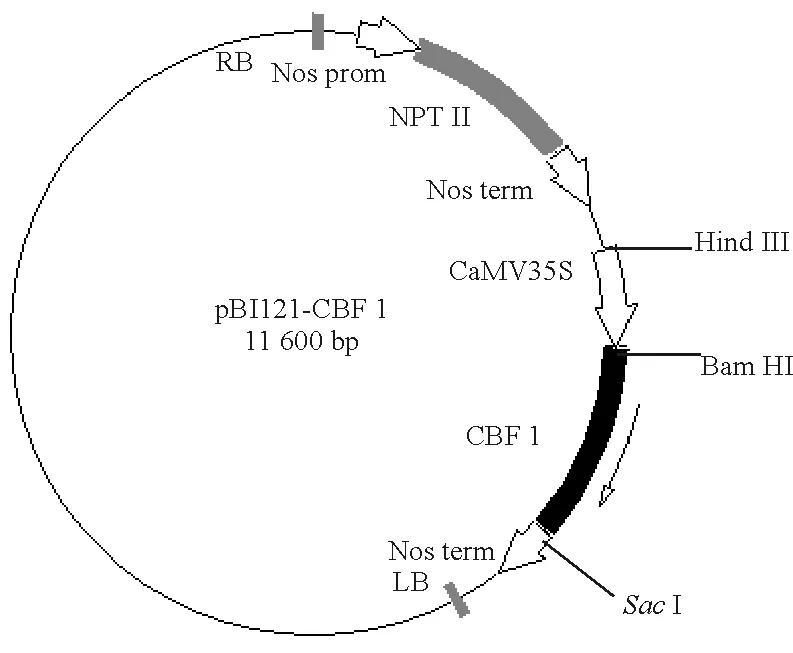
图 1 pBI121-CBF1植物表达载体图谱Fig.1 Map of plant expression vector pBI121-CBF1
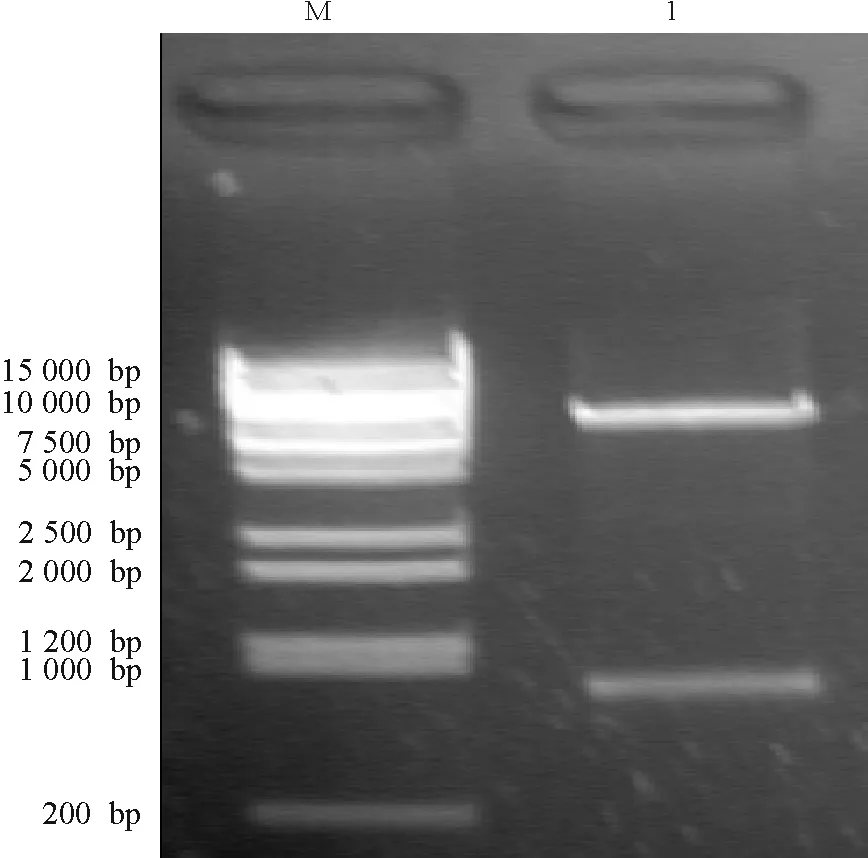
图2 酶切鉴定重组质粒pBI121-CBF1Fig.2 Result of enzyme digestion of pBI121-CBF1
取上述玉米草抗性植株和对照植株的总DNA,用加入BanmHI和SacI酶切位点引物(CBF1-UP和CBF1-DOWN)直接对总DNA进行PCR,结果从抗性植株总DNA中扩增出了预期的约686 bp的片段,而对照组则没有(图3),表明拟南芥CBF1基因已整合到玉米草基因组中。
2.4转基因玉米草低温下相对电导率的变化 对所获转基因玉米草在低温胁迫下的相对电导率的测定结果表明,玉米草植株经过低温胁迫后,随着处理温度的降低,其相对电导率的变化呈上升趋势,且变化明显,转基因饲草玉米SAUMZ1叶片相对电导率在各种低温下均比对照组低,说明转基因植株的细胞膜受低温伤害程度小于对照组(图4)。

图3 转基因植株的PCR鉴定Fig.3 PCR detection of transgenic plants
3 讨论
低温是危害和限制我国农业生产的重要因素,而农作物的抗寒性是由多个基因控制的数量性状。近年来的研究表明,CBF1是一个冷诱导转录激活因子,能够调控下游多个抗寒基因的表达,因此,转入CBF1基因是提高植物耐寒性的一条有效途径。实践证明,过量表达CBF1基因可以提高水稻、小麦等农作物的抗寒性。本研究将克隆到的拟南芥CBF1基因转入饲草玉米SAUMZ1中也获得了抗寒性增强的转基因玉米草新材料。
植物细胞电解质渗出率是用来衡量细胞内溶物扩散到细胞外程度的一项生理指标[15],也是衡量细胞质膜是否受伤害和细胞组织幼嫩程度的指标。由于植物细胞膜是细胞内外物质交换的主要通道,在环境胁迫下,细胞膜最为敏感,当低温胁迫时,伤害最先发生于细胞膜系统,造成膜脂过氧化作用增强,膜透性增大,离子发生泄漏,最终可以导致植物死亡[16-17]。因此,本研究采用低温胁迫下细胞相对电导率方法检测植株抗寒能力。植株体细胞的相对电导率能够反映细胞膜受损害的程度,相对电导率越高,则细胞膜受伤害就越严重。本研究表明,转基因植株的相对电导率随温度降低而呈现上升趋势,在不同低温胁迫下,转基因植株的相对电导率均低于对照组。由此可以判断,转基因玉米草植株在低温胁迫时相对于对照组的细胞膜结构较为稳定,细胞受伤害程度较低,表明植株抗寒性有所提高。

图4 低温胁迫后相对电导率的变化Fig.4 Change of cell membrane permeability after chilling stress
[1] 王琳,范彦,何玮,等.饲草玉米SAUMZ1不同生育期饲用价值的分析[J].饲料研究,2007(7):3-6.
[2] 范彦,何玮,王琳,等.玉米新材料——饲草玉米SAUMZ1在重庆地区的生产性能评定[J].草业与畜牧,2007(12):15-18.
[3] Stockkinger E J,Gilmour S J,Thomashow M F.Arabidopsis thalianaCBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE,a cis-acting DNA regulatory element that stimulate stranscription in response to low temperature and water deficit[J].Proceedings of the National Academy of Sciences USA,1997,94:1035-1040.
[4] Ito Y,Katsura K,Maruyama K,etal.Functional analysis of rice DREB1/CBF-type transcription factors involved in cold-responsive gene expression in transgenic rice[J].Plant Cell Physiology,2006,47(1):141-153.
[5] Thomashow M K.So what’s new in the field of plant cold acclimation lots[J].Plant Physiology,2001,125(1):89-93.
[6] 王洋,胡吉吉,王崇英,等.拟南芥CBF/DREB途径的研究进展及其在植物基因工程中的应用[J].生物物理学报,2007,23 (2):101-108.
[7] 刘强,赵南明.DREB转录因子在提高植物抗逆性中的作用[J].科学通报,2000,45(1):11-16.
[8] 张丽丽,李景富,王傲雪,等.转录激活因子CBF1基因在植物抗冷分子机制中的作用[J].园艺学报,2008,35(5):765-771.
[9] 吴关庭,陈锦清,胡张华,等.根癌农杆菌介导转化获得耐逆性增强的高羊茅转基因植株[J].中国农业科学,2005,38(12):2395-2402.
[10] 甄伟,陈溪,孙恩洋,等.冷诱导基因的转录因子CBF1转化油菜和烟草及抗寒性鉴定[J].自然科学进展,2000,10(12):1104-1109.
[11] 金万梅,董静,尹淑萍,等.冷诱导转录因子CBF1转化草莓及其抗寒性鉴定[J].西北植物学报,2007,27(2):0223-0227.
[12] Sambrook J, Russell D W.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2005.
[13] 王关林,方宏钧.植物基因工程原理与技术[M].北京:科学技术出版社,1998.
[14] 房义福,吴晓星,李长贵,等.电导法对11种常绿阔叶树种抗寒性的测定[J].东北林业大学学报,2007,35(12):16-17.
[15] 王连敏,王立志,张国民,等.苗期低温对玉米体内脯氨酸、电导率及光合作用的影响[J].中国农业气象,1999,20(2):28-30.
[16] 王以柔.在黑暗和光照条件下低温对水稻幼苗光合器官膜脂过氧化作用的影响[J].植物生理学报,1986,12(3):244-251.
[17] Badawi M,Danyluk J,Boucho B,etal.TheCBFgene family in hexaploid wheat and its relationship to the phylogenetic complexity of cerealCBFs[J].Molecular Genetics and Genomics,2007,277(5):533-554.
